Оглавление:



Металлохимические свойства элементов
- Химические свойства металлов. Характер взаимодействия элементов И друг друга во многом определяет их электроотрицательная разница Концентрация электронов(количество приходящих валентных электронов Для каждого атома формулы единица вещества и вид валентности Электронная орбиталь) и соотношение атомных размеров Комплектующие.
- В образовании интерметаллических фаз роль электроотрицательных различий Не может быть решающим. Элемент слева Эквивалентное значение электроэк от границы Zintl*- Разница и разница не превышает 0,8. электроэк-при оценке различий Значение химической реакции металла, значение должно быть использовано Характеризовать элемент в окисленное состояние
Более высокое состояние окисления не может быть достигнуто в Тарике phase. Людмила Фирмаль
To определить Роль взаимодействий металлов、 Плотность и размеры перевозки. Разница между простыми и переходными металлами、 Сравнение атомных радиусов, d -, / — элементов、 радиус чем sp metal. In кроме того, разница в атомном радиусе sp- Есть гораздо больше аналоговых элементов, чем десятилетия плагина elements. So … В металлах группы IA радиус изменяется от 0,250 Rb до 0,150 Нм Li.
Атомный радиус всех радиочастотных элементов колеблется от 0,124 до 0,181 Нм. В дальнейшем атомный радиус металла y близок, что является 3-м Вне энергетического уровня. Поэтому все элементы лантаноидов являются Атомный радиус в диапазоне 0.174-0.183 Нм. Разница между простыми и переходными металлами、 Электронный раствор концентрации.
Электронная плотность равна — Общее число валентных электронов на атом, и некоторые из них Условная граница, которая проходит через элементы квази-длинный Ива группа, P- Периодическая система Менделеева (см. таблицу 4). Электроны взаимодействуют с образованием металлических связей, и некоторые из них Обмен может участвовать в образовании ковалентных связей. Таким образом, концепция Электронная плотность и плотность электронов проводимости всегда Match.
In щелочные и щелочноземельные металлы, валентные электроны Полностью отдано в коллективное пользование. Переходные элементы имеют нечто общее Число валентных электронов увеличивается, но число электронов, участвующих в нем, увеличивается. Образование металлических связей колеблется в тех же пределах(в среднем 1-2 Электроны на атом).Однако прочность связи кристаллов D-элемента имеет важное значение
- Но для более высоких общих взаимодействий Новая муфта d-rf. Поэтому эти элементы являются кристаллическими В этом состоянии это не чистая металлическая связь, а ковалентная металлическая связь. Исходя из металлических химических свойств элементов, учитываемых、 Анализ общих закономерностей взаимодействия металлов Хом.
Интерметаллическое взаимодействие сводится к следующим основным видам: Pam: образование ограниченного твердого раствора, полного взаимного Золя Разработка мостиков и интерметаллических соединений. Простой металл-плохой растворитель Она характеризуется отсутствием внутренней пустой орбиты. Особенно плохое решение Источником является щелочной металл.
Поскольку размер атомов довольно велик, они и Сами они очень плохо растворимы в других металлах. Людмила Фирмаль
9-для систем, содержащих И sp металл, разделение фаз часто наблюдается в жидкой фазе (Na-A1, K-Fe и Д-Р.-)- Бериллий и магний сильно отличаются от щелочноземельных металлов. Согласно химии металла, магний примыкает к щетинкам, но Металла будет немного closer. In в частности, бериллий уже может образовываться Дефектные соединения (/- металл, магний Эта способность не так уж и велика. СП-металлы Твердые растворы не образуются ни с какими элементами цикла
Системы (даже друг друга) образуют соединения с элементами Группы IA и PA, большинство переходных металлов, полуметаллов и неметаллов Лама Переходный металл из-за дефектной d-и / / оболочки, значение близости Потенциал ионизации и атомный радиус широкого спектра металлов Химическое вещество ability. As как правило, это отличные растворители. Тела других химических элементов (кроме щелочных и щелочноземельных)、
Но они образуют только непрерывный твердый раствор между собой. Переходный Металл может производить большое количество различных интерметаллических фаз При взаимодействии с ша- Группа, бериллий и magnesium. In кроме того, они хорошо взаимодействуют с эле- Полицейский на правой стороне границы Zintl. Для общей оценки типа взаимодействия металлической системы, есть、
Обратите внимание на разницу в температуре плавления и разнице в электрической Троице Тело. Хотя последний элемент химии металлов не так уж и важен Как химия металлов и неметаллов вообще, но, она может Указывает на возможность образования интерметаллических соединений. Если Потому что простые материалы имеют большую разницу в температуре плавления、 Возможно расслаивание в жидкой фазе.
Этот вывод становится еще яснее. Деление, когда валентная электронная структура элемента отличается Оболочка и потенциал ионизации различны. Щелочной Металлы подгруппы калия не взаимодействуют, несмотря на их высокую активность Они мешают алюминию, что вызвано значительной разницей в температуре плавления. Потенциал ионизации и электронный structure. In кроме того, даже в уведомлении- Очевидное различие в электроотрицательности не способствует взаимодействию.
Если Температура плавления ингредиентов относительно близка、 Из-за больших различий возможно образование соединений в системе. Например, в системах, содержащих алюминий и щелочноземельные металлы、 Промежуточные стадии имеют ряд промежуточных стадий: MeAC, MeAl2 и MeAl. Оба фактора (член парламента. И ви) оказывают тесное и решающее влияние на характер взаимодействия Существует соотношение атомарных факторов.
Если атомный радиус близок Возможно образование непрерывных твердых растворов (Ca-Ba, K-Rb, K-Cs). Образование, если размер атома более существенно отличается Ограниченный твердый раствор, и значительно разницы в OEO-и Нина. Именно поэтому натрий и его аналоги (K, Rb, Cs)、 Твердый solution. In кроме того, поскольку электроотрицательность натрия выражена、 Образование интерметаллических соединений возможно, если они выше, чем калий, рубидий и цезий Пусто compound.
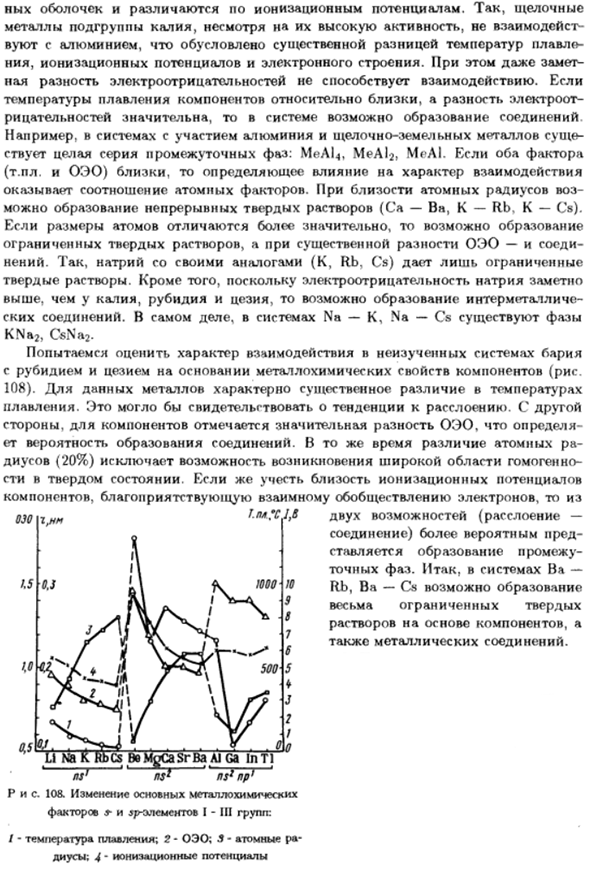
In на самом деле, существуют фазы в системах Na-K, Na-Cs (Kn2) CsNa2. Оценим характер взаимодействия в неисследованных Бариевых системах. Рубидий и цезий основаны на химических свойствах компонентов 108).Эти металлы характеризуются большими перепадами температур Он тает. Это может указывать на тенденцию к расслоению. С другой стороны С другой стороны, для компонентов существует большая разница в OEO.
Существует возможность соединения formation. At в то же время, разница между атомами Диусы B0%) исключает возможность равномерных широких площадей Твердотельный. Учитывая близость потенциала ионизации Компоненты, способствующие взаимной социализации электронов 030. 0.5 г, Нм 0.3 Mp. Ли на в эритроциты BeMgCaSrBa Аль-GA в Тл В AS1 Л. Н $ Р НП ’ Рисунок 108.
Фундаментальные изменения в химии металлов Факторы элементов S и sp группы I-III: / — Это температура плавления. 2-WEEE; 3-атомный Потенциал ионизации Daius 4′ 2 возможности (комплект- Соединение) Образование ставится между ними Точное время phase. So, в системе Ba- Возможность формирования Rb, Ba-Cs Очень ограниченное твердое тело Компонентные решения Кроме того, соединения металлов.
Смотрите также:
