Оглавление:



Металлы
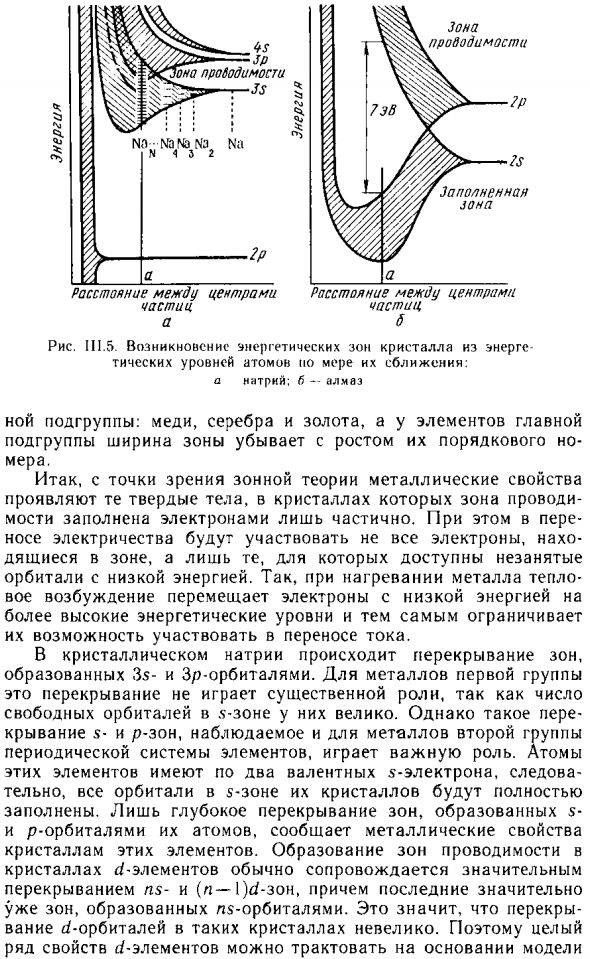
- Рассмотреть в соответствии с правилами зоны металла Теория энергетического строения металлов. Рисунок III.5, но пока Показано образование кристаллических зон натрия. Внутренняя электроника Атомные орбитали кристаллов натрия, особенно 2p, на самом деле Они не перекрываются геометрически, Внутри зоны проводимости, образованной взаимодействием 3x орбитали.
- N атомов натрия образуют одинаковое количество энергий Готический уровень. Каждый атом натрия имеет Только один валентный электрон при низкой температуре Только половина уровня заполнена зоной проводимости. Многочисленные уровни свободной энергии в зоне Высокая подвижность электронов, ведущая к высокой Электропроводность металлического натрия. изречений.
Логическая структура зоны проводимости кристаллическая и др. Людмила Фирмаль
Элементы первой группы периодической системы элементов, Чем ширина зоны проводимости является наибольшей для бокового элемента зона проводимость частица но Расстояние между центрами частица б Рисунок III. 5. Появление энергетической зоны кристалла из энергии На атомном уровне, но по мере приближения друг к другу: А натрия; 6-а; 1маз NOA подгруппа.
Медь, серебро, золото, основные элементы Ширина подгрупп и зон уменьшается с ростом порядка Меры. Поэтому с точки зрения теории зон свойства металла Диапазон проводимости Мост только частично заполнен электронами. Кроме того, Не все электроны участвуют в электрическом носу. Только те, кто находится в зоне, но доступны для безработных Низкоэнергетическая орбита.
Таким образом, когда металл нагревается, он теплый Возбуждение вызывает низкоэнергетические электроны Высшие энергетические уровни и их ограничения Возможность участия в текущем переводе. В кристаллическом натрии зоны перекрываются, Он образован 3-мя и sp-орбитами. Для первой группы металлов Это дублирование не играет важной роли. Это происходит потому, В 5 зоне есть много свободных траекторий.
- Однако такие изменения Покрытия S-диапазона и p-диапазона, наблюдаемые во второй группе металлов. Периодическая система элементов играет важную роль. атом Два валентных 5 электрона, след этих элементов Фактически все орбитали полосы кристалла полностью Заполнено только глубокое перекрытие зон, образованных Сообщите о p-орбитальных и металлических свойствах атомов.
Кристаллы этих элементов. Формирование зоны проводимости Обычно важно для кристаллов элемента d ns- и {n- ) d-3 на перекрытии, последнее значительно Зона уже сформирована нс орбитой. Это совпадение Такие кристаллы имеют небольшую орбиту.
Поэтому весь Может интерпретировать многие свойства элемента ti на основе модели Локализованный д е. Людмила Фирмаль
Последний дает металл ¿ Связь в кристалле элемента частично ковалентная Характер. Поэтому низкая химическая активность металлов Можно разместить ближе к концу периода и объяснить качественно Играл важную роль в Thread Crystal Изовалентные связи. Поэтому элемент d иногда называют В отличие от типичных металлов, они являются переходными металлами. Основная подгруппа.
Электропроводность кристалла d-элемента Он в основном генерируется электронами на внешних пяти орбитах. В связи с этим электропроводность переходного металла Ниже, чем типичные металлы. Исключение составляет металл d Подгруппа меди и цинка с полной орбитой Неэлектронный и не перекрывается с 5 внешними зонами
Смотрите также:
| Металлы, полупроводники и диэлектрики | Диэлектрики и полупроводники |
| Зонная теория кристаллов | Дефекты кристаллов и их возникновение |
Если вам потребуется помощь по химии вы всегда можете написать мне в whatsapp.
