Оглавление:



Методы построения диаграмм состояния
- Метод диаграммы состояния Экспериментальное построение фазовой диаграммы возможно в связи с тем, что фазовое превращение сплава характеризуется изменением физико-механических свойств (электрического сопротивления, удельного объема и др.) или тепловыми эффектами. Поскольку переход сплава из жидкого состояния в твердое сопряжен со значительным выделением тепла, путем измерения температуры во время нагрева или охлаждения в зависимости от времени можно определить критическую температуру, при которой происходит фазовое превращение, путем изгиба или остановки кривой охлаждения.
Для коррекции превращения твердого тела с небольшим тепловым эффектом наблюдают физические величины (электричество, магнетизм и другие свойства), которые обычно существенно изменяются в процессе фазового превращения. На рисунке 3.1 показана зависимость длины образца железа от температуры. При температуре 911°с наблюдается уменьшение длины образца. Это свидетельствует о переходе железа из одного фазового состояния в другое, и при температуре 1392°С наблюдается новое превращение. Эти физические эффекты указывают
на фазовый переход, не раскрывая атомную структуру этих фаз. Людмила Фирмаль
Диаграмма состояния строится в координатах температуры и химического состава сплава. Для экспериментального построения диаграммы состояния сплава, образованного компонентами а и в, необходимо изготовить серию сплавов с различным содержанием компонентов А и В. Для каждого сплава, критическая точка определяется экспериментально.
То есть температура фазового перехода. Температура результата Рисунок 3.1.Схема изменения длины образца железа в зависимости от температуры нагрева Рисунок 32.Схема создания диаграммы состояния Поместите его на вертикальной линии в соответствии с химическим составом сплава. Соедините важные точки и получите линию диаграммы состояния.
- 1 из простейших диаграмм состояния показана на рисунке. 3.2.Здесь линии представляют собой жидкофазные геометрические места всех точек, определяющих температуру, при которой начинается кристаллизация сплава (латинское слово»жидкость» означает жидкость).Солидус соответствует точке, определяющей температуру в конце кристаллизации сплава («Сори» — твердый).Эти линии разделяют диаграмму состояния на области с различными фазовыми конфигурациями.
Расположение линий на диаграмме зависит от скорости охлаждения сплава, поэтому температура ключевых точек при составлении диаграммы состояния определяется при медленном охлаждении или нагреве. Такая фигура называется равновесием. Таким образом, диаграмма состояния представляет собой графическое представление фазового состава сплава в данной системе в зависимости от температуры и химического состава сплава.
Левый край горизонтальной оси соответствует содержанию 1 100% двух компонентов. Людмила Фирмаль
Фракция 2-го компонента откладывается слева направо от этой оси. Правый край соответствует 2-ой составляющей 100%.Экспериментально построенные диаграммы состояния проверяются по фазовым правилам и могут быть теоретически продемонстрированы Совершение процесса трансформации для установления равновесного состояния системы. Общий закон существования устойчивой фазы, соответствующей состоянию равновесия, может быть выражен в математической форме, называемой правилом фазы (Гиббса).Фазовое правило позволяет прогнозировать и проверять процессы, происходящие в сплаве при нагреве и охлаждении.
Указывает, происходит ли процесс кристаллизации при постоянной температуре или в диапазоне температур, и указывает количество фаз, которые могут существовать одновременно в системе. Обычно диаграмма состояния строится с постоянным (атмосферным) давлением, поэтому фазовое правило выражается в следующей формуле: С = К 4-1-Ф、 Где K-количество компонентов в системе. Количество F-фаз. Рядом с степенями свободы(или системные отклонения).Число степеней свободы — это число независимых переменных внутренних (фазовый состав) и внешних (температура, давление) факторов, которые могут изменяться без изменения числа фаз в равновесном состоянии.
Согласно правилу фазы, в бинарной системе с постоянным давлением может быть до 3 фаз одновременно. Это возможно при C = 0 (Ф-2 4-1).Только при определенном фазовом составе и температуре имеется 3 phases. In двоичная система, когда число фаз больше, чем sin, это означает, что сплав не находится в равновесии или количество фаз или компонентов определяется неправильно. Для однофазных состояний правила фазы не применяются. Экспериментальное построение диаграмм состояния является очень трудоемким процессом, требующим подготовки большого количества экспериментальных сплавов.
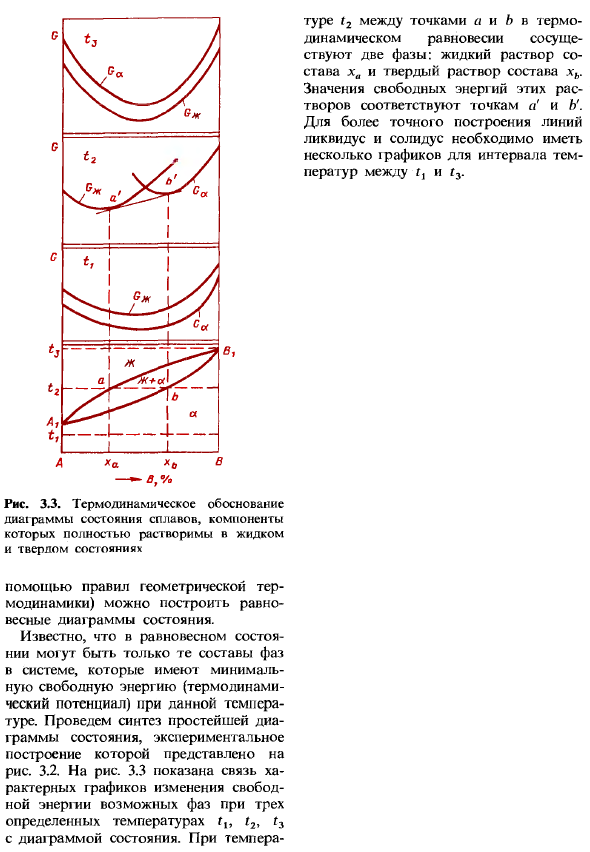
Однако, если у вас есть необходимые термодинамические данные( В раунде t2 2 фазы сосуществуют между A и b в термодинамическом равновесии. Жидкий раствор состава xx и твердый раствор состава xb. Свободная энергия этих решений соответствует точкам а и В. Для более точного построения Ликвидуса и Солидуса необходимо иметь несколько инт I-стоек. диапазон температур между Z и Z3. Это Б % Рисунок 3.3.Термодинамическая демонстрация диаграммы состояния сплава, в которой компоненты полностью растворяются в жидком и твердом состоянии Можно построить диаграмму состояния равновесия (используя правила геометрической термодинамики).
Известно, что только фазовый состав в системе с минимальной свободной энергией (термодинамическим потенциалом) при заданной температуре приводится в равновесие. Синтезируем простейшую диаграмму состояния. Экспериментальная структура показана на рисунке 1. 3.2.На рис. 3.3 показана зависимость между диаграммой характеристик свободной энергии и диаграммой состояния возможных фаз при 3 определенных температурах z, z2 и Z3.In
Смотрите также:
Материаловедение — решение задач с примерами
| Основные равновесные диаграммы состояния двойных сплавов | Получение монокристаллов |
| Диаграмма состояния железоуглеродистых сплавов | Аморфное состояние металлов |
