Пример №1-19.
Образец органического вещества массой 1,5 г сожгли в избытке кислорода. Продуктами реакции являются оксид углерода (IV) объемом 896 мл (н. у.), азот — 224 мл (и. у.) и вода массой 0,9 г. Плотность паров исходного вещества по воздуху равна 2,5862. Определите формулу вещества, если известно, что анализируемое вещество взаимодействует с равным числом молей 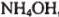 , а полученный продукт — с удвоенным числом молей
, а полученный продукт — с удвоенным числом молей 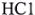 .
.
Решение:
Состав продуктов реакции  позволяет утверждать, что в состав неизвестного вещества входят углерод, азот и водород, а также, вероятно, кислород. Для окончательного решения вопроса о качественном составе неизвестного вещества определим сначала количества углерода, азота и водорода, входящие его состав.
позволяет утверждать, что в состав неизвестного вещества входят углерод, азот и водород, а также, вероятно, кислород. Для окончательного решения вопроса о качественном составе неизвестного вещества определим сначала количества углерода, азота и водорода, входящие его состав.

Суммируя массы углерода, азота и водорода, получаем:
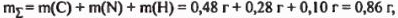
что не равно массе исходного образца. Следовательно, в состав неизвестного вещества входят не только углерод, азот и водород, но и кислород, масса которого составляет
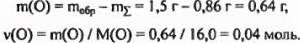
Теперь непосредственно перейдем к установлению формулы неизвестного вещества. Из проведенных расчетов видно, что молярное соотношение компонентов в искомом соединении равно:
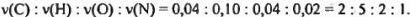
Очевидно, что полученному соотношению компонентов отвечает формула 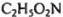 или, учитывая свойства этого вещества, приведенные в условии задачи, можно утверждать, что неизвестное органическое вещество — аминоуксусная кислота
или, учитывая свойства этого вещества, приведенные в условии задачи, можно утверждать, что неизвестное органическое вещество — аминоуксусная кислота 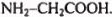
Этот пример взят со страницы решения задач по химии с примерами:
Возможно эти примеры вам будут полезны:
