Оглавление:



Окислительно-восстановительные свойства гидроксидов
- Окислительно-восстановительные свойства гидроксидов. Характеристика Содержание гидроксидов определяется не только характером кислотных изменений、 Но дело в том, что не только основные функции можно оценить на их примере Относительная стабильность различных степеней окисления элементов, взаимная.
- Рассмотрим переход между ними, а именно окислительно-восстановительные процессы Активность элементов в различной степени окисления. Характерность Окислительно-восстановительное поведение гидроксидов Взаимодействие в этом случае продолжается. Водный раствор. Вода Двести восемьдесят семь Активный участник проекта process.
In в большинстве случаев окисление Реакция восстановления, включающая гидроксиды, зависит от реакции среды. Людмила Фирмаль
На самом деле потенциал водородного электрода равен В стандартных условиях, а именно концентрация ионов водорода (активность) Раствор 1 моль / л (рН 0).В соответствии с уравнением Нернста Потенциал водородного электрода определяется соотношением Е = 0.059 журнала [Н +] = −0.059 пн. при увеличении рН потенциал электрода смещается в отрицательном направлении. Так, при рН 7 потенциал водородного электрода равен E (H + / H)= −0,413 в、 рН 14Å (Н+ /Н)= −0,826 В.
Стабильность окислителей и восстановителей в воде Окружающая среда зависит от конкретных условий (температуры, температуры、 Концентрация окисленных и восстановленных форм и рН среды). Окислительно-восстановительная активность гидроксидов зависит от степени Окисление elements. In общее, когда состояние окисления увеличивается、
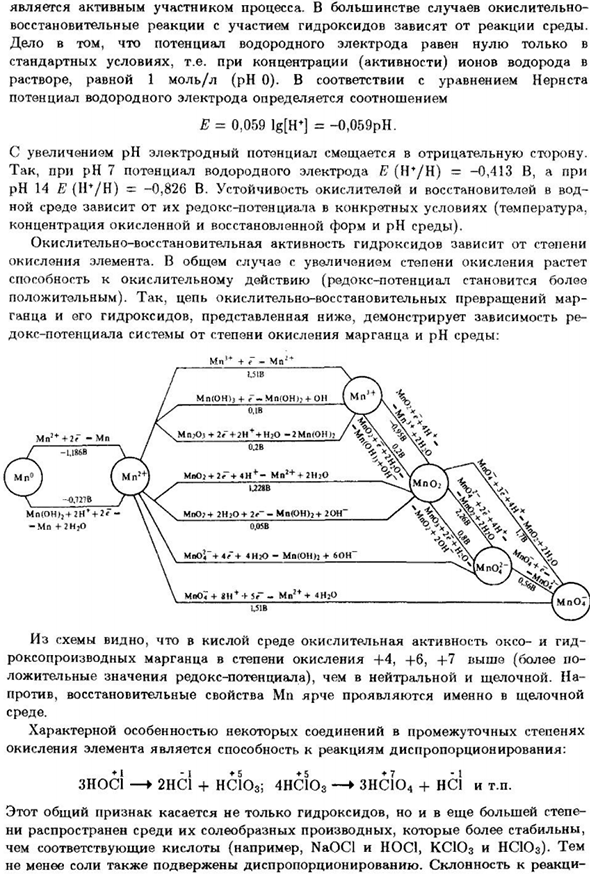
- Способность к окислению(окислительно-восстановительный потенциал будет больше Итак, цепь окислительно-восстановительных превращений составляет 3 месяца Марганца и его гидроксидов показано ниже Докс потенциал системы по степени окисления марганца и РН: Мпо2 + 2Н, о + 2—МН(о + 2OH MnO7 + 8H ++ 5 <Г-Mn2 ++ 4NgO 1.51 в На этом рисунке показано, что в кислой среде окислительная активность Оксо и гидро Степень окисления оксо-производных марганца+ 4,+ 6,+ 7
Отрицательные значения окислительно-восстановительного потенциала), чем нейтральные и щелочные. На Напротив, ремонтные свойства Mn более выражены в щелочности Окружающая среда. Является asn1 2НС1 HC1O3; 4НС1Оз 3HC1O4 + НС! И так далее.1 ′
Характеристики умеренных соединений Окисление элемента-это способность к непропорциональным реакциям. Людмила Фирмаль
Эта общая черта применима не только к гидроксидам, но даже более широко. Он также не распространен среди производных, таких как соли, которые являются более стабильными、 Чем соответствующие кислоты(например, NaOCl и HOC1, КСЮ3 и НСУЗ)- Содержание соли также непропорционально.
Тенденция реакции 288. Несбалансированные ямы выполняют важную классификационную функцию、 Потому что он показывает нестабильность соответствующего состояния окисления И нарастающая тенденция окислительно-восстановительного разложения.
Смотрите также:
| Гидроксиды как характеристические соединения | Соли кислородсодержащих кислот |
| Кислотно-основные свойства. Амфотерность гидроксидов | Комплексные соединения |
Если вам потребуется заказать решение по химии вы всегда можете написать мне в whatsapp.
