Оглавление:


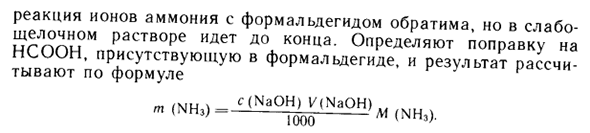

Определение солей аммония и азота в органических соединениях по Кьельдалю
- Определение солей аммония и азота в органических соединениях по Кьельдалю Ион аммония NH2 является очень слабой кислотой (pKt: = 9,24), поэтому прямое титрование раствором с использованием индикатора pH невозможно. Соли аммония обычно определяются обратным титрованием и вытеснительным титрованием.
- Один метод обратного титрования включает добавление в аналитический раствор чрезмерно точно измеренного раствора титрованного NaOH и нагревание до полного удаления NH3 из раствора. Фенолфталеин не рекомендуется в качестве индикатора из-за возможного искажения В результате взаимодействия щелочи и CO2. Масса аммиака рассчитывается по следующей формуле G s (NaOH) K (NaOH) s (HCl) V (IS ) «1 .. m (NHj) = L-yuo — iooo-JM (NHa) l
Затем оставшуюся щелочь титруют метиловым оранжевым путем титрования. Людмила Фирмаль
В другом методе обратного титрования избыток щелочи добавляют к раствору анализируемой соли аммония, и высвобожденный аммиак перегоняют до явно избыточного раствора титрованной кислоты. Количество кислоты, остающейся в растворе после взаимодействия с аммиаком, определяется щелочным титрованием метиловым оранжевым.
Использование фенолфталеина и других индикаторов с rG> 7 неприемлемо, поскольку присутствующие в растворе ионы аммония могут вступать в реакцию. Результат анализа рассчитывается по формуле обратного титрования. M / V. ». v [«<• (HCl) Y (HCl) s (NaOH) V (NaOH) 1 м (NH3) = L-W — iooo ~ —] M Аммиачная перегонка используется в хорошо известном методе Кьельдаля для измерения содержания азота в органических соединениях.
В простейшем варианте этого метода образец обрабатывается путем нагревания с концентрированной серной кислотой в присутствии ртутной соли (катализатора), так что органические соединения окисляются до CO2 и H2O, а азот превращается в NH4HSO4.
После охлаждения к остатку добавляют щелочной раствор, NH.i отгоняют при измерении объема титруемого раствора кислоты, измеряют избыток кислоты, не вступающей в реакцию с аммиаком, и массу азота в образце определяют по формуле обратного титрования. Рассчитать с Метод Кьельдаля может измерять азот в аминах, аминокислотах, алкалоидах и многих других азотсодержащих соединениях.
- Некоторые соединения можно анализировать по Кьельдалю только после предварительного разложения или восстановления с использованием хлорида олова (II) или цинковой пыли (соединения азота, производные гидразина и т. Д.). Поглощение аммиака может привести к образованию раствора борной кислоты.
Полученный борат-ион легко титруется соляной кислотой (метиловый оранжевый) в присутствии избытка борной кислоты. Эту технику можно рассматривать как титрование смещения. Другим методом измерения ионов NH ^ является альдегидный метод, основанный на реакции ионов NHJ с формальдегидом. 4NHf -f- 6CH20 «(CH,) eN4 -f 4H * -f- 6H20
Как показано на схеме реакции, количество образующейся кислоты соответствует количеству соли аммония. Людмила Фирмаль
Формальдегид вводится в анализируемый нейтральный раствор, а высвобожденная кислота титруется щелочью с образованием фенолфталеина. Реакция между ионами аммония и формальдегидом является обратимой, но длится для слабощелочных растворов. Корректировка UNCS, присутствующего в формальдегиде, определяется, и результат рассчитывается по следующей формуле:
Смотрите также:
Решение задач по аналитической химии
| Анализ карбонатных и фосфатных смесей | Определение фосфора |
| Определение жесткости воды | Определение спиртов |
