Основания. Краткие теоретические сведения
Соединения оксидов с водой называют гидроксидами. Гидроксиды обладают теми же кислотно-основными свойствами, что и оксиды, из которых они произошли. Гидраты основных оксидов проявляют основные свойства, гидраты амфотерных — амфотерные, а гидраты кислотных — кислотные. Первые два вида гидратов образуют один класс соединений — оснований, а последний вид — кислот.
Основаниями называют гидраты основных и амфотерных оксидов. В их состав входят одна или несколько гидроксильных групп.
Общая формула основания — 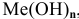 где n — валентность металла.
где n — валентность металла.
Кроме того, к основаниям относится гидроксид аммония 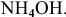
Количество гидроксильных групп в основании определяет его кислотность (основания бывают одно-, двух-, трехкислотными).
В основаниях водород с металлом связан через кислород. Примеры графических формул:
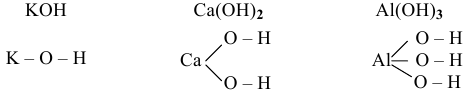
Рекомендую самостоятельно привести несколько примеров графических формул оснований.
Номенклатура оснований. Название основания состоит из слова гидроксид плюс название металла плюс в скобках римскими цифрами валентность элемента, например:
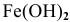 — гидроксид железа (II);
— гидроксид железа (II);
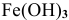 — гидроксид железа (III);
— гидроксид железа (III);
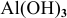 — гидроксид алюминия;
— гидроксид алюминия;
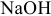 — гидроксид натрия.
— гидроксид натрия.
В последних двух случаях валентность элемента не ставится, т.к. элементы проявляют постоянную валентность.
Классификация оснований. Основания подразделяются на щелочи, нерастворимые основания. В последней группе выделяются амфотерные основания.
Щелочи — это основания щелочных и щелочно-земельных металлов и 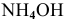 ; все они растворимы в воде. Например:
; все они растворимы в воде. Например: 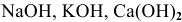 .
.
Остальные основания — нерастворимые основания, например: 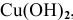 ,
, 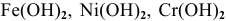 . Из нерастворимых оснований в отдельную группу выделяются амфотерные основания, которым соответствуют амфотерные оксиды, например:
. Из нерастворимых оснований в отдельную группу выделяются амфотерные основания, которым соответствуют амфотерные оксиды, например: 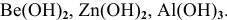 .
.
Способы получения оснований
1) Щелочи получают действием воды на оксиды щелочных и щелочноземельных металлов по схеме:
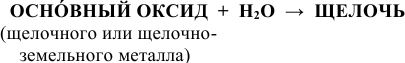
Например: 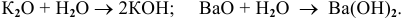
2) Щелочи получают также действием воды на щелочные и щелочноземельные металлы по схеме:
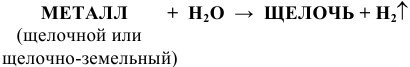
Например: 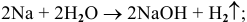
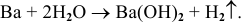
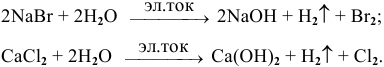
3) Еще одним важным способом получения щелочей является электролиз водных растворов солей, например:
4) Нерастворимые основания получают действием щелочей на соли по схеме:
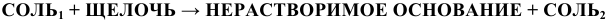
Например: 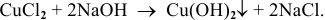
Этим же способом могут быть получены и щелочи, но обязательным условием является образование нерастворимой соли:
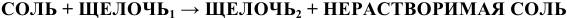
Например: 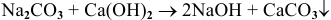
Рекомендую самостоятельно привести несколько примеров получения оснований различными способами и запомнить общие схемы.
Химические свойства
а) Электролитическая диссоциация. Щелочи подвергаются электролитической диссоциации с образованием аниона гидроксила, что обусловливает окраску индикаторов: фенолфталеина в малиновый цвет, лакмуса — в синий.
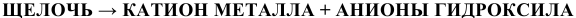
Например: 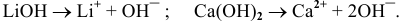
Рекомендую самостоятельно привести несколько примеров и запомнить общую схему.
б) Взаимодействие с солями.
Щелочи взаимодействуют с солями с образованием нерастворимых оснований или нерастворимых солей:
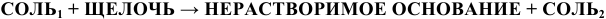
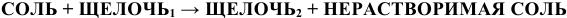
(См. «Способы получения оснований»).
в) Взаимодействие с амфотерными оксидами:
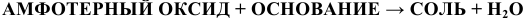
(См.подразд. 1.4 «Химические свойства амфотерных оксидов»).
г) Все основания взаимодействуют с кислотами, с кислотными оксидами
по схемам:
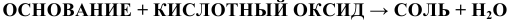
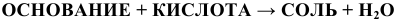
Примеры: 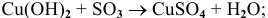
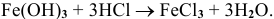
Рекомендую привести по нескольку примеров для обоих схем и запомнить общие схемы.
Частный случай реакции оснований с кислотами: щелочь + кислота называется реакцией нейтрализации.
д) Все нерастворимые основания при нагревании разлагаются по схеме:
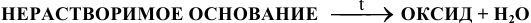
Например: 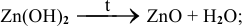
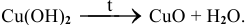
Рекомендую привести самостоятельно несколько примеров и запомнить общую схему.
е) Амфотерные основания, кроме свойств, указанных для нерастворимых оснований, проявляют кислотные свойства: взаимодействуют с основными оксидами и щелочами. Реакции протекают по следующим схемам:
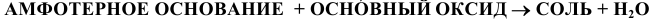
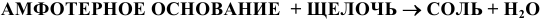
Например: 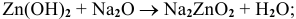
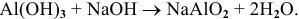
Эта теория взята со страницы решения задач по неорганической химии:
Задачи с решением по неорганической химии
Возможно эти страницы вам будут полезны:
| Неметаллы в химии. Краткие теоретические сведения |
| Оксиды в химии. Краткие теоретические сведения |
| Кислоты в химии. Краткие теоретические сведения |
| Соли в химии. Краткие теоретические сведения |
