Оглавление:








Основные приемы фотометрических измерений
- Основной метод фотометрического измерения Метод калибровочного графика. Согласно закону Бугера-Ламберта-Хепы, график координат оптической плотности — плотность линейная, и линия должна проходить через начало координат. Вообще говоря, для создания такого графика достаточно одной экспериментальной точки.
- Однако калибровочная кривая обычно создается по крайней мере с тремя точками, что повышает точность определения и надежность. Если вы нарушаете закон Бугера — Ламберта — Бера, то есть линейную зависимость A от c, вам нужно увеличить количество точек на графике. Использование градуировочного графика является наиболее распространенным и точным методом. Фотометрическое измерение.
Основные ограничения метода связаны с приготовлением стандартных растворов и сложностью рассмотрения эффектов так называемых третьих компонентов. Людмила Фирмаль
Это означает, что компоненты в образце не определяются сами по себе, но влияют на результаты. Метод молярного коэффициента экстинкции. При работе таким образом определяется оптическая плотность нескольких стандартных решений ASTU для каждого решения, вычисляется e = Arg / (/ cSt), а полученные значения e усредняются.
Далее измеряют оптическую плотность анализируемого раствора Ax и рассчитывают концентрацию cx по формуле cx — ax / (e1). Ограничение этого метода состоит в том, что анализируемая система должна быть представлена в соответствии с Законом Буга-Ламберта-Пива, по крайней мере, в области изучаемой концентрации. Метод сложения.
Этот метод может быть использован для анализа сложных композиционных растворов, поскольку эффекты «третьего» компонента могут быть автоматически приняты во внимание. Суть в следующем. Сначала определяется оптическая плотность Ax аналитического раствора, содержащего определенный компонент с неизвестной концентрацией cx, после чего известное количество определенного компонента (cst) добавляется к анализируемому раствору и оптическая плотность Ax + st измеряется снова.
Оптическая плотность АХ анализируемого раствора составляет Ax = elcx, (3.14) Оптическая плотность аналитического раствора и добавление стандартного раствора Ax + CT = tl (cx + cLT). (3.15) Сравнение между уравнениями (3.14) и (3.15) Arg стк ск + <41 или Ax (cx-f-cst) = ^ 1 + ct cx- Отсюда вы можете увидеть концентрацию анализируемого раствора. Концентрация аналита в методе сложения также может быть подтверждена графиком координат Ax bCT = f (cCT).
Уравнение (3.15) показывает, что установка Ax + как функции ct дает прямую линию, а экстраполяция на ось абсцисс прекращение дает сегмент, равный -x. На самом деле, если LA + CT-0, то -cn = cx из уравнения (3.15). Дифференциальная фотометрия. Фотометрия раствора темного цвета выполняется нормально Дом дифференциального учета.
В обычной фотометрии интенсивность света 1 Xu, прошедшего через раствор неизвестной концентрации, сравнивается с интенсивностью света, проходящего через растворитель. Коэффициент пропускания такого раствора равен отношению интенсивности (рис. 3.12). Tx = 1x / 1o. При дифференциальной фотометрии второй луч проходит не через растворитель, а через цветной раствор известной концентрации (так называемый раствор для сравнения концентрации gav).
Его сила обозначена как / ср. Как и раньше, пусть интенсивность света, проходящего через анализируемый раствор, будет равна / х. Коэффициент интенсивности f * // cp называется условной передачей T’x. T’x = 1x // c Отношения / ср и / о характеризуют коэффициент пропускания раствора сравнения. О Т, 7 ‘ср = / ср //. Таким же образом, как и 1x = Tx1o; / ср = 7 * срл), тогда т * / жк? = T’x = Tx / Tcp Или переход от коэффициента пропускания к оптической плотности. A’Ya = AYa Ах-г1ш-А Где ах — относительная оптическая плотность.
Уравнение (3.16) показывает, что относительная оптическая плотность пропорциональна концентрации окрашенного материала, а также истинной оптической плотности, но прямая Ax-cx не проходит через начало координат (рис. 3.13). Пусть оптическая плотность анализируемого раствора A = 4.0. Это нельзя измерить точно с помощью обычной фотометрии. Если вместо растворителя используется раствор Lsr = ZD, получается относительная оптическая плотность A’X = AX-ASR = 4,0-3,0 = 1,0. Это уже можно измерить с необходимой точностью.
Таким образом, дифференциальная фотометрия значительно расширяет диапазон концентраций, доступных для точных фотометрических измерений. Кроме того, точность некоторых методик Рисунок 3.12. Обычные и дифференциальные фотометрические схемы: от a до нормального, b-дифференциал Вода * (3.16) брак Дифференциальный учет превышает точность обычной технологии измерения.
Найти значение A ‘или V, которое минимизирует относительную погрешность дифференциального фотометрического определения. Поэтому найдите * по формуле (3.16). Ign + LG ^ CP (3,17) Различают выражение результатов Учитывая ГСР, она / Рисунок 3-13 График ступенчатой дифференциальной фотометрии l; + lSr cx = 4 * < El определенная Live,: д = 2.3 T’hv1
Комбинируя уравнения (3.17) и (3.18), DC _6Th с 2.3 ты (№ + 1ВГср) Или перейти к конечному приращению. Как Атия 2,3r; (игра; + играLp) dT’x (3,18) (3,19) На рисунке 3.14 графически показаны результаты нескольких расчетов, выполненных в соответствии с уравнением (3.19). Кривая 3.14 на рисунке показывает, что относительная погрешность определения концентрации уменьшается с уменьшением проницаемости раствора для сравнения (Gav).
- Кроме того, чем меньше коэффициент пропускания Ger, тем меньше относительная погрешность. Как видите, при 7 \ p = 1 дифференциальный метод меняется на прямую фотометрию. Поэтому нормальную фотометрию можно рассматривать как частный случай дифференцирования. Это показано кривой 1 на рисунке 1. 3.14, по существу воспроизводя кривую на рисунке 3.11.
Меньше чем. Чтобы найти оптическую плотность, которая минимизирует относительную ошибку решения, продифференцируйте уравнение (3.19) по константе AT и Gav Tx, чтобы сделать производную равной нулю. d \ Γ [(inП + InΓgr) + — ^ r j ^ [2.3n <lgr; + lg7 \ p)] ‘ д р; 1pP + 1pGsr + 1 = 0 1 0,435 2, 3 (3.20) А W = 0,435-л
Как показано, кривая, которая характеризует ошибку в дифференциальной фотометрии, находится ниже первой кривой, то есть слепой мышцы, и относительная ошибка в определении концентрации с помощью дифференциальной фотометрии является соответствующей ошибкой в традиционной фотометрии. Людмила Фирмаль
Если LSR = 0, это отношение передается в Ax-0.435 как особый случай. То есть Ax принимает оптимальное значение, ранее установленное для нормального измерения. Увеличение оптической плотности сравнительного решения (L1p) вызывает уменьшение оптической плотности, при которой достигается максимальная точность результата, согласно уравнению (3.20).
Когда AcP = 0,435, относительная оптическая плотность равна нулю. Следовательно, точные измерения достигаются при высокой оптической плотности и минимальной относительной оптической плотности эталонного раствора. Этот вывод также иллюстрируется кривой на рисунке. 3,14. Количественный анализ по инфракрасному спектру. Анализ по ИК-спектру также основан на применении закона Бугера-Ламберта-Бера.
В большинстве случаев здесь используется метод градуировочного графика. Использование метода молярного коэффициента экстинкции в ИК-спектроскопии сильно затруднено тем фактом, что расположение линий 100% передачи часто не может быть найдено из-за рассеяния, непрерывного поглощения и других эффектов. Определить интенсивность света, проходящего через образец без анализируемых компонентов (в / о).
Многие трудности в количественной ИК-спектроскопии были успешно преодолены с помощью широко используемого метода базовой линии. Суть понятна из рисунка. 3.15, это две полосы поглощения (их волновые числа v ^ и v ^. Базовая линия рисуется у основания полосы поглощения (показана пунктирной линией). Коэффициент пропускания, таким образом, равен TA = 1A / 1 ^ определяется как A) или T = I // 0 (e).
В соответствии с полученными данными создается таблица калибровки и создается определение. Экстракционная фотометрия. Методы экстракции очень широко используются в аналитической химии, и определение анализируемых компонентов в экстракте может проводиться как фотометрическим, так и другими методами: полярография, спектры и т. Д. В то же время, существует группа методов извлечения, где конец измерения наиболее эффективен, сек Он / с по-видимому Рисунок 3.14.
Относительная погрешность разных передач сравнительного решения: или Ig ^ + lgfcp воды Т.а = 0,1 1,0. 2-0.01. 4 = Ю-3 I-Tc, 3-T, Испеките необходимую скорость и точность решения. Эти методы обычно называют экстракционной фотометрией. Техника переноса определенных второстепенных компонентов в водорастворимые окрашенные соединения очень распространена, экстрагируется, и экстракт является фотометрическим.
Содержание обычно определяется калибровочным графиком. Поскольку извлечение является концентрированным следом примесей, этот метод устраняет влияние помех от посторонних компонентов и повышает чувствительность измерения. Например, примеси железа в солях кобальта или никеля измеряют путем экстракции тиоцианатного комплекса амиловым спиртом.
Измеряемое окрашенное соединение не должно растворяться в воде. Например, дитизон и многие дитизонаты металлов фактически не растворимы в воде, но растворимы во многих органических растворителях. В этом случае окрашенный экстракт может быть получен путем добавления раствора дитизона в подходящем органическом растворителе (например, четыреххлористом углероде) к аналитическому раствору.
Может быть более удобно экстрагировать одним реагентом, и вы можете использовать другой реагент для экстракции цветных соединений экстрагируемого элемента. Измерение смеси светопоглощающих веществ. В принципе, спектрофотометрия позволяет измерять несколько светопоглощающих веществ в одном растворе без предварительного разделения.
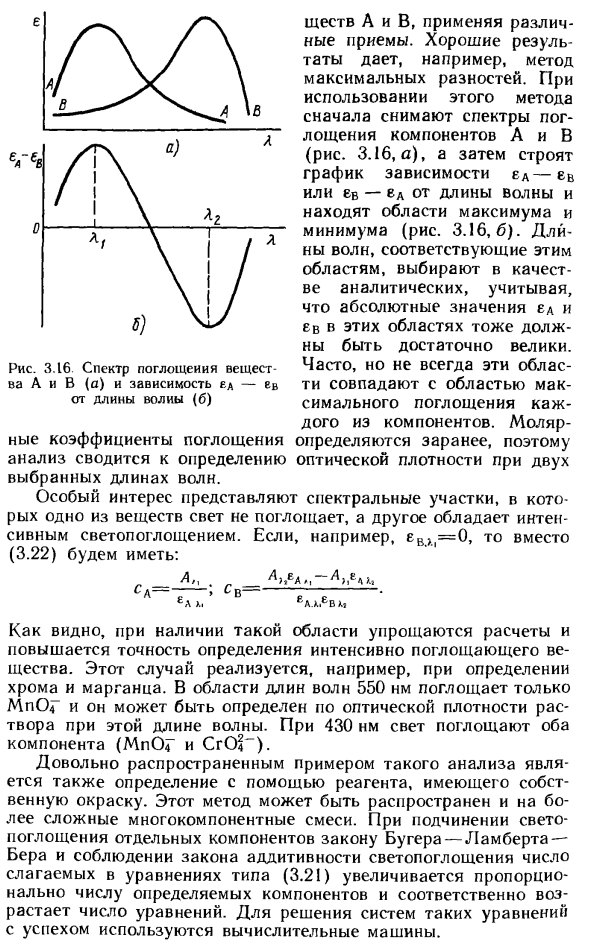
Особое практическое значение имеет особый случай таких систем, а именно анализ смесей двухцветных веществ. Согласно аддитивному закону поглощения света смеси таких веществ, например, А и В, его можно записать в виде ^ / 1 = K2, \ hC c \ UlC a + e) ^ X, = A hf A ~ t ~ £ B. / F c) » Решение этой системы уравнений для 1- \ см A) eB /, -> (3,22) Длины волн Xj и Xg, на которых выполняется измерение оптической плотности, выбираются из следующих спектров поглощения. * — 1 г / г <^ 7 л / * И р / \ / / 1 / V? , о г V / ^ Рисунок 3 15
Основной метод Научно-исследовательский институт (3,21) Вещества А и Б используют различными методами. Например, метод максимальной разницы дает хорошие результаты. При использовании этого метода сначала получают спектры поглощения компонентов A и B (рис. 3.16, а), затем строится график зависимости длины волны для eA_ev или ev_eA, чтобы найти максимальную и минимальную области ( (Рисунок 3.16.6).
Учитывая, что абсолютные значения u и ev в этих областях также должны быть очень большими, для анализа выбираются длины волн, соответствующие этим областям. Часто, но не всегда, эти области совпадают с максимальной площадью поглощения каждого компонента. Поскольку молярный коэффициент экстинкции заранее определен, анализ определит оптическую плотность на двух выбранных длинах волн.
Особый интерес представляет спектральная область, где один материал не поглощает свет, а другой материал обладает сильным поглощением света. Например, если ev> | = 0 вместо (3.22): Рис. 3.16. Спектры поглощения веществ А и В (а) и зависимость от длины воли £ е-е (б) CA = — л *, C n = Как можно видеть, если такая область существует, расчет упрощается, а точность измерения сильно поглощающих веществ повышается.
Этот случай реализуется, например, путем измерения хрома и марганца. В области длин волн 550 нм поглощается только MnOg, и его можно определить по оптической плотности раствора на этой длине волны. При длине волны 430 нм оба компонента (MnOr и CrO?) Поглощают свет. Довольно распространенным примером такого анализа является измерение с использованием запатентованного цветного реагента.
Этот метод может быть распространен на более сложные многокомпонентные смеси. Если поглощение света отдельными компонентами зависит от закона Бугера-Ламберта-Бера и наблюдается закон аддитивности поглощения света, число членов в уравнении типа (3.21) пропорционально количеству определяемых компонентов И поэтому число уравнений увеличивается. Компьютеры успешно используются для решения систем таких уравнений. Фотометрическое титрование.
В методе фотометрического титрования точка эквивалентности определяется с помощью фотометрического измерения. Во время этого титрования измеряется поглощение света раствором. Конечно, этот способ может быть реализован, если имеется подходящий индикатор или если по меньшей мере один из компонентов реакции титрования поглощает свет.
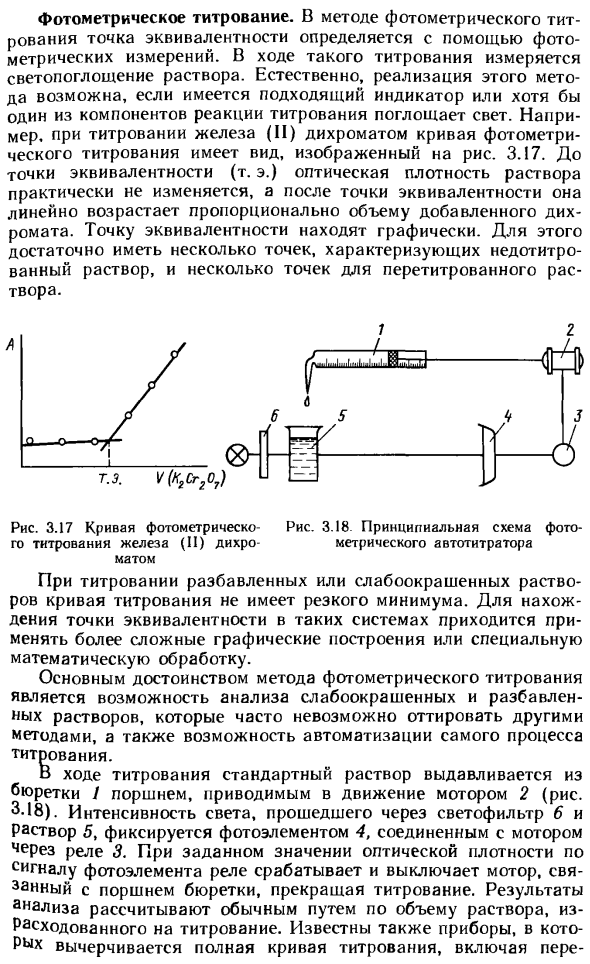
Например, во время титрования железа (II) дихроматом, фотометрическая кривая титрования имеет вид, показанный на рисунке 2. 3,17. Вплоть до изопункта (т.е.) оптическая плотность раствора существенно не изменяется, после чего она линейно увеличивается пропорционально объему добавляемого дихромата. Точки эквивалентности можно найти графически.
Для этого достаточно иметь несколько точек, характеризующих раствор для растворения, и несколько точек титруемого раствора. Рис. 3.17. Фотометрическая кривая 3.18. Схема фотометрического титрования дихроичного автоматического титратора железа (II) непристойность При титровании разбавленных или слабоокрашенных растворов на кривой титрования нет резкого минимума.
Нахождение точек эквивалентности в таких системах требует использования более сложных графических конструкций или специальных математических процессов. Основным преимуществом фотометрического титрования является возможность анализа слабоокрашенных и разбавленных растворов, которые часто не могут быть окрашены другими методами, и автоматизировать сам процесс титрования.
Во время титрования стандартный раствор выдавливается из бюретки / поршня, приводимого двигателем 2 (рис. 3-18). Интенсивность света, проходящего через фильтр 6 и раствор 5, фиксируется фотоэлементом 4, подключенным к двигателю через реле D. При заданном значении оптической плотности реле запускает и останавливает двигатель, соединенный с поршнем пули с помощью сигнала фотоэлемента, и останавливает титрование.
Результаты анализа рассчитываются обычным способом в зависимости от количества раствора, затраченного на титрование. Устройства с полной кривой титрования также известны. Титрование раствора, дифференциальная кривая титрования АА л. 1 / Координаты как функция В. Определение состава и стабильности комплексных соединений в растворе.
Благодаря простоте и достаточной точности фотометрических измерений фотометрические методы стали широко использоваться для изучения реакций в растворе, особенно цветовой реакции значений химического анализа. Метод эквимолярных рядов часто используется для определения состава соединения. Используя этот метод, готовят серию растворов, в которых отношение концентрации центрального иона к концентрации лиганда (cM: cL) варьируется между 9: 1 и 1: 9, давая общую концентрацию (cM-f-cL)
Оставайтесь одинаковыми во всех растворах (равные молярные ряды)) Далее измерьте оптическую плотность раствора и построите график зависимости оптической плотности от отношения концентраций cM: cL. Максимальное значение на этом графике указывает на состав комплекса.
Хотя метод эквимолярных рядов имеет свои ограничения и недостатки, он на самом деле является одним из наиболее широко используемых методов. Стабильность соединения с помощью фотометрии можно рассчитать графически или аналитически. Например, если молярный коэффициент экстинкции e комплексного ML может быть определен, константа устойчивости может быть вычислена из отношения: o _ A / (d) _ HML [^ -MeOP ^ — ^ AeOG ‘ Где A — оптическая плотность раствора.
с ° m и c ° L — начальные концентрации растворов центрального иона и лиганда. Предполагается, что кислотно-основное равновесие в исследуемом растворе не вызывает осложнений, т. Е. Центральный ион не гидролизуется, а лиганд не взаимодействует с протонами. В процессе кислотно-основного взаимодействия расчет констант стабильности является сложным.
Смотрите также:
Решение задач по аналитической химии
| Количественный анализ | Практическое применение метода абсорбционной спектроскопии |
| Оптимальные условия фотометрического определения | Общая характеристика метода абсорбционной спектроскопии |
