Оглавление:








Периодическая система элементов Менделеева
- Периодическая система менделеевских элементов Разъяснение природы, установленное Д. И. Менделеевым (1869) Частота характерных изменений, замеченных в числах Выполнять элементы, расположенные в порядке возрастания атомов Количество, следует учитывать функцию следящего Электронная оболочка, заполненная атомами (Н. Бор, 1922). x).
- Обратитесь к книге за подробной информацией о типе коммуникации и количественных аспектах проблемы. Э. Кондон, Г. Шорт Ли. Теория атомных спектров. -М. : IL, 1949. §73П Е Р И О Д И Я Ч Е С К И С И С Т Е К А А Л Л Е М Е Н Т О В М Е Н Д Е Л Е Е Б А 335 Увеличивается при переходе от одного атома к другому Заряд за единицу, и один электрон добавляется в оболочку. На первый взгляд энергия связи Каждый из электронов добавлен подряд Монотонные изменения с увеличением атомных номеров собирают.
Но на самом деле это не так. Людмила Фирмаль
В нормальном состоянии атома водорода есть только один Это государственный электрон. Атом-ге следующего элемента Я-ли другой электрон добавлен в том же состоянии. Однако энергия связи каждого Is-электрона в атоме гелия Гораздо больше, чем энергия связи электронов в атоме Фавор. Эта ситуация является естественным следствием.
Разница в поле, где электрон находится в атоме meН, и поле, куда добавляется электрон Ионы He +: на больших расстояниях эти электрические поля почти одинаковы Но вблизи ядра с зарядом Z = 2 электрическое поле ионов He + Ядерное магнитное поле атома водорода с Z = 1 В атоме лития (Z = 3) третий электрон входит Потому что состояние 25 не может быть в состоянии Is Два или более электронов одновременно.
О конкретном Зуро Венера 2с на есть. По мере увеличения Линия ядра и еще одна осень. Тем не менее, От Z = 2 до Z = 3, первый эффект очень важен Энергия связи второго и, следовательно, третьего электрона в атоме Li намного меньше энергии связи электронов в атоме Гелий. Кроме того, атомы от Be (Z = 4) до Ne (Z = 10) Сначала добавляются еще 25 электронов, затем 6 2p электронов.
Энергия связи, добавленная в этой серии Как правило, электроны испускаются при увеличении заряда ядра. Здесь. Добавлено при переходе на атом Na: (Z = 11) электроны находятся в состоянии 3s, эффект перехода Да, в высоких снарядах, он имеет приоритет над эфф При увеличении заряда ядра энергия связи снова становится сильнее. Осень. Подобный шаблон, который наполняет характер электронной оболочки На всю последовательность элементов.
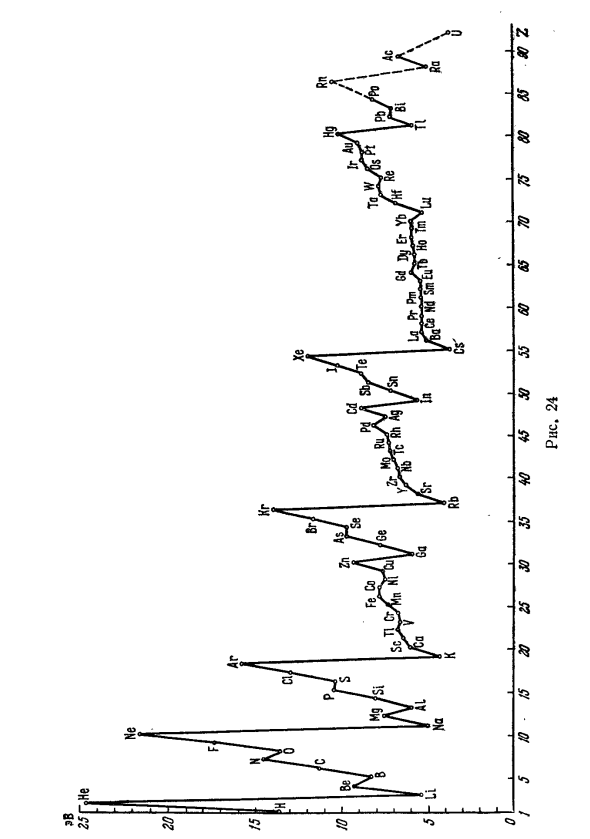
Все электронные Статус можно распределить, введя последовательно Группа: заполнить серию элементов, Их дой, энергия связи обычно растет, но сначала Когда следующее условие группы выполнено, энергия связи становится сильнее Осень. Рисунок 24, построенный по известным спектральным данным Потенциал ионизации элементов, они определяют Энергия связи электронов, добавленных при переходе от ка.
Далее каждый пункт. E, EV 336 Различные состояния доставляются в порядке Разверните группу следующим образом: 2 электрона, 2 с, 2р 8 электронов 3 с, 3р 8 электронов 4 5, 3д, 4п. 18 электронов 5с, 4д, 5п. 18 электронов 6s, 4 /, 5d, 6p 32 электронов, 7s, 6d, 5 / … Первая группа заполнена H и He. Заполните второе, Третий соответствует первым двум (маленьким) периодам периода Дихическая система, включающая 8 элементов.
За этим последовало Два больших периода с 18 элементами и большим периодом, включая Содержит редкоземельные элементы и в общей сложности 32 эля Милиционер. Последняя группа состояний заполнена не полностью Элемент, который существует в природе (и искусственный суперуран) Милиционер. Понять процесс изменения свойств элемента во время Реализация статуса каждой группы, ниже D и / или функции состояния, чтобы отличать их от состояний s и p.
Кривая эффективной потенциальной энергии центральной прокладки Метрическое поле (состоящее из электростатического ля и электроны в тяжелом атоме после центрифугирования) Оседание в начале быстрого, почти вертикального, опускания Динат имеет глубокий минимум, то Ассимилируется и асимптотически приближается к нулю.
Для s- и p-co Выдержите эти изгибы и идите очень к их возрастающей части Близко друг к другу. Это потому что Elec в этих штатах Трон расположен примерно на одинаковом расстоянии от ядра. кривая d, особенно кривая f-состояния Весь путь налево. Ограничено классически доступным Область заканчивается намного ближе, чем состояния s и p С такой же полной энергией электронов.
Другими словами б? В -и / -состоянии электроны в основном Ближе к ядру, чем состояния s и p. Многие свойства атомов (в том числе химические свойства Полицейский — см. § 81) Зависит в основном от внешней территории Стиль электронной оболочки. В этом отношении это очень важно. d и / или статус объяснил функции. Так при заполнении 4 / состояние (для редкоземельных элементов — см.
Ниже) ext Испускаемые электроны расположены гораздо ближе к ядру, От электрона, который был ранее заполнен. В результате 338 ATOM GL X Эти электроны мало влияют на химические свойства. И все редкие земли химически очень Точно так же. Элементы, содержащие заполненные d- и / -оболочки (или Называется основной элемент группы) Элементы, которые заполняют эти Состояния называются элементами промежуточной группы.
Иер Сотрудники полиции этих групп считаются полезными отдельно. Начнем с основных элементов группы. Водород и гелий Нормальное состояние: 1H: 1 секунда 2S 1/2, 2 He: b 2150 (Индекс слева от химического символа указывает на атом везде Номер). Электронная конфигурация оставшейся части главы Новая группа отображается на вкладке. 3.
Основная группа электронная структура и элементы S s 2 s 2p s 2p 2 s 2p 3 s 2p 4 s 2p 5 s 2p 6 n = 2 сс 4Be 5B 6c 7N sO sF iOn s 2 3 u N a 12-M-g 13AI w S i ib P ieS 17CI isAr 2 s22p6 4 19K 2oCa 3 с 23p 6 4 29 кл! 30Z11 3 iG a 32Ge 33 A s 34 Se 35 Br 36 Kr 3 d10 5 37Ш) 5-4 и 00 00 4 секунды 24p 6 5 47 А г 0 00 49 In 50 Sn 51 Sb BGTe 53I 54 X e 4d10 6 55CS 56 B a 5s 25p 6 6 79AU 8oHg 81 T l 00 к кр 83 Bi 84P0 85 At 86 R n O 43 Ю. 7 87Fr 00 00 6 секунд 26р 6 2S l / 2 x5 0 2P l / 2 3P0 4s 3/2 3P 22Рз / 2х50
В каждом атоме оболочка обозначена Правый столбец таблицы в той же строке, а все остальные Высокий. Электронная конфигурация заполненной оболочки как показано выше, главное квантовое число — электрон Эти состояния обозначены цифрами в левом столбце вкладки Та же самая линия поверхности. Нормальное состояние показано ниже.
Атом в целом. Таким образом, атом А1 имеет электронную конфигурацию l s 2 2s 2 2p6 3s 2 3p 2 P1 / 2. Значения L и S в нормальном состоянии атома Предопределено (с известной электронной конфигурацией) с помощью § 73 П Е Р И О Д И Я Ч Е С К И С И Я ТЕМА А Е Л Е М Е Н Т О В М Е Н Д Е Л Е Е Б А 339 Правило Хунда (§67), а значение J определяется по правилу Это упоминается в §72.
- Атомы благородного газа (He, Ne, Ar, Kr, Xe, Rn) занимают Особая позиция в конце таблицы на каждом. Целостность состояния группы указана в (73.1). Их электронные Новая конфигурация особенно стабильна (потенциальная Максимальная ионизация на соответствующей линии). Подключитесь к этому Химическая инертность этих элементов также показана.
Вы можете видеть, что происходят различные состояния заполнения Очень естественно среди элементов основной группы наполнения Сначала состояние s каждого главного кванта, затем состояние p Количество предметов n. Электронная конфигурация тоже естественна.
Ионизация ионов этих элементов (до затронуты электроны d- и / -оболочки) — каждый ион. Людмила Фирмаль
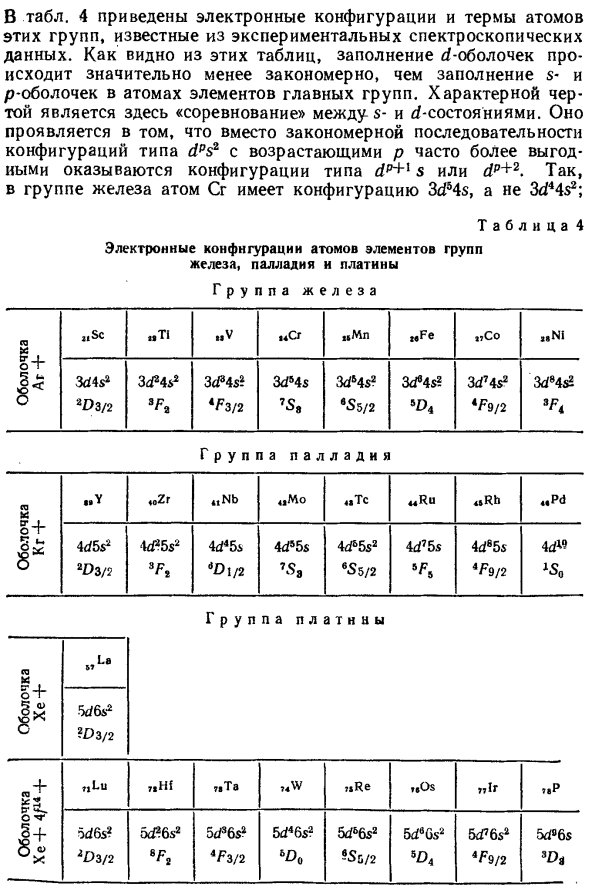
Это конфигурация, соответствующая предыдущему атому. так Ионы Mg + имеют конфигурацию атома Na, ионы Mg ++ имеют конфигурацию Приемопередатчик. Затем перейдите к элементу средней группы. Заливка Национальная оболочка 3d, 4b? , 5d происходит с группой элементов, именем Каждая группа состоит из железа, палладия и платины.
В таблице. 4 Показывает электронную конфигурацию и терминологию Эти группы атомов известны из экспериментального спектра Область применения данных. Как видно из этих таблиц, заполнение б оболочка S и p заполнение оболочки атомов элементов основной группы. Особенность здесь s- А б? Государство.
Вместо закона Размерная последовательность композиции типа d ps 2 с возрастом Во многих случаях плавление р-конфигурации является более выгодным. Введите d pJrls или d p + 2. Следовательно, в группе железа есть конф. В атоме Cr. 3d5 4s расчет, а не As4 3d4] Ni с 8 b электронами Полностью доволен б? Сразу после атома С с оболочкой (Таким образом, мы ввели его в основную группу).
то же Отсутствие регулярности также наблюдается в отношении терминологии Ion-Обычно электронная конфигурация ионов не совпадает Уте в предыдущем составе атома. Например, V + ион Состав 3d4 (не 3d2 4s2, как Ti) и ион Fe + является конф 3d2As (вместо конфигурации 3d ^ 4s2 атомов Mn).
от Остерегайтесь всех ионов, которые встречаются в природе в Содержится в кристаллах и растворах, незаполненная оболочка только d- (не s- и p-) электроны. Так что железо Кристалл или раствор Fe ++ Fe +++ только в виде ионов, Конфигурация 3sP и 3d5 соответственно. Электрические настройки и Atmo Сарказм, парада, платин организация скорлупа
А г + 2 1 СБ к к 4 2 3 V 24 Cr 2 5 M 11 2 6 Fe 2 7 C 0 2 e N i SD4S 2 2 D 3/2 3d 2 4 s 2 3 ф 2 3d3 4s 2 4 F3 / 2 3d 6 4s 7 S 3 3d 5 4 s 2 ES 5/2 3d 6 4 s 2 6 д 4 3d 7 4 s 2 * Fe / 2 3d8 4 секунды 2 3 ф 4 Г п р а п а л л а д и я скорлупа К р + 3 9 Y 40 Zr кр 4 2 M 0 £ Колорадо 44 Ру SL кр 4eRd 4d5s 2 2F> 3/2 4d 2 5 s 2 3 ф 2 4d 4 5s 6-й / 2 4d 5 5s 7S3 4d 5 5 s 2 6с5 / 2 4d 7 5s 5 ф 5 4ds 5s 4 ф 9/2 4d10 х5 0 Группа компаний скорлупа Х е + 57La 5d6s 2 2F> 3/2 S BHH ^ VO + 71 Lu 72Hf 7 3 Ta 7 4 W 7 5 Re 76Os 77lr 78? 5d6s 2 2F> 3/2 5d2 6 секунд 2 сф 2 5d3 6 секунд 2 4F3 / 2 5d46s2 5 D 0 5d56 с2 6с5 / 2 5d66 с2 5d 4 5d76 с2 4 ф 9/2 5d96s SD 3
Аналогичная ситуация возникает при заполнении Оболочка, которая встречается на серии элементов, известных под 4 / Название редкой земли (Таблица 5) 1). 4 / заполнение оболочки Также не очень обычный способ, персонажи 4 / -, гонка Зуя между 5d и bz-состояниями. Последняя группа промежуточных элементов начинается с Морской анемон. В нем 6d и 5 / shell заполнение сделано.
Заполните ряд редкоземельных элементов (Таблица 6). 1) В химических курсах Лу обычно называют редкоземельным элементом. Милиционер. Однако это неправильно, поскольку оболочка 4 / уже заполнена. Лу нужно отнести к платиновой группе. Это сделано в таблице. 4. §73П Е Р И О Д И Я Ч Е С К И С И Я ТЕМА А Е Л Е Е М Е Н Т О В М Е Н Д Е Л Е Е Б А 341 Таблица 5 Электронное и электронное оборудование для землепользования элемент скорлупа
Х е + BvSe 5 9 WG EOND EIP M 62SM / EU 4/5 д 6 с 2 1G я 4/36 секунд 2 * ч / 2 4/46 секунд 2 5 часов 4/5 6 секунд 2 6H 6/2 4/66 секунд 2 7f 0 4/76 секунд 2 8 S / 2 64 Gd 6 5 Tb eEDy 6 7 H 0 68 Er бета ройб 4/75 д 6 с2 9d 2 4/96 секунд 2 6 # 15/2 4/106 секунд 2 5 4 / n 6 секунд 2 4 / 15/2 4/126 секунд 2 в 4/136 секунд 2 2f v 2 4/146 секунд 2 X5O Таблица 6 Технология электропитания скорлупа R n + 8vAc 9oTh 9iPa 9 2 U 93Np 9 4 Pu eB при 96 см 6d7s2 2F> 3/2 6d27s2 3f 2 5 / 26d7s2 4 ^ н / 2 5 / 36d7s2 5BE 5f * 6d7s2 6 т 11/2 5/67 секунд 2 7Jb 5/77 секунд 2 SSf / 2 5 / 76d7s2 9 £> 2
В заключение этого раздела Актуальное применение метода Томаса Ферми. Мы видели, что Элек Трон p-оболочки впервые отображается в пятом элементе (B). б? Электроны появляются при Z = 21 (Sc), f-электроны Z-58 (Се). Эти значения Z могут быть предсказаны с использованием Метод Томаса-Ферми заключается в следующем.
Электроны с орбитальным импульсом I в сложных атомах движения «Эффективная потенциальная энергия» равна 1 7’T f \ (\ I V 2) 2 Ni) = — <p (r) + —— b —-. Первый член — потенциальная энергия электрического поля. <P (r), описываемый потенциалом Томаса-Ферми. Второй человек Есть центробежная энергия, которую мы пишем (/ + 1/2) дважды г) Как и в §70, используются атомные единицы. 342 100 1 (1 + 1) для полуклассического движения.
С пола Поскольку энергия атома электрона отрицательна, Ui (r)> 0 для всех r (для конкретных значений Z и I) Атомы не могут иметь электронов Пункт I. При рассмотрении определенных вещей Если вы измените значение I и Z, вы увидите, что Z слишком мало На самом деле E7 / (r)> 0 везде. Есть момент, когда кривая [7 / = E7 / (g) касается абсциссы.
Для больших Z уже есть область E7 / (r) <0. Ta Таким образом, момент появления электрона в данном атоме I Определяется условием, что кривая [7 / (r) касается абсциссы. уравнение rm (\ I ^ V ^) 2n TT1 (\ 1 (\ (IV ^) 2n U (r) = — (p + 2 rz = U (r) = -i p (r) -J = 0 Подставляя потенциал в уравнение (70.6), получаем следующее. уравнение ^ 2/3 * M = / 4 \ 2/3 (I + 1/2) 2 ^ X \ 3 7G / X 2 G72 / 3 x x ‘(x) -x (x) = r, (4 \ 2/3 (r + 1/2) 2 X \ 3 7G / X 2
Разделив второй член этих уравнений на первый член для каждого члена, х уравнение Х (х) __ 1 X (x) w ’ Затем рассчитайте Z согласно первому уравнению (73.2). Расчет льна дает Z = 0,155 (2 / I) 3. В этой формуле атомы Электрон дается я (о Ло 10%). Вместо этого вы получите очень точное значение.
Коэффициент 0,155 выбирает 0,17: Z = 0,17 (2/1/1) 3. (73,3) Для I = 1,2,3 это уравнение округляется до ближайшего значения, затем Для целых чисел единственными правильными значениями являются 5, 21, 58. Выражение I = 4 (73,3) возвращает Z = 124. Это означает г-электрон Он должен был появиться впервые только в 124-м элементе.
Смотрите также:
| Волновые функции внешних электронов вблизи ядра | Рентгеновские термы |
| Тонкая структура атомных уровней | Мультипольные моменты |
Если вам потребуется заказать решение по физике вы всегда можете написать мне в whatsapp.
