Оглавление:





































Платиновые металлы
- Платиновый металл. Все платиновые металлы-это несколько общих элементов. Относительное атомное содержание каждого из них в земной коре оценивается следующими величинами (% ): Ру Резус ПД ОС ИК-Пт 9-ИО » 7 2 -!0〜* 2 * 10-7 b•10-7 9.10 ″ ®5-HTf Из-за высокой дисперсности на различных породах платиновый металл вряд ли образуется clusters. As в результате они стали известны относительно поздно.
- Накопление платинового металла содержится только в почти самородном состоянии, как незначительная смесь с продуктами выветривания других пород. Отделение последних от платины и друг от друга представляет значительные трудности, что отчасти объясняется высокой стоимостью рассматриваемых элементов. В свободном состоянии это очень тугоплавкие и нелетучие металлы, иногда плотно разделенные на легкие (Ru, Rh, Pd) и тяжелые (Os, Ir, Pt).
Сама платина (аналогичная золоту) в такой золотой пыли обычно намного больше, чем в других металлах платиновой группы. Людмила Фирмаль
Наиболее важные константы для них сравниваются ниже. * Кокаровецаа И. Г. Беляев И. Н.. Семенякой Л. В.. Успехи в химии. 1 на 72. ДЖ * ВТОРОЙ, 1378. Ру Резус-ПД О » ИК-Пт ВМТ……..Серебро-серсбр.- серабр.- синий.- саребр. Салоа- Белый, белый, серый, белый, белый. Плотность, г! См.} 。 12.4 12.4 12.0 22.6 22.4 21.5 Температура pravivir. С….. 2260 1963 1554 3000 2447 1772 Температура кипения Это отличный способ познакомиться с новыми людьми…… 4100 3670 2900 5000 4500 3800 Проводимость 10 10 (1)….. 12 22 9 21 Природный N платиновый палладий пригоден для механической обработки, но Ru, Os n Ir тверже и хрупче. * −10 Что касается химических эффектов, то элементы платиновой группы очень stable.
In форма компактного металла, Ru, Rh и Ig нерастворимы не только в обычных кислотах, но и в царской водке. Последний растворяет платину и осмий, но палладий также растворим в HNOвсе платиновые металлы могут быть переведены в растворимое состояние сплавлением со щелочью в присутствии окислителей. Даже самые активные металлоиды при комнатной температуре не работают на компактных платиновых металлах.
Более или менее энергетическое взаимодействие может быть вызвано нагреванием, и наблюдаются интересные индивидуальные особенности отдельных элементов: по отношению к фтору и кислороду сера-рутений, хлор-иридий более устойчивы, чем другие металлы родий и platinum. In осмий, окисление протекает относительно легко, и его мелкодисперсный порошок медленно окисляется на воздухе(даже при нормальных условиях он становится Оссм. Очень тонко разделенное состояние (в виде » черного»)
Практически самое главное-это сама платина. Отдельные части лабораторной посуды и оборудования химических заводов изготавливаются из it. In электротехника, платина используется при изготовлении приборов (термометров сопротивления и термопар), которые используются для нагрева обмоток и измерения температуры в электроустановках furnaces. It также имеет очень важные применения как катализатор для различных производственных процессов в химической промышленности.
ИЖ-17 Соединения платиновой группы еще не нашли значительного практического применения. Производные некоторых металлов известны для определенных металлов и соответствуют самым разнообразным валентным состояниям вплоть до VIII, поэтому они очень многочисленны и разного типа. Однако некоторые валентности не являются характерными. Все элементы платиновой группы отличаются ярко выраженной склонностью к сложным образованиям.
Производные двухвалентных элементов особенно характерны для палладия и частично платины. Последние образуют очень много сложных соединений, но очень мало простых. Напротив, в случае палладия двухвалентное состояние является наиболее стабильным, даже в других случаях. Среди простых соединений Pd2 наиболее важными являются соли, большинство из которых являются легко растворимыми кристаллическими веществами, окрашенными в коричневый цвет в разные оттенки.
Таковы, например, обычные коммерческие составы: желто-коричневый Pd (NOj) 2 и красно-коричневый PdCl2-2H20.In Создатели PdCls легко восстанавливаются до металла реакцией даже при комнатной температуре PdCl2 + H20 + CO-CO2 + 2HC1 + Pd Исходя из этого, его используют для обнаружения окиси углерода в газовых смесях. И PdCl2, и другие соли этого элемента в растворе гидролизуются очень сильно.
Сложные производные палладия и платины в двухвалентной форме очень разнообразны по составу. Наиболее важными из них являются соли хлорплатины (соли H2 [PtCl4]) и цианоплатина (соли H2 [Pt (CN) 4]).* — м Соединения трехвалентных элементов наиболее характерны для родия и иридия. Их гидроксиды-1 г (OH) 3 желтого Rh (OH) a и зеленого-практически не растворяются в воде.
Оба они характеризуются слабо выраженными основными свойствами, которые при нагревании легко теряют воду и превращаются в черный оксид E20z. In помимо обычных солей, многие различные комплексные соединения известны своими обонятельными элементами. Диоксид EO *, соответствующий четырехвалентному элементу, известен для всех платиновых металлов(только частично-в виде гидратов).
Другие производные этой валентности особенно характерны для самой платины. Коричневый Pt (OH) 4 растворим как в кислотах, так и в сильных щелочах, и при нагревании он начинает терять кислород еще до полного обезвоживания. Продуктом взаимодействия как с кислотами, так и со щелочами, как правило, является не простая соль, а сложное соединение. Например, следующие реакции протекают с KOH и HC1: 2KOH + Пт(о)4 = KJPt(о)е] ст (О) 4 + 6CH1 = HJPtClJ + 4H20 Hi [PtCU], общий коммерческий препарат для этого элемента, получают путем растворения платины в соляной кислоте, насыщенной хлором. Pt + 2C12 + 2CH1 = H ^ PtClJ
Образование желтого осадка NH4, K, Rb♦ и Cs, которые являются плохо растворимыми солями хлорида платины, иногда используется для обнаружения вышеуказанных катионов. Образование сложного аммиака характерно только для платины, большинство из них соответствуют[Pt (NH3) e] X4 и[Pt(NHs) 4Xt] X2.Напротив, для всех металлов платиновой группы известны анионные комплексы общей формулы Mg [EC] (X-почти одинаковая часть одного и того же галогена). стабильность hx максимальна с соединениями платины. Производные шестивалентных элементов характерны для осмия и рутения.
Оба металла сплавляются со щелочью в присутствии окислителя и, согласно схеме, образуют соль осмия или рутениевой кислоты соответственно. E + 3KNO,+ 2KOH-K * E04 + 3KNOa + H20 Оматы (например, фиолетовый Ka0s04-2H20) и лютеи (например, черный K2Ki04Ng0) находятся вполне в нормальном состоянии Он нестабилен, но типичный характер изменений отличается. Рутенат легко восстанавливается до Ru02, наиболее стабильного кислородного соединения рутения. Напротив, os-mat OsO *. легко окисляется до i * 7-200 Соединения октановых элементов известны только для осмия и рутения. Тетродит осмия является наиболее характерным оксидом этого элемента, который при хранении в воздухе медленно образуется из мелкодисперсного металла и всех его соединений.
Удобно нагреть порошок Os с потоком кислорода, чтобы получить ce. Тетроксид рутения получают обработкой k2r11o4 избытком хлора. K2Ru04 + CI2 = 2KS1 + RU04 Тетраоксид является летучим желтым кристаллическим веществом substance. In в воде они очень растворимы, и раствор не проявляет кислой реакции на лакмус. Четыреххлористый углерод является сильным окислителем, но разница в стабильности совершенно различна. 0s04 кипятят при 131 ° С без разложения, но при нагревании до 100 ° С или более тетроксид рутения распадается на Ru02 и кислород.
Без контакта с ОСО * восстановителями он не изменяется в нормальных условиях, но Руо *может храниться только при отсутствии света и влаги. Тетроксид осмия легко растворяется в спирте; кроме того, он медленно восстанавливается до 0s02, и взрыв происходит, когда Ru04 вступает в контакт со спиртом. Поэтому в целом Ru04 гораздо более неустойчив, чем 0s04,и его окислительные свойства гораздо более выражены. Как четырех-окиси пары имеют характерный резкий запах, сильно разъедают слизистую и являются высокотоксичными, я * −208
Для всех видов соединений, образованных элементами соединения платиновой группы, основное практическое применение химии связано с каталитическими свойствами самого металла. Ускоряя различные химические процессы, они иногда способствуют, в частности, различным реакциям с участием газообразного водорода. Палладий является наиболее интересным в этом аспекте. Водород уменьшает хлор, бром, йод и кислород уже в холоде и темноте, и преобразует S02 в H2S, C10J в CG, а FeClj в FeC!2 и так далее. Вода, насыщенная водородом палладия, может конвертировать N2 в NH4NO2.Это означает, что свободный азот может быть объединен при нормальных условиях температуры и давления.
209 несмотря на многие индивидуальные различия, платиновый металл в целом похож на элементы семейства железных. Оба являются серебристо-белыми или серыми металлами, характеризующимися сложной летучестью, их температуры плавления и кипения изменяются очень естественно, снижаясь при переходе снизу вверх и слева направо (наибольшие в осмии, наименьшие в Никеле).Все элементы триады характеризуются высокой каталитической активностью.
Их ионы проявляют ярко выраженную тенденцию к комплексообразованию. Соединения, полученные из них, в подавляющем большинстве окрашены. Почти все элементы триады образуют соединения, соответствующие нескольким различным валентным состояниям, причем изменение последних происходит относительно просто. При перемещении группы снизу вверх, слева направо, наиболее характерно для конкретного элемента Как видно из приведенного выше сравнения, валентность в целом снижается: 2.0 Fe III, II Ru IV Os VIII Ко II, III Rh III Ir III, IV Ни ИИ, ПД второй, И. Pt IV, II
Между элементами вертикальной колонки появляется более тесное сходство с отдельными чертами. Например, для всех членов ряда Co, Rh и Ir (в отличие от других элементов триады) характерно образование аммиака типа[E (LN5) b] Xs. Члены ряда Fe, Ru и Os являются особенно активными катализаторами Ni, Pd и Pt в синтезе аммиака из элементов и в реакции присоединения водорода к органическим соединениям. Для Fe, Ru и Os кислородные соединения более характерны, чем для соединений серы, но для Ni, Pd и Pt они являются opposite.
In в этом отношении и в некоторых других отношениях Fe, Ru и Os подобны Mn, Tc и Re, но Ni, Pd и Pt подобны Cu, Ag и Au. Поэтому их химические свойства позволяют членам триады переходить между соседними элементами марганцевой подгруппы и соседними элементами медной подгруппы. Добавь 1) Первые признаки существования платинового металла датируются серединой 18 века. Платина была описана как самостоятельный металл в 1752 году. Из остальных элементов Pd и Rh были обнаружены в 1803 году, Oz и Ir-1804, Ru-1844.Последний элемент-Казанский химик К. К. Нм рутений (латино-лютенский) в честь России.
Имеется монография по рутению и родию 4. 2) природный родий является»чистым» элементом (i03Rh), иридий имеет 2 изотопа-1c, 1g(38,5%) и| I1g (61,5%), а рутений состоит из изотопов массового числа%(5.5%、98(1.9%)、99(12.7%)、100(12.6%)、101(17.0%)、102(31.6%)、104(18.7%)、 осмий 184(0.02%)、186 (1.6%)、187(1.6%)、188(13.3%)、189(16.1%)。 190(26.4%)、192(41.0%)、палладий-102(1.0%)、104(11.0%)、105(22.1%)、106(27.2%)、108(26.8%) )、110(11.9%)、платина-190(0.01%)、192(0.8%)、194(32.9%)。 195(33.8%)、196(25.3%)、198 ’(7.2%)。
3) структура электронной оболочки вне атомов Ru (4 <75s) и Os (5d 6s1) соответствует их четырехвалентным состояниям, а атомы Rh (4d * 5s) и Ir(5tPbs*) соответствуют трехвалентным состояниям. Атом Pd в основном состоянии (4 < / 10)является валентностью. Но в двухвалентном состоянии он легко возбуждается (рис. VI-5).Основной Атом Pt (5de6s)является двухвалентным.
Возбуждение в Квадрантное состояние (5d * 6s6p) требует затрат 86 ккал / г атомов. Энергия ионизации металлов платиновой группы сравнивается со следующей (эВ): Ру Резус ПД ОС ИК-Пт Я 7.36 7.46 8.33 8.7 9 9.0 II 16.76 18.07 19.42 17 (I & 0) 18.56 III 28.46 31.05 32.92(24.8)(26.7)(28.6) * Звягинцев О. Е. и др. Химия рутения. М..«Нвука», 1965.300 С. Федоров И. А. Родди. М. «Наука», 1Л6. 27 б. 4) в виде крупных самородков платиновые металлы встречаются очень редко(максимум этих самородков составляет 9,6 кг), а общее содержание эксплуатируемых месторождений обычно не превышает 1 г породы 10 мин на 1 тонну.
Поэтому первую операцию проводят путем промывки руды водой, отделения ее от песка, глины и др. Полученный продукт обычно содержит 60-90% самой платины и лишь относительно небольшие примеси других членов ее семейства. Существуют специальные монографии*, касающиеся металлургии платиновых металлов (а также Au и Ag).
5) ежегодное мировое производство платины составляет около 25 тонн (без учета Советского Союза). в качестве побочного продукта переработки никелевой руды получают значительное количество палладия(n платины).Размер оставшегося платинового металла значительно меньше, чем платины и палладия. Относительное значение (Au = I) на мировом рынке (1966) можно увидеть из следующего сравнения: Ру резус ПД ОС ИК-Пт 1.8 6.2 5.3 4.3 1.0 7Д 」 В России с 1828 по 1846 год платиновые монеты выпускались по 3, 6 и 12 рублей.
в) рутений и осмий кристаллизуются в зависимости от типа гексагональной плотной упаковки, а оставшийся платиновый металл-в виде куба с центральным surface. In в дополнение к константам, описанным в тексте, мы сравним несколько констант ниже. Ру Резус ПД ОА ИК-Пт 1.34 144 1.37 1.35 1.35 1.38 Работа на выходе электроаа, значит. 。 。 •4.5 4.8 5.1 4.6 4.6 5.3 Тепло плавит атомы kksl / m. 。 6.1 5.2 4.0 7.0 6.3 4.7 Ядерная жара. ккал / Ф-агож 152134 90186100135 Все 6 типов металлов характеризуются парамагнетизмом, и наиболее заметным из них является палладий(x «+567).
Чистое белое золото обладает высокой вязкостью и приближается к золоту в этом случае regard. As повышается давление, уменьшается электрическое сопротивление и повышается температура плавления (до 10 млн при 2070 * с).Растворимость платины в ртути составляет 0,09 мас.%.%(ср. ХІІ§ 4 Добавить.30).Из соединений этих металлов известны PtHg, PtjHg и Pt » Hg. 7)имеющиеся данные о взаимодействии водорода с элементами платиновой группы весьма противоречивы. Это в первую очередь связано с тем, что его поглощение сильно зависит от степени диспергирования и предварительной обработки материала. metal.
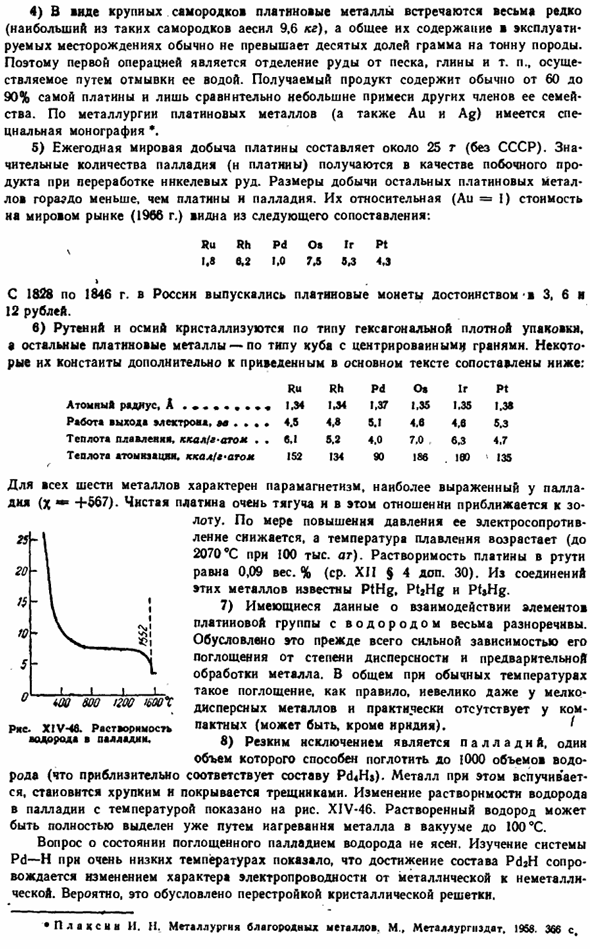
In в общем, при нормальных температурах такое поглощение на самом деле не присутствует в компактном металле (за исключением иридия), обычно небольшое даже в мелкодисперсном металле. «» 8) явным исключением является палладий, 1 емкость которого может поглощать до 1000 объемов водорода (что примерно эквивалентно составу Pd4H). в этом случае металл будет расширяться, становиться хрупким и покрываться трещинами. На рисунке показано изменение растворимости водорода в палладии по отношению к температуре. XIV-46.
Растворенный водород уже можно полностью отделить нагреванием металла до 100°С в вакууме Вопрос о состоянии водорода, поглощенного палладием, не ясен. Исследования системы Pd-H при очень низких температурах показали, что достижение состава PdjH влечет за собой изменение свойств проводимости от металла к неметаллу. Вероятно, это связано с перестройкой кристаллической решетки. США-XIV-46.Растворимость водорода в палладии. * P A d x I II. II. металлургия драгоценных металлов. М. нержавеющая сталь, нержавеющая сталь, нержавеющая сталь 1968.366 секунды 9) диффузия водорода через
Палладиевую стенку может быть использована для очистки от примесей других металлов. gases. It было показано, что его скорость (давление водорода 100-700 мм рт. ст. и температура 200-600°с) не зависит от толщины стенки и не пропорциональна V ^ P. последняя ситуация противоречит привычному представлению об атомной природе растворения водорода в палладии. 10) растворимость водорода в платине относительно ниже, чем у палладия(при 400 и 1000°С равна 0,6 и 2-10 ″% по массе).
Напротив, кислород платины растворяется лучше, чем palladium. It может поглощать до 70 объемов кислорода и 1 объем палладия-всего 0,07 объема, но платиновая стенка является кислородонепроницаемой даже при температуре 1400°С. мелкодисперсный палладий адсорбирует до 1 моль этилена на 1 г атома (платины немного меньше) способность элементов платиновой группы поглощать газ является их высокой каталитической активностью.
I) относительное сопротивление компактного платинового металла нагреву в потоке кислорода характеризуется серией Rh> Pt> Pd > > Ir> Ru > Os. At при комнатной температуре на поверхности платины образуется тонкий слой нестабильного оксида. когда oi ломается, торсини поднимается до 500°C. потеря массы металла более 500°C происходит из-за образования Летучего PtOf в этих условиях.
12) при использовании платиновой посуды в лаборатории* следует отметить, что при высоких температурах платина очень чувствительна ко многим различным химическим воздействиям. Нагрев огнеупорной посуды следует осуществлять с помощью электропечи (если нет паяльника).Горячая платина растворяет углерод и становится хрупкой, поэтому ее запрещено нагревать уменьшающим пламенем, особенно при курении flame. As в качестве подставки для Тигля следует использовать только кварцевый или платиновый треугольник.
В платиновом поддоне невозможно расплавить все вещества, которые могут выделяться при высокой температуре (из-за образования более или менее расплавленного сплава с платиной), такие как едкая щелочь, перекиси металлов, цианиды, сульфиды, сульфиты и др. sulfates. It также не может быть расплавлена с помощью платинового Тигля смесь, содержащая свободные B, Si, P, Aa. Sb и nx сочетаются с металлами (такими как бориды и силициды).Сплавление фосфатов, арсенатов и амитонатов следует проводить только в электрическом furnace.
To очистите платиновую посуду, вы также можете сварить ее в концентрированном HCl или HNO *и сплавить в ней равный вес H, BO, ■ kbf4. 13) работа наиболее распространенных термометров сопротивления основана на периодическом увеличении электрического сопротивления при нагревании тонкой платиновой проволоки. Поэтому, измеряя это сопротивление, можно определить температуру того места, где находится провод. Область применения платинового термометра сопротивления—263〜+1063 он находится в широком диапазоне°C, точность показаний достигает 1000 градусов за 1 минуту. При температурах до 630,5°C основным измерительным прибором считается ОИ.
14) принцип работы термопары несколько отличается. Поскольку концентрация свободных электронов изменяется в зависимости от металла, некоторые электроны всегда перемещаются от одного к другому из-за их тесного контакта. Это приводит к определенной разности контактных потенциалов между двумя металлами. Если цепь замкнута, то на 2-м месте контакта создается полностью идентичная разность потенциалов, и ток по цепи не течет. Однако это верно только в том случае, если оба контакта имеют одинаковую температуру.
Когда 1 из них нагревается, разность потенциалов в нагретом месте будет такой же, как и в уже холодном месте, и ток будет течь в нагретое место. circuit. It экспериментально установлено, что чем выше напряжение, и чем дальше друг от друга, тем оба металла в контакте находятся в нижнем ряду(положительно заряжены слева). Металлическая термоэлектрическая серия Sb Fe Mo Cd W Cu Zn Au Ag Pb Sn Mg A1 Hg Pt Pd Ni Bi Поэтому, используя такие термопары, можно передавать тепло непосредственно в электрическую энергию (но только с небольшим коэффициентом полезного действия).
Поскольку напряжение, обеспечиваемое термопарой определенным образом для каждой пары металлов, зависит от степени нагрева контактной зоны (обычно спая), то измерение этого напряжения позволяет также определить температуру пространства вокруг спая. Для поддержания постоянной температуры на 2-м стыке его помещают в тающий лед. Схема работы термопары показана на рисунке. XIV-47. 15) наиболее распространенными термопарами являются платина, платина и родий, а в качестве контактного металла используется сплав чистого белого золота и родия (10 мас.% Rh).
Зависимость ЭДС от температуры перехода ( / ) показана ниже. Т. С… 10020030040060000600700600900 1000 1100 1200 1300 1400£. милливольт. 0.64 1.42 2.31 3.24 4.21 5.22 6.25 7.32 8.43 9.57 10.74 11.95 13.15 14.37 Эта термопара рассмотрена как ведущий измерительный прибор для температуры 630.5-1063°C. Однако, температуру можно измерить до около 1500 * C. !в) серебристо-белый палладий используется при изготовлении различных предметов роскоши, помимо промышленных (электрических и др.).Небольшое количество присадок в этом металле значительно облегчает изготовление вольфрамовых деталей методом порошковой металлургии(VIII§ 5 add.
17).Металл родий является лучшим материалом для изготовления зеркал в системах освещения, которые сильно нагреваются во время работы. Хотя родий и палладий имеют худшее отражение света, чем серебро (для пучка с длиной волны 5500 а отражательная способность Ag, Rh и Pd составляет 94, 78, 65% соответственно).Однако оба эти металла имеют значительные преимущества перед серебром, и они не темнеют под действием сероводорода.
17) смешивание иридия с платиной значительно улучшает твердость и химическую стабильность. От сплава 90% Pt и 10% 1G, старый метр международного стандарта хранился в Париже. Сплавы платины и родия помогают в производстве термопар и сеток, используемых в качестве катализаторов при производстве HNOj из аммиака(IX§ 3 add.38).Сплав иридия и осмия отличается исключительной твердостью и используется для правки важнейших часовых осей.
Платина и сплав хрома ферромагнетика составляют 7-20% по массе, а точка Кюри в этом интервале колеблется от 50 до 900°С. Благодаря хорошей пластичности Ag 75 мас. Сплавы%и 20-Pd и 5-Mp (mp 1120°С) подходят для крепления корпусов лопаток газовых турбин. 18) как правило, комплексные соединения платиновых металлов с четным числом электронов являются диамагнитными, а нечетное число электронов содержит только 1 неспаренный electron. In в этом отношении они довольно сильно отличаются от элементов семейства железа, и многие их соединения обладают значительными эффективными магнитными моментами.
19) платиновые металлы и производные некоторых полуметаллов относятся к веществам с неясным валентным отношением. Поэтому фосфид характеризуется композицией типа ER.(Rh. Pd. Ir), Эр, (ру. Ов, ОП, ОС, Пт), РП (ру). Е * П(ДП, Ов, ИК), Е»П(Др. Пт), мощность Ncides-3Sia(ОС), 3aSii(ру. Резус. ОС. ИК), 3si, по (Рус. Резус, Др. Ос. ИК. Пт), 3jSia (ру. Rh, Ir), 3jSi (Pd. Pt), — бор до E2B5 (Ru, Os). Ева(Ru. Rh. Os. Ir). EaB3 (Ru). ЭВ(Ru. Rh. Os. Ir, Pt). E3Ba(Др. ИК. Пт), Е, Б (Ру, РЗ). OsC и RuC были получены из карбида.
Последнее соединение Рисунок XIV-47.Схема работы термопары. Самый твердый из всех карбидов металлов. Нитриды платиновых металлов не характерны. 20) то, что понятия валентности и важности переплетаются, особенно ярко проявляется в литературных данных о соединениях платиновых металлов (VII§ 5 add.2).Например, если оба понятия RhCl3 совпадают, то интерпретация Rh (NO) » Cl отличается.
С точки зрения валентности радикал N0, содержащий 1 неспаренный электрон, принципиально не отличается от атома хлора. Таким образом, родий также является 3-валентным в Rh (NO) jCl. At в то же время, исходя из частоты N0 ’(1721 с») растягивающей вибрации, этому радикалу обычно приписывают положительную поляризацию, а родству-значимость-I. Очевидно, что в системе экспериментальных материалов должна быть заложена определенная basis. Perhaps.
It разумно предположить, что атомы или радикалы с неспаренными электронами (CI, H, NO и др.) изменяют валентность связанного с ними платинового металла, а также то, что к ним присоединены донорные акцепторы (CI, NHa, CO и др.) не меняются. Таким образом, в дальнейшем за основу системы берется валентное состояние платиновых металлов, определенное таким образом, и обусловленное им значение почему-то считается одним из более или менее условных свойств молекулы(см. IX§ 5 из 21).
Конечно, такие схемы тоже безупречны. Это в первую очередь связано с тем, что даже в случае мономеров существует четкое различие между образованием молочных рецепторов и истинной валентной связью. Еще сложнее ситуация обстоит в полимерах, где валентные связи образуются даже непосредственно между атомами металлов. Через адгезивные частицы (CO и др.).Однако, чтобы внести соответствующие усовершенствования, необходимо точно определить электронную структуру молекулы под действием consideration.
In в большинстве случаев этого еще не сделано, поэтому нужно довольствоваться несколько более или менее формальными основаниями, изложенными выше. 21) производное нулевого валентного палладия представляет собой соединение цианида K4Pd (CN) 4].оно получено действием металлического калия на раствор Kj (Pd (CN) 4]в жидком аммиаке, представляет собой желтоватое кристаллическое вещество, которое очень похоже по свойствам на аналогичные производные никеля (§ 1 add.155). K ^ Pt (CN) j], только стабильный при −20°C.
Красный[P (C6H$)] L1 (SMA. 22) изонитрильный комплекс нулевого валентного палладия-Pd(CNR)(R-C * H и др.)- черно-коричневое твердое вещество (МП> 150°С). вероятно, оно имеет полимерную структуру. Они диамагнитны, нерастворимы в обычных растворителях, разлагаются на металлы пиридином, а избыток изонитрила образует желтые кристаллы состава Pd(CNR) 3 или Pd(CNR).Как никель (§ 1 add.150).Они превращаются молекулярным кислородом в производное состава (02) Pd (CNR) j. для других нулевалентных платиновых металлов изонитрильный комплекс неизвестен.
23) в случае Os 1 g n Pt известен аммиак платинового металла нулевой валентности. Они осаждаются при взаимодействии аммиака Os111, 1g, P или Pt11 и металлического калия в кипящем жидком аммиаке. Коричневый Os (NH3) стабилен примерно до 25°C, а бледно-желтый Pt (NH3) 4 уже начал разлагаться при 0°C и выше, а бледно-желтый Ir (NH3)$начинает разлагаться при 90°C и выше. Последнее соединение представляет собой диамагнитное вещество, которое поддерживает бинарность своей структуры (связь 1g — 1g).Продуктами пиролиза во всех случаях являются NH3 и мелкодисперсный металл.
24) среди аналогичных производных других Аминов описано нестабильное этилендиаминовое платиновое соединение PtEnj в нормальных условиях. Это розовое твердое вещество было получено восстановлением PtEn3b с избытком металлического калия в жидком аммиаке при −78°C. Один 25) фосфиновые комплексы платиновых металлов чаще всего получают из PF3 или P (SbH5) 3.Таким образом, взаимодействие PF3 при 100°С под высоким давлением (100 или 300 Ат) привело к образованию диамагнитного тетраэдра Pt (PF3) 4(то есть ad.-15.、 13 Б, С; Некрасов Т. 86°С)и PD (НФ«) «(МР.-41°с).
Эти бесцветные гидрофобные волокна разлагаются на ПФС и металлы при температуре+90 или −20°C соответственно. Бесцветный кристаллический Ru (PFs)&(mp.30°C), Os (PFs) 5 и оранжево-красный (Rh (PFj) » l, (mp. он said. It также известен как 93°C).Последнее соединение, вероятно, является валентной связью Rh-Rh, то есть формально производной нулевого элемента. Для Pt n Pd было получено несколько соединений общего типа 3 (PR$) 4t (R-C » H » или его различные производные).Они твердые, легко растворимы в бензоле и нерастворимы в спирте.
Желтый Е | П(CbH6) » 1 ″ раскладывается на 118 (ПТ) или 100°с (PD) и разлагается на ахроматические 3 | П (OCeHsbl4-145 или 125 кубических сантиметров соответственно. Бесцветный 3 {As (CeHj) sl4, а в долгосрочной перспективе описывается светло-зеленый RhlPfCtHsbl*.Поскольку он диамагнитный, его размеры могут быть (с валентной связью Rh_Rh).Для платины композиция P1 {P (CbH5) e1z плоскость трехсторонней координации платины</(P1P)= 2.26 A. группа P (C * H5) 3 в 1 может быть заменена CSj или COS. 26) интересным производным нуллвалеитной платины является композиция PILI complex, L — RjPCHjCHjPR. В R-QHS, они золото-желтые наслоенные кристаллы (mp 255 ° С), которые окисляют очень медленно в air. In напротив, бесцветный комплекс с R-CH5 очень чувствителен к воздуху.
27) известно, что производные платины N-вальвалеита являются твердыми в нормальных условиях. Существуют солеподобные соединения, полимерные структуры в составе KJPt (C * CR) aJ (R H, CH, C, H5), которые являются диамагнитными и нерастворимы в большинстве органических растворителей. Также было получено много смешанных комплексов общего типа[Pt (PRs)aAu].Где R — C » H и Ac-C ^ Hbcch и другой однозамещенный ацетилен. 28) наиболее полно нулевой валентный платиновый металл присутствует в карбонильных соединениях. Бесцветный Ru (CO) 5(mp 22°C, давление пара при 18°C 50 мм рт. ст.) получают нагреванием смеси с медным или серебряным порошком Rul до 170 ° C (для связывания галогенов).Внутри протекает угарный газ.
Уже выше −15°C, постепенно (быстрее со светом) происходит переход к Rus (CO) u. почти мгновенно такой переход происходит при 50°C. оранжевый Кристалл Ruj (CO) u (mp.155 * с) оба карбоната рутения не растворяются в воде, но легко растворимы в органических растворителях, нагревающих раствор бензола, получаются красные кристаллы Ru6 (CO) U. Я».Также описано смешанное карбонильное производное типа RufCOJjISfCeHsJj).Где E — Это P или As. 29) бесцветная унция (CO)$(mp.-15°C, давление пара 4,5 мм Hg. To получить Prn 20°C), лучше всего нагревать 0s04 под углекислым газом (оптимальные условия-300 АТ и 300). °C) в нормальных условиях, оно изменяет медленно к Osj (CO) la. Это желтое кристаллическое вещество (mp 224°C) очень стабильно и может быть очищено сублимацией при 170°C.
В молекуле Os ((CO) u атом осмия образует равносторонний треугольник (rf (OsOs)= 2.88 A], а для константы прочности связи соответственно известны значения/ c (OsOs)»0.9 и k (RuRu)= −0.8.В нормальных условиях оранжево-желтый Osi (CO) 9. НАФТА производных смешанных карбоновых кислот nullvalentium осмий также состоит из операционной системы (со) b1P(с * ч|) 9б. 30) оранжевый Rh3 (CO)$76 * C с разложением.) Рхрс могут быть получены нагреванием их под высоким давлением монооксида углерода (в других случаях образование углей ускоряется в Серии С1 — БР — и).он медленно разлагается на воздухе, а вода быстро разлагается.
Более стабильный и в случае красного резус (((со) Ия Н Черное П | ^ со).Оба являются твердыми веществами, которые не растворяются в воде Слабо растворим в органических растворителях. Последняя структура этих соединений интересна: в своей молекуле атом родия образует правильный октаэдр (d (RhRh)= 2.78 A], 2 молекулы монооксида углерода соединены друг с другом, остальные 4 молекулы со находятся прямо напротив Центральной грани октаэдра (^желтый смешанный Rhi (CO) 4 | P (C H5) представляет собой смешанный углеродный пузырь, содержащий 2 атома, четко сшитые он описан с точки зрения derivative. CO группа среди родственников родственников.
31) кристаллический карбонил иридия-зеленовато-желтый 1g » (CO) e и желтый 1g4 (CO) и-образуется при нагревании галогенидов 1gG вместе с медным порошком под высоким давлением CO. Первый из них более летуч (сублимируется при 160°С с потоком окиси углерода) и хорошо растворяется в органических растворителях. Это и есть основа метода их разделения. Оба они нерастворимы в воде. Ни разбавленные щелочи, ни кислоты (даже в концентрированном HN03), они не действуют на более стабильные Ира (CO).Красные тени для век (CO) также известны.
32) Jura Barate platinum polymer carbonyl — (Pt (CO) Jn -), полученный действием монооксида углерода на разбавленный спиртовой раствор NaJPtCU.) Ом-это коричневый кристалл, который нестабилен в воздухе. Наличие константы прочности связи Pt-C карбонильного производного, величина k = 3,9 CO при высоком давлении, явно способно обеспечить присутствие жидкого тетракарбонена-Pt (CO) 4—, который стабилен только при −20°C.
33) в случае палладия композиция[PD (CO) adlpyj•4ngo смешана с углерод-дипиридонильными производными. Представляет собой красный кристалл. Нулевая валентность палладия в этом соединении является лишь формальностью, так как его структура, вероятно, соответствует схеме[Dipy Pd (CO) aPd DipyJ и сшитой карбонильной группе]. 34) многие соединения одновалентного платинового металла являются карбонильными производными. Тетракарбоновые кислоты практически не встречаются known.
By при действии монооксида углерода (200°С, 350 Ат) OsBr y получают желтый (Os (CO) 4Br] j, заметно сублимированный при 100°С поток CO, растворимый в органических растворителях. Подобные оранжевые нитриды известны. Возможно, уравнение [(CO) 4OsITOs (CO) 4 |соответствует Галоидному мостику между атомами осмия. Гидрированный карбокс| HOs (CO) 4] j может иметь жидкую структуру в нормальных условиях при нормальных условиях. Тетрамеры (ГПЧ (Колорадо), j14(видимо 2-изомеры) и H2Ru4 (Колорадо) были зарегистрированы.
36) + 8CO = 2hrh (CO) в соответствии со схемой 2Rh-f, бледно-желтый HRh (CO) 4(mp.- 10°С) можно получить (200°С, 250 Ат) 4.It неустойчив и начинает разлагаться (Hi и Rh |(CO) e]. он уже превышает плавление temperature. It известен, почти не изучен и еще более нестабилен H1r (CO) 4. 38) трикарбоновый ворс представлен коричневым производным иридия в составе 1g (CO) 9G. это получают нагреванием 150 г до 1 г в потоке влажного монооксида углерода (легкость образования зависит от серии CI> Br> 1).
Эти вещества, вероятно, являются макромолекулами. В потоке CO он сублимируется при температурах выше 100°C и разлагается более или менее быстро из-за осаждения metal. As для осмия известен состав Трикарбонильных производных Os (CO) sU. Где L — P (SbH5) s. 37) Dncarbonnals в первую очередь характерны для родительского родственника. Простейшим представителем является соединение с Rh (CO) AR композицией, которое получают нагреванием Галогенида RhT во влажной атмосфере монооксида углерода (трудно образуется в серии C1 — Br — I).
Растворяя летучие твердые вещества около 120 ° с различных оттенков, несколько менее растворимы в воде (и медленно разлагаются), но более растворимы в органических растворителях. Для наиболее хорошо изученного хлорида его структура, вероятно, соответствует формуле[XCO) 8RhClClRh ^ CO). Атомы. Родий. Производные катионов P (CO) tL » h. здесь L-P(CeH5b или Sb (CeH.) 3 известен как для родия, так и для иридия. 38) путем добавления молекулы Амина (для Rh (co), что jCIJj образует резус (Колорадо) jLCI-тип гигроскопичен myomemager (л-ня, Пи, и т. д.).Для пиридина также был описан парамагнитный (X-+ 314) желтый димер[ Rh (CO)aPy2C1].А в случае L-Sb(CeH5) a-диамагнитный Мономер состава L3Rh (CO) aCI.
39) другой 1-солеподобный-характеризуется мономерным диамагнитным продуктом присоединения типа M {Rh ’(CO) araJ, примером которого является желтый[N (CH))») [Rh (CO) jCla].Анионы[Rh (CO) jCla] — по-видимому, имеют плоскую и центральную структуру. Благодаря молекулярному кислороду окись углерода легко окисляется до CO.высокая катионная соль, получаемая nnc, стабильна в кристаллической форме в растворах HCl, но медленно разлагается в нейтральных средах. Известны специфические производные подобных анионов(lr (CO)aH}.
40) / Rh (CO) атом хлора aClla может быть заменен некоторым комплексным Аноном (NO», SCN〜, SOj» и др.), без димерной структуры. Это взаимодействие карбола и NaCsHj образует диамагнитный оранжевый C * H»Rh (CO) a (mp −11°С), из которого медленно выделяются темно-красные кристаллы (C & HsRh (CO) sb> PRI в петролейном эфире), при нагревании до 123°C они частично разлагаются с переходом TR | Hcrh ($JC / $ 5 CO) в мономер, а известный состав fC / Hcrh ($JC) восстанавливается до наличия карбонильной группы в молекуле, связывающейся с атомом родия в углу треугольника(к нему присоединен анион csh5).
41) C5H5Rh (CaH4) a можно считать производным вышеуказанных мономеров, поскольку молекула этилена координируется двойной связью вблизи родия atom. In были получены иридиевые, еще более обильные этиленовые комплексы. Структура треугольной пирамиды b 1gc1 (CaH4) 4 в атмосфере этилена стабильна до 30°C и только разлагается выше этой температуры с образованием [IrCI (Caha) aJa]. Обратите внимание, что прочность связи Ir1 с этиленом выше, чем у Rh1.
42) Ir (CO) sCl и NaC » Hs, начиная с желтого CsH $ Ir(CO), жидкость была получена в нормальных условиях и была нестабильна в air. In напротив, оранжевый красный (CsH6Ru (CO) lla(mp 185°C) и желтый IC5HsOs (CO) a] a (mp 197°C) стабильны в воздухе.3 циклопентендиен все случаи иридия 1g (CO) aBG(где L-органический Амин) и 1g (CO) aBaG [где l-P (CbH5) A или Av (CeH) тип соединения также известны. е. я не уверен. Последний легко отсекает 1 молекулу со. 43) миоглобин характерен для родия и иридия. Среди производных других металлов платиновой группы, бесцветное ру (Колорадо) Бр описано, что получается при взаимодействии RuBr3 с Co (350°С, 150°С) и при нагревании до 200°С, ру и Ру (ко) абра исчезают.
В случае палладия, соли в составе Нью-Хэмпшир [ПД (Колорадо) CljJ], и результаты исследования подтверждают его формула димерные. Интересным производным этого элемента является красно-фиолетовый полимерная композиция [ПД (Колорадо) КАПЛЕСТРУЙНЫХ.Он нерастворим в обычных растворителях, диамагнитных, нелетучих и термически устойчив до 250°С. 44) карбонильных галогенидов в составе Rh (CO) T получено не было, но соли анионов, полученных из них(Rha (CO) ar»] a-были выделены. Rh (CO) наиболее характерен для соединений родия в составе LaCl.[
Rh (CO)в бензольном растворе образуется при взаимодействии aCIJa с избытком L E-P, As, Sb, R-CeH3 и др.).Производные Р и Ас желтого цвета, Sb диамагнитны, мономеры еще не разлагаются при 150 ° с, растворимы в органических растворителях, устойчивы к разбавлению кипящими растворами кислот и щелочей. разуются (вероятно, громоздкая фенильная группа атомов азота полиостью щита). 45) аналогичное производное желтого иридия-Ir (CO) LjCl [L (C * H5) 3]получают непрерывной обработкой 1gCl3 трифенилфосфином в спиртовой среде. Прежде всего, он интересен тем, что обладает способностью связывать молекулы ClfcHC1 или на с образованием соответствующих комплексов salrjcojl ^ CL type. So …
Водород/появляется здесь, возможно, в роли окислителя, что для него необычно, поскольку все трн процесса протекают аналогично. 46) еще более интересна способность бензольного раствора рассматриваемого углеродного ила поглощать молекулярный азот путем образования красного OjIr (CO) L3Cl. Когда давление падает, стержень Неро раскалывается. То есть реакция его привязанности есть reversible. As в результате 1 г (CO) CS1 выступает в качестве носителя кислорода, напоминающего в этом отношении гемоглобин (X§ 3 add.18). Испарение бензола в кислородной атмосфере влечет за собой выделение 0, Ir (C0) кристаллов L2Cl, которые постепенно разлагаются на свету.
Для молекул этого кислородного комплекса была установлена правильная пятиугольная структура с CO, CI и O в основании и P (C»H5) 3 в вершине(d(IrP)= 2.37 A).Оба атома кислорода равноудалены (d = 2.06 X)<(00)= 1.30 A от 1 г. Последнее значение показывает, что молекула 02 не объединена в виде сшивающей группы[d(00) » 1.5 A), но другими способами. По-видимому, слабая связь возникает из-за одноэлектронной донорной функции атома Иллиума в структуре кислорода, соответствующей Иону 07(XIII§ 1 add.48).
Точно так же, очень вероятно, что молекула O * будет связываться с атомами железа hemoglobin. It интересно, что сложные конкреции, сходные по составу, имеют d (00)= 1,47 а, которые необратимо объединяют Норрод. 47) спиртовой раствор E (C0) L3C1 (L P (CbH$) 3) и взаимодействие с избытком гидразина привели к синтезу иридия с Кином типа E и (C0) 1″H типа Кина. Хорошо изученное соединение родия имеет тригональную бипламундную структуру на основе 3 молекул трифенилфосфина (d (RhP)= 2,33 A).Вершины карбонильных групп (д (РГС)= 1.83 а) и водорода[д(RhH)= 1.60 а).
Атомы родия перемешиваются относительно дна на 0,36 а в направлении со. 48) для родия и иридония характерны некарбонильные производные платиновых металлов, формально одновалентные. Бесцветный диамагнитный HRh (PF3) 4 (mp. 40. Kp. 90°decomposition разложение) был получен путем выдерживания RhCl3 вместе с медным порошком при давлении Н2 и PF3 (90 атм) при 170°C.
In его молекула, 4 атома фосфора образуют тетраэдр вокруг атома Rh (положение водорода не установлено).он неустойчив (медленно разлагается уже при температуре более 20°С), имеет удушливый запах, легко растворяется в органических растворителях и почти не растворяется в воде, но его водный раствор представляет собой сильную одноосновную кислоту, за счет чего некоторые большие количества соли (в водно-ацетоновой среде) растворяются при взаимодействии катионной и калиевой амальгамы. нам с ним очень весело. 49) в ирнингдании известна подобная соль. В результате окисления эфирного раствора в узлах (-80°С) образовался Ir (PF3) 4I и выделился в виде стабильных желтых кристаллов до 25°С.
Также сообщалось о получении ртутных солей с составом HgP (PF3) 4b. Вот, е-резус. 1г 50) RhL3r типа (L-P (CbH5) 3, а Γ-красный кристалл CI, Br, I) (т. е. разложение^ 120°C) комплексы могут быть получены взаимодействием избытка P (C * H&) с RhT3 * 8 спиртом medium. In раствор бензола, он диссоциирует по схеме RhL3r * * RhLjI * + L и растворяется в CHjCl (mp 97, mp 40°C) RhLjCI может быть замещен на 1 P (CBH5) 3 группы на молекулу кислорода (02rhl3cl коричневого цвета образуется в CO и переходит в Rh (CO) L»Cl» (add§x 3.20).
Примером соединения Irndn является IrL3CI оранжевого цвета, и в его квадратной структуре 3 группы p (CeH) 1 легко заменяются другим лигандом. Также было отмечено присутствие Rh (P (CeH») 3) 3NO и производного катиона[RhL2).Где L-Cb (CH3) c. 51) нагрев в вакууме комплекса RhL3r включает удаление 1 молекулы P (C $ H3) 3.Полученное красное соединение RhLar разлагается только при температуре около 250 ° C. раствор Тетрагидрофурана RhLjCl поглощает CO или Na с образованием Rh (CO) L2Cl или Rh (H2)LjCl соответственно.
Последний теряет водород при пониженном давлении и возвращается в RhLjCl. Подобные продукты известны. Добавление молекулярного азота-Rh (Na) LjCl. ОИ свет-желтый порошок, очень стабилизированный в атмосфере азота. С помощью инфракрасной спектроскопии было показано, что молекулярная структура азота в этом комплексе не сильно нарушена. То же самое относится и к комплексам иридия аналогичного состава.
52) на основе Rh (CO) L C CI и RNC изонитрила (R as C6H5) получены многочисленные изотонические производные общего одновалентного родия Тип [Rh (CNR)»] X, X G», CU7, PF».Примерами являются желтый (Rh (CNCeH5)» JClO»(MP 180°C разложение) и фиолетовый (Rh (CNC»H» Cl) JCI (mp 137eC).Смешанные производные этого типа также известны. [RhLa (CNR) a] X, где L — P (CeH5) s. As(C $ H6)s или Sb(CeH5) 3> X-это Г», С| 0-очень летучий красный Rh является интересной производной. (Нет) (ПФ3) 3(Мп.-8°С). 53) диамагнитный, (x » −0.53) красный фиолетовый(Rh (Dipy)] aC!0″ — 3Ha0, вероятно, является dimer. It интересно, что для нитратов с аналогичным составом было найдено значение M.φφ^ 1.83.
Из других Аминов описан ярко-желтый [Os (NH3) e] Br, полученный восстановлением Os (NHBR3) elBr3 металлическим калием в жидком аммиаке. Светло-желтый (Ru (NH3) 5NjOJBF.」 54) состав простейшие производные ES1 известны в родстве, иридии и платине. Область их устойчивости очень мала, и под давлением I атм хлор 958 n 964°C RhCl IrCl case 773-798 ° С. Для PtCl, 581-583°C относительно стабилизированный IrCl, с красными медными кристаллами, неразрешимыми в воде, алкалие, и кислотах.
Длительное нагревание Osl>с 55% HI и CoA атмосферным спиртом производило серый Osl. oi — это только слабый парамагнетизм (Af, * * x 0.5), поэтому могут быть взаимодействия Os-Os. 55) E * 1 + 2e * E обычные потенциалы Pd и Pt, соответствующие переходу по схеме, составляют+ 0,99 и 1,2 В(в кислой среде) или+0,07 Н +0,15 В (В щелочной среде).Когда она становится более сложной, она смещается в отрицательную сторону. Значения 0,88 и 0,93 а приведены для ионных радиусов Pd «и Pt1*. 56) оксиды и дроссели двухвалентных платиновых металлов более или менее характерны только для платины и палладия.
Железо PdO и OX образуются при нагревании мелкодисперсного металла в кислородной атмосфере (в случае платины давление должно быть повышено, и продукты, наиболее богатые кислородом, примерно эквивалентны составу Pt30).Сильное свечение приводит к распаду обоих оксидов- * — Pd рыбалка для элементов при давлении кислорода Q-CI|, hell P ^ O (теплота образования 22 ккал / моль) 1 чтобы достичь атмосферы 875°с ПТО по, около 450°с Рvе водорода. XIV-48.Группировка цепочек г » Кристалл PdClj. Оба окна легко восстанавливаются Тара.
57) гидрат e (OH) a, соответствующий этим оксидам (точнее EOLNaO), может быть получен щелочным осаждением растворов солей Pd1 и Pt1.Оба гидроксида амфотерны по своей природе, и главная особенность заключается в том, что они относительно сильны в Pd (OH) a. и кислые-Pt (OH) a. черный осадок во влажных условиях Pt (OH) a является мощным восстановителем, который легко окисляется на воздухе.
С разбавленными кислотами он почти нерастворим. Коричневый Pd (OH) a сразу после осаждения хорошо растворяется в кислотах и сильных щелочах. Когда происходит обезвоживание(даже при нагревании на водяной бане), она чернеет и становится все труднее поддаваться обезвоживанию. Melt. In по сравнению с другими веществами, Pd (OH) a действует как слабый окислитель.
58) для теплоты образования галогенидов PdTa из элементов приведены значения 112(F), 43(C1). 25 (Vg), 14 (I) ккал / моль. Красный безводный PdCla(Мп.680 ° С) образуется при нагревании металла до 300°С в атмосфере хлора. Его кристаллическая структура характеризуется наличием, показанным на рисунке. XIV-48 тип плоской цепи Он классифицирует и относится к типу слоистой решетки (XIII§ 3 add.30).
Темно-коричневый PdBr2 имеет аналогичную цепную структуру (d (PdPd) «„3.29 A], и 2 противоположных атома брома ближе к Pd (D „„2.57 A““, чем другие 2 (d “» 2), d-2.43 A), и, наоборот, бледно-фиолетовый Pddi кристаллизуется с решеткой типа рутила, что свойственно ионным соединениям(rf (PdF)= 2.15 A].Взаимодействие между ионами Pd и Г образует черный осадок Pdlj. Практически нерастворим в воде(но если есть достаточно избытка раствора, чтобы пройти!) Значение константы диссоциации этого чувствительного Иона Pdr составляет MO 5 5 (CI).2-10 ’(Бр).Это МО10(я).
59) диамагнитный темно-коричневый Pdno) CI примыкает к железе и осаждается встряхиванием в разбавленном растворе PdCli (в отсутствие кислорода) и очень сухом взрывчатом Pd (Ns) j в N0.И Нан3. 60) фторид не получается из двухвалентного галогенида платины(но ему придается значение 82 ккал / моль для тепла, получаемого от элемента).Теплота образования других галогенидов P1G меньше теплоты образования соответствующих соединений палладия: 28 (CI), 19(Br), 4 (I) ккал / моль.
Пиролиз (к металлу) 556 (C!), Происходит при температурах 460 (Br), 370 (I)* C. Красный Черный Кристалл дихлорида платины состоит из отдельных групп Пуолу. Атом платины расположен под углом к октаэдру (d (PtPt) −3.32 4-3.40 AJ, а атом хлора над его краем fd(PtCI)= » 2.34 H-2.39 A].Как и палладий, dnchl рнда, каждый атом хлора связывается с 2 атомами металла одновременно. Хотя хлорид платины не растворяется в воде, он растворяется в HCl с образованием темно-красного Hjptclj. Перманганат в кислой среде количественно окисляет двухвалентную платину до четырехвалентной.
61) отдельные железы EG2 также известны по другим платиновым металлам. Двухатомный осмий является наиболее стабильным в виде плохо растворимого черного осмия. Когда OsClj нагревают до 500°C в вакууме, получается водонерастворимый темно-коричневый цвет OsClj. Аналогичные соединения лютеина образуются при восстановлении раствора RuCl * io цинком в свободном состоянии; он отделяется.
Однако известно несколько комплексов, соответствующих ему. Производное родия диатомита доступно от Rh (OH) j. It образуется при действии олова на Rh (OH), в сильно щелочной среде. Темно-красный галогенид Rhl » i быстро окисляется в воздухе. Некоторые сложные производные бивалентных родственников более стабильны. Иридий коричневый irclj нерастворимый в воде, кислотах и щелочах вследствие взаимодействия сажи и хлора (при атмосферном давлении) образуется в узком диапазоне 763 ~ g773°С pr пиролиза 1 ГСТ.
- 62) двухвалентное состояние осмия и лютеина сильно стабилизируется за счет образования комплексов С монооксидом углерода. Осмий характеризуется кристаллами в составе OstCOlnT^.Где n = * = 2, 3, 4.as n увеличивает в серии C1-Br-1 летучесть углерода и его растворимость в органических растворителях increases. In вода, они нерастворимы и взаимодействуют с ней. 63) самый простой способ получить желтый йод. Взаимодействие между Os04 и CO и HI уже включает образование Os (CO) при 200°С при нормальном давлении 4I2.Последний prn 240 * C будет Os (CO)$ I2.А в ПРВ 290°С-Os (CO) 2I2.
Pr 300°С (главным образом к металлу) внутри этого карбона разлагается. Бромиды и хлориды термически стабильны. Таким образом, бесцветный Os (CO) 4Cl2 получается при 220 ° С без деградации. Многие цезиевых солей изготавливаются из carboylchlorodon: КС(ОС (Колорадо)МПМ|], ЗС * {ОС (Колорадо) Иси»]и CsJOs(Колорадо) ТС).64) CO nн 2 (160 * C. By нагревание раствора ОСО в гептане со смесью 180Д * > — бесцветных кристаллов Os (CO) 4H2(mp 149°С) было получено. Атом водорода этого углеводорода (SG4) заменен на галоген、
Первые 2-бесцветные, а последние 2-оранжевые. Людмила Фирмаль
Na [OsH (CO) 4) также известен. Описаны также более сложные соединения подобного типа-Osj (СО) ijh OS (co), R, N. 65) галотановый углерод типа Ru (CO)2r2 является характеристикой рутения рутения. Его оранжевые кристаллы получают путем постепенного нагрева Rulj до 250°C в потоке CO2, который является диамагнитным, нелетучим, нерастворимым в воде и органических растворителях и очень устойчив к различным химическим веществам influences. In в этом узле предложена цепеподобная полимерная структура, включающая йод и сшивку. Желтая соль CsJRu(COhClJ. При длительном нагревании Rulj + Cu до 70°C под давлением оксина углерода (200 арг) образуются желтые кристаллы Ru (CO)
4l2.Они растворимы в органических растворителях и сублимируются при 126 ° С (выше! Интересно, что в октаэдрической молекуле этого карбонил-нидолита атомы узлов явно занимают положение ЦНС. Промежуточный карбонил Ru (CO) jIj не описан. 66) Carbonnygndrnd Ru (CO) 4H2 очень нестабилен. Из его производных (помимо галогенидов) необходимо обратить внимание на соединения типа Ru (CO) 4 (SnR3) s, которые устойчивы в воздухе. Где R-органический радикал(R-С*H8mp 182°С).Более сложные рутений карбонильного гидриды, Ru4 (co), что i2H4 и Ru4 (co), что ijH2 также перечислены.
67) 1G (CO) 2G2HALOCARBONS в отличие от Ru11 и Os, соединения иридия очень нестабильны и быстро разлагаются в water. In серия CI-Br-I, цвет меняет от белизны к желтому цвету. ) / 1е].Для родственников дифтерии карбонагаланда неизвестна. 68) из углеродных желез двухвалентного палладия только желто-коричневый Pd (CO) CI2 является known. It получают прямым взаимодействием монооксида углерода с PdClj (содержащим воду на 1% или менее по массе). Нагретый до 60°C или под воздействием воды, он разлагается. 69) для двухвалентной платины гораздо более характерен углеродный венец. Бледно-желтый Pt (CO) * Clj (mp 142°С) получают взаимодействием PtCIj и CO при 150 X.
In раствор бензола, он является мономером и имеет большой дипольный момент (q 4,85), что является преимуществом для центральной нервной системы. Этот карбонилхлорид быстро разлагается водой по схеме Pt (CO) jClj + H2O2 = 2HCl + CO2 + CO + Pt. Подобные бромиды также известны. При нагревании 70) Pt (CO) 2Cl2 потоком индифферентного газа образуется первый (210°C) pt2 (CO) sCU. Далее (250°C) Pt (CO) Cl2 (mp 195°C) в желтом цвете. Состав аналогичен оранжево-красному бромиду и красно-красно-ноду также известен, судя по результатам измерений молекулярной массы бромида (750±50).
Рассмотренные угольные железы являются размерными. Молекула [Pt (CO) r2J2 неполярна. И их инфракрасные спектры не выявляют частот, характерных для мостиковой группы со, структура днмеров должна соответствовать 2 Мостиковым атомам галогена и 2 другим плоским рамкам (OS) (G) ptrtpt (G) (CO), смещенным друг относительно друга. При температурах выше 300°С хлорид распадается до COC12n. образование Pt и HCI приводит к разложению воды. COj и Pt.
In сильный HCl, он растворяет для того чтобы произвести желтую комплексную кислоту H [Pt (CO) Cl. Некоторые получили sun. It является постоянным, но может быть разобран сам по себе. Бромиды и узлы имеют сходные свойства с хлоридами. Под действием H2S раствор соляной кислоты последнего осаждает черно-коричневый Pt (CO) S. It не разлагается даже при промывании водой, а при сушке на воздухе режет CO. «» 71) композиция Pt (COCli) желтого нелетучего соединения jclj представляет собой сухой фосген pr.
It может быть получен действием 500 х и свежеосажденной платины. Хотя стабилизированный в воздухе(немножко водоемкий, не обезвоженный путем сушить, 105°С), он легко солубле в воде и разлагает только с сильным топлением. Структура этого интересного соединения до сих пор не установлена. 72) двухвалентные соли платины и палладия и соответствующие соли комплексных соединений других элементов, в основном соответствуют типу м ^ ЭКД.
Где m-одновалентный катион, а X-одновалентный анион. Обычно сложный Анон имеет квадратную структуру с Комплексообразователем в центре. [PtCUPн [PdCl]] a-почти идентичное ядерное расстояние d (ES1) «» 2.31 A. для постоянной силы связи E-G следующее значение равно 2.3(Pt-CI).2.0(Пт-Бр), 0.5(ПТ-1),1.9(ПД-ки), 1.6(др-Бр). Здесь тепло, выделяемое элементом NS некоторых связанных галогенидов (ккал / моль): Ka [PdCl4]-262. Ki {PtCl4) −255. KJPdBr4J-218. К * 1Pfg<] −221.Интересно, что хлориды обладают высокой теплотой образования производных палладия, а бромиды-платины. Следующие значения доступны для полной константы нестабильности ионов [например*]^: PtCI4 PtBr4 PtI 3 * 10-17 4.10-1 3-10 ″
Как видно из этих данных, галлиевый комплекс платины более стабилен. Нет никаких аналогичных данных об ионах PdF, и ионы PtF*, по-видимому, не существуют(поскольку dnsmutacin стремится к Pt и PtF^). 73) водный раствор хлоропланита имеет равновесие: IPtCUJ » 4 — + H, 0 [PtCbOHj] ’+ CI’(K-3-1 (H) и [PtCUOH.] + H, 0 ** [PtCla (OHs)) » | 4-SG(KMO —).Согласно схеме, полученный ахнон частично диссоциирует: (PtCljOHJ ’ [PtCl, OH] » + H-(K-1•10 «7), IPICIi (OH.) J * (PtCh (OH) OH.))’ + n-(K = 6 -») и(PtCI, OH (OH), r ^ Ipt2 (OH) tJ» + H + H — (Л= » 5-10-9).как видно из приведенного значения константы, кислота функция рассматриваемого ахнона выражена достаточно слабо.
74) взаимодействие PT с соединением галогенид Pd11 протекает по схеме с » железистым [NR]] r. например, 21N (CjH5)»] Br + 2Kj (PtBr4] — 4KBr-1 (C, H5) » WPtjBreJ. In образуется сложный комплекс, 2 атома брома соединяются, и платина остается в четырех конфигурациях.[Pt (SnCl.) 5P-и [PTH (SnCU) соли комплексных катионов, включая 4F〜анноны, представляют собой интересные производные двухвалентной платины с аномальным координационным числом 5.Оба имеют тригональную структуру[первый d (PtSn) 2.54 A].
Известно взаимодействие комплексов Prn NaN со спиртовой средой соляной кислоты и PdClj (PdClj (Nj) j] 2-и[Pd (N9) 4] a».Взрывной соль»с-в{Пт (Н), подобные. 75) большое количество аммиака Pt14 и Pd’4 в основном соответствуют типам[3(NHs) 4JXj и 13 (NHj) sXi1 -.Оба охарактеризованы внутренней структурой шарика как квадрат, который имеет Ei в center. In в частности, [Pt (NH.) 4JXj дал много солей, в том числе различных анонов. Общая нестабильная константа этого катиона составляет 5-10«, а для K (PtN)она будет равна 2,8. Стабильность большинства амнионов Pt8 *и Pd * 4 относительно нагрева очень высока.
Таким образом, бесцветный IPt (NH**) 4jcli-HaO после расщепления кристаллической воды не изменяется до 230°C, и только 2 NH теряется при этой температуре и выше. (Он передается в [Pt (NH$) iClj].(Pd (NH$) 4jr), подобный переход происходит быстро при 180°C хлорида, 150°C бромида и йода prn 110°C. lPd (NH) 4] «дают значение 4-10» 30. 76) в пергаменте 2-го потребительского товара объявление X более или менее прочно привязано к Комплексирующему агенту.
Так, например, вновь приготовленный раствор желтого[Pt (NH3) jClal проводит мало тока, и при добавлении AgNOj к осадку AgNOj осадок AgCI осаждается не сразу, а постепенно (поскольку C1〜NH эволюция сферы медленно прогрессирует) в желтом[Pd (s | / sCl], но состав хлорного связывания аналогичен составу слабого и это почти нерастворимое соединение в этом растворе Н3, растворенном в аммиачной воде, снова осаждается в соляной кислоте, оставляя палладий черный когда кальцинированный, поэтому его можно использовать для чистого палладия. Pr не транслоцируется ни в одну из молекул NHj, а константы связывания Pt-N и Pd — N оцениваются как 2,2 и 1,9 соответственно. 6 «S〜» 8 ″ 10 S0″
77) хорошим примером комплексного соединения, в котором двухвалентная платина присутствует одновременно как в катионах, так и в Аноне, является водорастворимая Зеленая соль [Pt (NH«) «IPtClJ, осажденная путем смешивания раствора[Pt (NHj)» JCIj и KHPtCIJ. In его кристаллы, катионный катион (d (PtN)= 2.06 A) и Анкон (d (PtCI)* 2.34 A]расположены попеременно вверх и вниз(d(PtPt)= 3 3.25 A).
Подобно структуре солей красного палладия, атомы платины фактически оказались шестикоординатными-[Pd (NH |)4) (PdCI»], и расстояние Pd-Pd в них примерно такое же, как расстояние платины. Окружающей среды гладко по схеме[Пт (Нью-Хэмпшир$) <HPtClJ * — ЛПТ(Нецах) » Ди] Ди+ Пт 78) известны многочисленные комплексы двухвалентной платины n-палладия для N с NH $, а также многие другие amines. An примером могут служить их dnmentglnoxnmates, структура которых аналогична соединению никеля (рисунок XIV-42).Обычно комплексы Pt11 более стабильны, чем аналогичные комплексы Pd11, но относительная стабильность основания гидроксианамина[3 (NH2OH)»J (OH) i и его солей явно противоположна. Фактическая нерастворимость в холодной воде(и разбавленная HCI) интересна для желтого ztlendamnamy комплекса платины-(Pt (En) ClJ.
Oppsayo содержит много аминсодержащих смешанных комплексных производных, таких как желтый [Pt (CO) (Py) CljJ 79) соли пяти нуклеиновых кислот, характерные для Ru11 и Os11, интересны тем, что молекулы азота могут занимать 6 позиций во Внутренней Сфере. Общим методом образования таких соединений является взаимодействие RuCl il OzCl <гидразин. Желтый диамагнитный комплекс, выделяемый раствором, имеет состав[3 (NHs) eNj] Xj. Где E-Ru или Os, а X-одновалентный Анон. Они очень медленно разлагаются в воде, устойчивы в сильных кислотах и почти не поддаются окислению(см. Дополнительно 62).
Исследования этих соединений показали, что молекула: N ««N: связывается с комплексообразователями путем донорного связывания, а 3 — »- N ««N группа является linear. In обнаружено ядерное расстояние соединения, подверженного воздействию хлорида рутения, d (RuN)= 2, Il n d (NN)=» 1.12 A. Волновое число из N «Н〜Н облигаций снизилась примерно на 300 (ру) нлн 300 cmgh (ОС) по сравнению с бесплатной молекулу азота (<о»= 2331 см-1) и волновым числом около 500 (ру) соответствует Э— НЖ облигаций жестокого 530 см-х (ОС).
В результате, при переходе с ру на ОС, прочность сцепления с Нью-Джерси увеличивает незначительно (вероятно, из других сложных облигаций), но она небольшая, и молекулы на заменяется довольно легко со. В то же время азот замещается молекулами воды путем пропускания тока Na через раствор, содержащий non — (Ru (NHj) sOHj].[Этот путь формирования в Ru (NHa) sNap наиболее интересен. ) $ J (BF») 4.Молекула азота регулируется линейно методом Ru — ^ NeN — ^ Ru С d (NN)= » 1.125 A. имеется обзорная статья*о молекулярных азотных комплексах («интрохеин»).
80) аммиачные комплексы не характерны для Rh11, но известно красновато-фиолетовое диамагнитное производное типа dnnndn[Rh Dipyi CIA] (A-NOJ или CU^).Они, вероятно, одномерны. И наоборот, красный (Ru Dlpyj) C1a-6HaO N зеленый(Os Dipys) CI | * 6НаО является мономером. Оба этиола очень растворимы в воде и очень устойчивы к воздействию различных химических веществ. Атом с 3 молекулами dnnrndyl, diamagna[Ru (CO) aPyjljJ. 81) когда PtClj нагревается до 200 * C в потоке PFS, получается бесцветный кристалл [PtCla (PFs) a] (mp 102, mp 240 * C decomp. it это не так. Нагревание в избытке PtCla является оранжевым[PtCljPFj] (MP 156, MP 290°С разложение). это не так. * Бородко Ю. Г. Шмлова. Е. и успехи в химии. 1949, м. 5, 761.
Полевка этих соединений-мойомелон, который имеет цис-структуру 4,4% бензола), а 2-й-димер(включая сшивку хлора). во влажном воздухе оба быстро становятся холодными. 82) кристаллические соединения PtCla (и PdClj) и PC1a близки по составу и структуре и были описаны в течение длительного времени. При использовании воды или спирта сложный фосфоротрон преобразуется в P (OH) a или P (OR) соответственно, не разрушая Pt-P bond. In в этом случае следует отметить, что стабилизация осуществляется за счет комплексообразования его трехосновной формы, что является необычным для фосфорной кислоты(IX§ 5 add.26).
83) многие продукты добавляют Pd11 PD11 «молекула типа 9R» к Pt11, но E_P, As, Sb и R являются органическими радикалами. Простейшими представителями nx являются желтые nln-оранжевые комплексы PtraLa и PdTiLt. Производные Г-01, Вг, I и L-P (Canb) e-платины, как правило, являются CFC, N является транс-типом, тогда как только последний является особенностью палладия. 84) длины как палладия, так и платины были получены хорошо кристаллизованными 2-ядерными комплексами, содержащими L (C1) e01c1e (C1) L-типа хлорные мостики.
Где L — алкильное производное элементов ряда P-As-S-Se-Te-Sb(стабильность комплекса снижается).Примером может служить P <bC1 «(P(CaH») » s (mp.230°C).как правило, соединения платины более стабильны, чем соединения палладия. 85) в этом отношении интересен желтый комплекс [(CjH6) jPkP4Ge (CeH5) jJj (аббревиатура Q).Уже при комнатной температуре и атмосферном давлении, реагируя с молекулярным водородом по схеме: Q + Na-HGe(CeH5) a + {(CaHs) aPbPt (H) Ge (C»He) a. смешанные комплексные соединения, содержащие атомы водорода во внутренней сфере, очень характерны для некоторых двухвалентных платиновых металлов. Простейший представитель nx может рассматриваться как бесцветный[PtHj (PRa) j).Где R-CbH5(decomp. At mp 177°C), довольно устойчив на воздухе, нерастворим в спирте, слабо растворим в бензоле.
Из раствора в пиридине 1a немедленно высвобождает Na (моль / моль).Кроме того, [PtHa (PRj) J n (PtHa (PRa)) » J. все они являются производными Pt8 *и содержат более широкое соединение родового 3Hr(PRs).а. Е ПТ или ПД. Бесцветный диамагнитный PtHCI { P (C2Hshb (mp 82°C), стабильный на воздухе, дистиллированный без разложения, легко растворимый в органических растворителях. Интересно, что PtHCl (PRa) a + C2H Pt (CaH5) CI (PRa) a. Квадратная структура аналогична бромистой, d (PtP)= «= 2.26 а и ZPPtBr-94е, а связь с платиной в трансформаторном положении не замещается водородом атома брома, по сравнению с обычной (d»2.4 А), удлиненной (d = 2.56 а) становится слабее.
86) как Ptn, так и Pd11 содержат соединения состава 023 (PR$») ’ a, и они образуются в бензольной среде при 3°С по схеме (PRa)» + 02 «= Oj3 (PRa) a-f 2PRa 20.Гораздо более стабильны, чем аналогичные производные никеля (§ I, 118), только prn 90°C распадается на RaPO и E. структурное исследование стального сольвата 02Pt (PRs) 2 CeH, d(OO) » 1, 45A. 87) координационным числом 6 являются свойства платины и палладия в Руит и ОС. Эти элементы, например |(CO) 2b2.It представлен различными соединениями, такими как ENG (CO) b8.Например, бензольный раствор Os (CO)$ L2 {здесь L синтезировал P (C «H5») a]кристаллический комплексOsH (CO) aLa.
Это соединение интересно из-за одновременного присутствия отрицательного водорода (во внутренней сфере) и положительного водорода (во внешней сфере).Многие производные обеих солей с другими Анон и нейтральных молекул были получены-(OsH2 (СО) ljj, (OsHCl (Колорадо) судья по административным делам) судья по административным делам[oscij (Колорадо) Алайский хребет.
Комплекс (OsHj (CO) (PRj) s) также известен. n fOsHa (PRj) » J, где R-другой органический радикал. Примерами структурно изученных соединений являются бесцветные OsHBr (CO) La (mp 276°Cdecomp) с искаженной октаэдрической структурой с Os bonds. It is-P (CeN$) I P-Os-H координата (2.56 A) намного больше, чем P — Os — P координата (2.34 A) типа{RhraLj) A, и комплекс RhftU описан для двухвалентного родия. Где L-это AsR * 88) очень стабильный не невротический бивалентный платиновый комплекс соответствует типу (P r » (CNR) 2] n (Pt (CNR) K KPtr)).Примерами являются светло-желтый (PtClj (CNCHj) jJ и красный[Pt (CNCH.) 4HPtCI4J. Pd » характеризуется соединением только первого типа.
Например, диамагнитные производные оранжевого [PdI2(CNC $ H$) 2]-Ru11 и Rh11 соответствуют типам[Rur2 (CNR) 4]и (Rhr (CNR) 4)2×2 примерами являются желто-зеленыеRuC12 (CNCHj) 4J и зелено-черные (Rh2l2 (CNCeH) $e (215 ° C). 89) интересным является комплексное производное бивалента, которое оплачивается молекулами этилена во Внутренней Сфере. Таким образом, при пролонгированном действии C2H4 на слабокисленный красный концентрированный раствор получается желтый комплекс K [Pt (CjH4) CI$].
Стабильность этого соединения относительно невелика, не-CN -, SON», N0″, G, Br » этилен более или менее легко перемещается из Внутренней Сферы. Когда K [Pt (C2H4) Clj) обрабатывается спиртом HCl, KCl отсекается и образуется оранжевый полимер[Pt(C2H4) CI2] 2, только около 200°C разлагается. Однако он чувствителен к влаге и очень растворим в спирте и ацетоне(AC).Интересно, что в кипящем растворе ацетона будет находиться Мономер(вероятно, по схеме{Pt (C2H4) CI2) i-f 2Ac ** 2Pt (C2H4) CI2Au.
By при взаимодействии этилена с раствором безводного ацетона pr −70 ° С получают желтые кристаллы этиленового комплекса [(C2H4) 2PtCI2).Поскольку последний очень нестабилен, равновесие [Pt (C2H4) Cl2l2 + C2H4 * * 3t * 2tPt(CjH4) 2CI2J фактически происходит в насыщенном этиленацетоне. даже pr-10°С сдвинулся влево. 90) по рентгеноструктурным данным оба этилен-углеродных атома расположены симметрично относительно атомов рассматриваемых комплексов(расстояние от него до центра li между инт составляет 1,6±0,2 а).
Существует 2 основных подхода к интерпретации сложного характера присоединения этилена. Согласно 1 из них, связь C = -C сохраняется в 2 раза, но ее самоизлучение (x§ 2 add.(См. 18) одновременно выполняет донорскую функцию (т. е. само-донорскую связь) по отношению к платине. Согласно другому методу, двойная связь становится простой, в результате чего образуется нормальная валентная связь платины и углерода (значение x (CPt) равно 3,2).
Длина углерод-углеродной связи молекулы этилена, связанной с платиной, составляет 1,65 а [k (CC)= 6,55], второй подход представляется более правильным. 9!) В случае палладия был получен [Pd (CjH4) Cl2] j. ^Плоская структура, в которой установлено наличие сшивки хлора и транс-конфигурация (pr перпендикулярно общей плоскости) обеих молекул этилена. Было показано, что синий раствор RuClj в сильном HCl способен поглощать до 1 моль этилена на 1 г атома Ru, желтеющий, и полученное соединение не будет выделено.
Для близких родственников известна производная катиона [RhL2P \, где L-Cb (CH$) c. 92) простой цианид-Pt (CN) x-не распространен в платине. (NH4) j (Pt (CN) 4]нагревается до 200°C, образуется в воздухе в виде желтых аморфных и самовоспламеняющихся веществ. Нерастворимые в воде и щелочных Pt (CN) 2 кислотах образуют раствор цианида и соль Hj (Pt (CN ^ 4).Эта сильная кислота является двухосновной, а бесцветная сильная кислота (Pt(CN) 4p) характеризуется значением*(PtC) −3,4 и очень сильной (нестабильной постоянной MO)
41). Кристаллические гидраты, такие как Ag2 [Pt(CN) 4) и Na2JPt(CN) 4] −3HaO, бесцветны, но многие другие кристаллические гидраты имеют очень красивый цвет. o зависит от положения (плеохроизма) Кристалла относительно падающего света. Например, Ba [Pt (CN) 4] −4H20 (растворимость 35 г / л при 20°C) является зеленовато-желтым или сине-фиолетовым. kslotot может быть отделен в виде красного кристаллогидрата Hj(Pt (CN) 4] −5H20.
Под воздействием рентгеновского или радиоактивного излучения в кристаллах бария возбуждаются кристаллы желто-зеленой флуоресценции. Это является основанием для использования экранов, покрытых этой солью, при изучении радиоактивного распада и работе с рентгеновскими лучами. 93) среди смешанных производных Зандо двухвалентной платины наиболее интересным является очень стабильное Мономерное соединение типа [Pt (CN) a(CNR) fJ.
Метильное производное представляет собой бесцветное кристаллическое вещество, полученное прямой реакцией Chjnc с раствором KrfPt (CN) α]и слабо растворимое в воде (но хорошее для CHjOH). обратное расщепление нитрилов nz достигается только под действием концентрированных растворов KCN. Наличие связей Pt-Ge важно для комплексов in (CH3)»MPt (CN) j (GeR3h).Где R-CHH$. 94) по схеме ПД (Ной),+ НД (СN),= др (СN) Аль + НД (с бортовым номером 03) с собой белый аморфный осадок Xanda двухвалентных палладия могут быть получены. Фактическая нерастворимость в воде иногда используется для отделения палладия от других металлов.
Сложный цианид этого элемента изоморфен соответствующему соединению платины. примерами hx являются бесцветные Ka [Pd(CN) 4) — 3HjO и зеленоватые Ba (Pd (CN)»]- 4H » 0).для не (Pd (CN)» f -, k (PdC) значение константы прочности связи «2.8 и k(CN)» = 16.7, а ее константа неустойчивости равна 3 * 10 ″ м. Величина последней явно неверна. Потому что свободный Ha (Pd (CN) 4)содержит избыток HCN. 95) сложный цианид, полученный из EA *, также известен как рутений и osmium.
In состав, они соответствуют соответствующим производным железа и сходны с ними во многом properties. In в частности, бесцветные KlRu (CN) e] * 3H | 0 и K <[Os (CN) e] −3HjO кристаллизуются изоморфно с желтой солью крови, проявляя аналогичную реакцию с солями тяжелых металлов. Свободная кислота H4E (CH)#] представляет собой бесцветный кристалл, растворимый в воде и спирте. (SfCNje) 4-для константы связи ионной силы значения k (RuC)= 3.2 и*(OsC) равны «3.9 1 для k(CN)=» 15].Среди смешанных производных следует отметить бесцветный кристалл lRu (CN). (CNCH, 4)
96) Красный Pd (SCN) j или коричневый Pt (SCN) осаждается действием KNCS на раствор Kt (ES1).С избыточными осадителями они образуют красный комплекс роданида Kj (3 (SCN) J JJ, который легко растворим. (NH3) 4IPt (SCN)»] интересен тем, что он практически нерастворим в воде или ацетоне, но хорошо растворим в смеси растворителей обоев. 97) интересен также смешанный комплекс палладия. Внутренняя сфера квадрата содержит 2 иона родандия и 2 молекулы E-типа (C» H3) a (взаимно трансформирующее положение).
Если-СБ. Затем связь Pd-SCN сохраняется (в результате взаимодействия (С6Н5″) a-далее L-и Kj (Pd (SCN)»)).— В случае As образуется желто-оранжевый [PdLa (SCN)a].[PdLa (NCS) j] меняется на более стабильный ярко-желтый (pr-30°C при 150°C в минутах) [pdla (NCS) J] (разложение только при 195 ° C).Наконец, в случае E-P, немедленно введите комплекс (PdLj(NCS) aJ. Очевидно, что во всех 3 случаях структура с связью Pd-NCS более стабильна, и фактическое расположение связано с тем, что скорость изомеризации исходной связи Pd — SCN зависит от других свойств. 。
Следует отметить, что объединение частиц влияет на P (C«H$$)$, а более объемное dipnridnl-подобное ASFC ^ Hs). 98) смешанный 1D тиоцианат платины lPtjC! JLj (SCN) a! Где L — P (CjHr) s. в том числе 2 моста противоположного направления drodan group (tf (NC)—1.31.d (CS)= 1.66, d(PtS)= 2.44, d (NPt)= 2.05 A. ^ SPtN = 101e].стоит отметить, что длина двух соединений Родена значительно увеличивается по сравнению с обычным значением(X§ I дополнительный
151).Возможность различного расположения концевых групп в плоскости молекул рассматриваемого комплекса определяет наличие изомерии. TpaHc-S. разборка при C «1.57, mp 150» C. другой (C1-trans-I c = 1.36, mp 175X) с желтыми кристаллами имеет зеленоватый цвет. Желтый. Смешанная структура тиоцианина (s’bolee complex L) известна и палладию. 99) нормальные признаки безводного состояния, полученные при растворении металла в нитрате палладия нитрат нитрата двухвалентного, сомнительны. Возможно, dngndrat сформирует-Pd (NOj) j-2HjO. При нагревании под давлением 0,1 мм рт. ст. В NjO $до П0°С. Искусство.
Действительно безводный ПД (Ноа) J является возгоняется и конденсируется на охлаждаемой поверхности. Известный n оранжевый красный KJPd (N03)»].он стабилен в воздухе, но быстро разлагается с водой. 100) при испарении нитрата HCL4 получали коричневый перхлорат Pd (C104) a•4HjO. Его структура, вероятно, соответствует формуле{Pd (0H«) «J (C10») j, поскольку он не теряет влагу в вакууме выше pjo$. в растворе эта соль стабильна только при низком значении рН, и нет молекул или ионов, которые легко образуют комплексы с палладием.
101) в случае двухвалентного палладия, типа МЮ {ПД (Ной)], МДЖ (Пдрт (Ной) J], и{PdLj (Ной) Я. (л НХ и т. д.) известны как световой комплекс. Желтый Ks (Pd (NOj)4j. нестабильная константа Иона iPdfNOiJJ имеет порядок 10〜.Смешанные комплексы обычно получают только в транс-типе. Несколько исключений составляют cns и TpaHC-(Pd (NH3) a(N02) j).Более устойчивыми превращениями являются бледно-желтые кристаллы (2 г / л), бледно-желтые кристаллы(при взаимодействии Pd(NOa) j и N0), а также доказательства возможности получения легко разлагаемой PD (NOj)воды.
Двухвалентная платина образует уникальные комплексы подобного типа. Самый простой пример-бесцветный KTtPt(N0j»)») — 2H » 0.It легко растворяется в воде (40 г / л).Для смешанных производных, как правило, n cis и преобразование желтый и красный (Pt (NOs) s (CNC «H») 2). 102) некоторые соединения, содержащие производные серы, характерны для двухвалентного палладия, платины и некоторых рутений. Из них сульфаты известны только о палладии.
Растворимые коричневые кристаллы PdSO-2hso коричневого цвета при нагревании сначала обезвоживаются, а затем разлагаются на PdO (около 600°C).примером комплексного сульфата является оранжевый[Pd (NHt)tSO»], слабо растворимый в воде. Благодаря взаимодействию мелкодисперсного Палладия с селеновой кислотой (VIII§ 4 add.37), и был получен красновато-коричневый PdSe04. 103) основными типами обычно бесцветных или желтых сульфитных комплексов палладия и платины являются MjI3(S0j) j)и Me {3 (S03) «L. последний может быть более точно определен как Mj(3 (SO»M) 4).
Эти комплексы обычно отделяют от раствора, содержащего кристаллическую воду. Например, бесцветный NaJPt (NHj) (SO » h), оранжевый lPd (NH3) «SOj1 и красный (NH») s (PdClaS03)•NaO. In все эти соединения, связь между сернистым анионом и центральным атомом явно через серу. 104)интересно смешанного типа комплекс аммиака сульфон двухвалентный рутений.
Почти нерастворимый бесцветный{ру (НХ9) 4 (S03H) 2]под влиянием NHOH о преобразуется в бесцветный и нестабильной{ру (NН3)$ С03] −2Hj0 и немножко soluble красный лру (Нью-Хэмпшир) 4) (С02) ХЛ (параметр РФ (сі)== 2.13 и D (Рус) = 2,0 а)$ компания SJI кислота (Рус = 2.0 а) при действии НС1. RU (NH3) преобразовано в ssojlb. It известен своими стабильными красными солями, которые содержат много отрицательных ионов (CI -, Br, NO-и др.).Все они диамагнитны. 105) тоносурфатный комплекс характерен только для двухвалентной платины. Их главным представителем является желтый Na ^ Pttsaojj-lOHjO. Формула этого соединения NaJ (Pt (S10, Naf4) — IOHJ0.
И это может быть более точным, чтобы написать. 106) черно-бурые отложения Пхф, осаждаются при воздействии растворов сероводорода и соли ПД**. (NH4)2S нерастворим в разбавленном растворе HCl n. Hjptcl4 простой активный раствор сероводорода осаждает черный сульфид PtS. Oi можно получить непосредственно из элемента путем нагревания очень мелкодисперсной порошковой смеси (образующей тепло 12 ккал / моль) около 1000 ° C. In кристаллическое состояние, PtS (т. е., 1229 ° С) является、 На царской водке почти растворяется щелочь и кислота.
Для обоих элементов также известны 3se serenade и ET telluround. 107) для Pd11 и для Pd11 золь[E (Tho) 4p * образуется из ионов. Здесь Тио является общим тромбом(X§ 1 add.103). нестационарная константа (Pd (Thio) J-порядка 10°°.[Pt (Thlo) 4] основные свойства (OH) j выражены довольно слабо(Ki » 5-10 -«.Kg „5-10“°). 108) соединения состава 3 (HNtSj) i <для обоих элементов также являются known.
In по структуре и свойствам они близки к аналогичным производным никеля ($1 сложение.213). 109) рентгеноструктурное исследование комплекса (pdClj ((CH $2SO) i), обе молекулы DNAmetalsulfoxind (x§ 2 ext.78) имеет атом серы (d (PdS)= 2.30, rf (PdCI) −2.29, rf (SO)= 1.47 A. At в то же время, non{Pd ((CHj) iSO]<) > 4, по косвенным данным, добавление осуществляется как с серой, так и с кислородом.
Пространственные ограничения допускают такие различные корректировки одних и тех же сложных лигандов, но только прямые структурные решения могут быть решены, если они выполняются в этом случае. 110) исследование бензольного раствора ацетата палладия показало, что сдвиг вправо равновесия по схеме происходит при переходе его из нормального состояния в Точку кипения: [Pd(CHJCOO), l,* * 3Pd (CH, COO) a. взаимодействие уксусной кислоты с TsN (OH) 3 дает RH (CHaCOO) j-HjO, зеленый ацетат, который формально является двухвалентным родственником.
Это вещество является диамагнитным и имеет принципиальную схему, показанную на рисунке. XIV-49 представляет собой очень короткую-2,45 л (2,68 а для металлов)-2 — мерную структуру валентной связи Rh-Rh. Молекула H * 0 легко заменяется (аммиаком, пиридином и др.).Но основной скелет соединения очень стабилен. Многие формиат-производные родия являются двухвалентными общего типа[Rh(HCOOhX] i, где X-NaO, NH$ и др.) также известны. 。ГЛ.. С, Н». 111) комплекс щавелевой кислоты очень характерен для палладия и платины.
Желтый кристаллогидрат свободной кислоты: Hi | Pd(Cj04)2] −6H20 и Hj [Pt (CjO»)j] — 2HiO-получают путем обменного разложения солей серебра и HCl. И без того незначительная смесь Pt, v придает желтому комплексу Ptn более темный оттенок различных цветов. [RCSCO *)} если кроме 2 — < * (РУ)»2.00 а. Константа нестабильности палладия-ацетилацетата-Pd (CsH7Oah-порядка 10 112) бледно-желтый, довольно Летучий Ru (C * H5) a (mp.196°С) — циклопентадоненовое производное двухвалентной платины metal.
It растворим в органических растворителях и химически устойчив в отсутствие окислителей-разрушается щелочами и кислотами. Структурно он аналогичен ферроцену (X§ 2 ext.34), относительное расположение циклопентосилан-тиофенового кольца в кристаллах обоих соединений различно(рис. XIV-50).Осмий, состав С$Н 05$ (С0)2Вг(Мп 121°С)бледно-желтого смешанных производных описаны, описано около платина, оранжевый составные CjH5PtNO(Мп 64°С)являются. 113) Схема 3° + 3 * =»согласно нормальному потенциалу Rh и 1D приближению, соответствующему переходу на Э, они будут равны+0,8 n 1,15 в (кислотная среда) или+0,04 n +0,1 в (щелочная среда) соответственно.
При сложных вычислениях они смещаются в отрицательном направлении n. например, для HCI он будет равен+ 0.44(Rh) и+0.77 in (Gg). 114) серый RhjOj получают нагреванием металлического родия до 1000°C в атмосфере кислорода (однако, если он превышает 1100°C, элемент разлагается). Рисунок XIV-40.Структурная схема! Rh (CH3COO) j * HJOJJ. Теплота образования оценивается в 68 ккал / моль. Черный Ирджой известен, но его нельзя получить в чистом виде(как это принято утверждать по схеме 21 g * 0 «= 31gOa + Ir). Из раствора щелочных солей Rh111 выпадает лимонный, но желтый Rh (OH) осадок, не растворимый в воде, но легко растворимый в кислоте(и сильном коне).Аналогичный зеленый гидроксид Nrnnya получают при действии разбавленной щелочи на раствор Na3[IrC! Ми.]
Поскольку 1 г (OH)4 легко окисляется атмосферным кислородом, в атмосфере nndn образуется газ. Желтый Ru (OH) окисляется еще легче.„Было сообщено, что Ca (RhOj) a был получен путем сплавления Rha03 и CaCO3 prn 1150°C. 115) галогениды трехвалентных платиновых металлов характерны для рутения, родственных, Nrnnya и частично osmnia. Известное значение теплоты, выделяемой на один элемент, сравнивается с нже [ккал / моль). RuClj RuBra Rul, Rhoclj RhBr “ IrCJ3 GgVg, OsClj 49 43 38 U 50 50 40 46 Как правило, галогенид EG4, полученный сухим способом, имеет темный цвет и нерастворим в воде.
116) путем раскаления родия-Керна в атмосфере фтора выше 400°С можно получить красные кристаллы RhF3, нерастворимые в воде, щелочи и кислоте. Аналогичные характеристики характерны для коричневого RuF3 и черного IrFa. В RuFj и RhF3 кристаллы, ядра * расстояние е-G составляет 1,98 А. В IRF$хрусталя 2.01 А. 117) уже подключенный к хлору Rh составляет 250 ° С. И ИК, только около 600°C для обоих элементов, хлорид NCH ES13 (красный RhCls и серо-зеленый, входящий в желтый кристалл IrCIk через длительный нагрев до 650 ° C) является наиболее стабильным производным хлора в нормальных условиях. То же самое можно сказать и о коричневом черном RuCI3.С другой стороны, для Osm OsCU более стабилен(но Osl-лучший iodnd).Хлорид хлористый Ru, Rh.
Размеры и структура ИК аналогичны AlaCI (рисунок XI-2I). давление, равное давлению хлора I атм выше nnmi, достигается при следующей температуре (°C): 770(Ru). 948 (Rh), 763(Ir), 558 (Os). 118) EG * nH » примерами растворов NS, полученных из 0 кристаллогидратов, являются красные RhCI3-ЗНаО, которые растворяются в воздухе и легко растворяются в узлах. Его водных растворах, вероятно, желтеют в связи с переходом из-за схема [RhClj(Оха) Т] — * — ЛРХ(OHahJCl, (хлорная кислота катиона[РЗ (Оха) «П раздельно)). RhCl3 легко растворим в воде до 180 ° C, но при дальнейшем нагревании переходит в нерастворимую форму.
Очень низкую растворимость Rhl3 можно использовать для того чтобы отделить Rh от Ir. In контраст к сухому подготовленному IrClj, Temio-зеленый цвет 1gC1 » — ZN20 легко melts. It растворяется в (NH4) aS, пропуская коричневые IraS в раствор сероводорода. Относительно подобные черные сульфиды осаждаются при холоде; только n становится нерастворимым в (NH4) aS. Красный RhF-9H20 N зеленый OsClj-3HaO также перечислены. Константа диссоциации кислой среды по схеме ES13 * ES1a-fCH равна L0 ″* (Rh) n 4-10 — ’ (Ru).
119) соединение Галогенида рассматриваемого трехвалентного элемента характеризуется типом Mz (EHv) и частично типом Ma (3r5OHjJ).Первый тип производных калия-красный (Ru, Rh. In ОС) или зеленый (ИК), Ихао (ру. Rh) в nln 3hjo кристаллизуется (Os, Ir).Наиболее практически важным из содержащихся здесь соединений является зеленый Na ^ IrCI], который служит общим исходным материалом для получения различных производных 1g. Атмосфера HCI при температуре −500°C. 120) при замещении во внутреннем круге[ES1®) 5 «1 ионов хлора и молекул воды, производных Ru, n Rh цвет практически не изменяется, в то время как KallrCUOHaJ имеет оранжево-красный цвет(это соединение не характерно для осмотического давления).
Рисунок XIV-50.Графически проиллюстрирована структура ферроцена и лютецена. Бассейн воды плотно соединен, например KafRhCI3OHa] только на 250°C отрезан. Найдены производные рутения= 2,04 и< / (RuO)= * 2,12 a pr Среднее значение d (RuCI)=-2.33 A 121) некоторые железы в составе EG3 также известны как палладий (F) и платина (CI, Br, I).Из них черный PdF3 (официально единственное известное производное 3-валентного палладия) может быть получен действием фтора на PdClj prn 250 ° С. Взаимодействие с водой сопровождается выделением кислорода. Структура этого соединения соответствует химической формуле Pd [PdFe], которая включает двухвалентный и четырехвалентный палладий.
Его Mwff = 2.88 соответствует спиновому моменту Pd2*. об этом свидетельствуют соединения, содержащие явно диамагнитный Анон, например (SnFe) 2. 122) трехвалентные платиновые темно-зеленые хлориды образуются при нагревании металла до 400°С в атмосфере хлора, растворенного в воде без разложения, но при нагревании с HCl он разлагается по схеме 2PtCl3 +4СГ = fptcuj » — f (ptci$»).Например, структура CsjPlCU соответствует выражению CsjPtCU-CsjPtCU. 123) из карбонильных соединений трехвалентного платинового металла наиболее интересными являются светло-желтый Pl (CO) jF3 и оранжево-красный Rh (CO) 2F3.
Единственное известное-это карбонфлорды. Первые соединения были получены действием CO на PtF4(под давлением). он может быть сублимирован в вакууме, но затемняется на свету, гидролизуется во влажном воздухе и постепенно разлагается при контакте с бензолом. Производные родия, которые улетучиваются даже под вакуумом, являются более stable. In бензольный раствор, это димер, и связь между молекулами мономера явно осуществляется сшивкой фтора. 124) Csa {RhCls(OHa)] при насыщении раствора монооксида углерода получали оранжевый [Cs ^ RhCljCO].
Известен также комплекс[N (CeH3) 4IRh(CO) F4].Вероятно включает в себя йодный мост и днмерной Anon. As как видно из рисунка XIV-51, аналогичные структуры имеют димер-Nd-дневные комплексы(1gC1a (CH3) (CO)? Также сообщалось о связывании CO и иридия[1g (CO)313] n бледно-желтого{Os (CO) aBr3]. 125) темно-коричневый галогенид Нитрозила Rh(NOhr(G CI, Br, I) образуется при действии N14 на раствор CC2RJJ (Co) N0. (БР) черный (я) лютеин нитро Лидо можно получить при 230°C в соответствии со схемой ру (Колорадо) — младший * — ф-ф нет * = т 2ПК■ + ру (нет) г. Возможно также полимеров.
Для известковой платины, красно-коричневого K (Pt (NO) CI » l. в семенах отмечено присутствие нитрозогалида аналогичного состава. 126) аммиачный комплекс трехвалентного платинового металла является наиболее характерным для Rh, 1g, Ru. Наиболее распространены аммиачные производные tnpa(3 (NH3) e) X3. Если Х-одновалентный анион, то они обычно бесцветны, а те, в которых содержится небольшое количество молекул аммиака во Внутренней Сфере, часто имеют желтый цвет. Некоторые из них очень термически стабильны.
Например. (РЗ(NН3) е] CL3 по разлагается только пиар-290°С, и lRhr pentamnes(NH3b] Р, пр 340 (С1), 320(Бр), 290eC(я).Бледно-желтый [RhCl (NH3b] Cla слабо растворим в воде (8 г / л), при 10% HCl значительно меньше (0,07 г / л), пригоден для осаждения родия, растворимость в воде почти такого же состава и цвета, как и производные иридия, также ярко-желтый[RuCl (NH3) 3lCIj интересен тем, что он также может выдерживать длительное кипячение в соляной кислоте, но лучше использовать блендер или блендер. / irCia(СН3) (Колорадо) Дж] а.
Значение d (RuCl) −2.34 и d (RuN) этой соли составило 2.07 ч-2.11 А.[3(NH)) раствор 60HJ ведет себя как слабая одноосновная кислота в растворе, степень диссоциации ИК—ряда Rh-Ru незначительно возрастает. Композиция [Ru (0H) Cl (NH*) «JCI-H» 0 («ruthenium red») Air stabilizer complex обладает очень сильной красящей способностью. Oi теряет кристаллическую воду только при 150 ° С. 127) гидридный комплекс[RhH (NH)) 5) SO был синтезирован за счет взаимодействия RhCI (NH) s] S04 с цинковым порошком и аммиачной водой.
Это белое кристаллическое вещество стабильно при хранении на воздухе, а также стабильно в воздухе (RhH (NH») 4ohjjs04 можно отделить от водного раствора, содержащего ацетон. 128) осмий производит тот же тип аммиачного комплекса, но менее известен. По данным магнитных измерений соединения, 1.7, или осмий, фактически трехвалентного. В отличие от этого, формально трехвалентных платиновых производного Амина-Пт (Нха)АБР», Пт (Нью-Хэмпшир») и J (о) clj ПО, и ряд других оказались диамагнитными. Как показано на диаграмме XIV-52 (д (BrPtIT) −2), почти черные кристаллы первая смесь состоит из равного числа молекул (Пт (Нью-Хэмпшир), спальня 4)и (ПТ(Нью-Хэмпшир»), tBrj). 50, Д(Брпть») −3.03 ЭйДжей.
129) кроме аммиака, для трехвалентных платиновых металлов известны комплексные производные пиридина, dnnrndi * la, ethnlendnamn и некоторых других Аминов. Примеры типа [ЕСВ / С1$] (е резус -, ИК -), Ион (SDipyaJ (е ов, ОС), и[3En, Дж (е ов, ИК, РС, ОС)).IRhEniCIt) * интересно, потому что ионы преобразуют Борат натрия (Rhenjhj1″. NaH4) sCls] Cl » 1 молекул гидразина, по-видимому, играет роль в мостике между атомами рутения. 130130) многие комплексы, содержащие в своем составе молекулы 3Ra, известны для 3-валентного Кина, иридия, осмия и рутения.
Где э-р, Как, ШБ, R является органическим радикалом. Особенно характерны производные типа (EGa (CO) La].Где L — p-CbH5.»Желтый IrCl, J, может быть самым простым представителем рассматриваемого соединения. 131) для L_P (CBH5)$ были получены все члены ряда lIrCl»Ls]-[IrHCIaUJ-(IrHjClLj]-[Irhjjli). В этих комплексах, которые плавятся только при 200-250 ° С, особенно выражена полуметаллическая функция водорода. Подобный nm желтый (RhHCIjLi]присоединяется к CHH4 или CaHa и переходит к (Rh (CjH5′) CljLj]или[Rh (CH ’ CH)) Cljlj, respectively. In все 3 соединения родия имеют координационное число 5.
Комплекс [Rh (NO) CltU] l lRh (NO) aC! ЖЖ. И относится к фиолетовому комплексу иридия (Ir (CO) (NO) ClLalBFi. Иридиевый комплекс с липы и диметилсульфоксид (ИК — н — о схеме), 124 °(ИК-никакая схема) (1gHCl *(Че)£О. 132) тип KJo (CN) E]сложный цианид характерен для родия и иридия. Они бесцветны и очень растворимы в воде. water. By действие бората натрия, lRh (CN) p-преобразуется в (RhH (CN) 5}> -.Известно, что подобные [IrH (CN) iJ * \соли обоих анионов являются диамагнитными. Комплекс KalRhH (CN) 4OHa]связывает интересную молекулу, knlsloroA, с образованием K [[[HaO (CN)4RhOaRh(CN) 4OHa].
Не удалось восстановить Ka {Ir (CN) e] на металлическом пне(-33°C в жидком аммиаке). I-xHjO в Ru, Rh, Ir наблюдаются, их свойства недостаточны, безводные 3 (CN), родий, иридий также были получены пиролизом (NHa) J3 (CN | i). Рисунок X1V-S2. Диаграмма кристаллического состава Pt (NHa) jBrj. Желтая соль композиции[N© / [Os (CN))] была obtained. As для платины известны H [Pt (CN) J и некоторые ее соли, но платина в ней явно 3-валентная. 133) ацетонитрильный комплекс (NHa)* [3 (NCCHS) CU] ’h30 известен как у близких родственников, так и в Ирнии.
Для близких родственников также был получен комплекс фенилмаонитрильного типа (Rh (CNC®H5) Clt} X).Сине-фиолетовый хлорид растворяется при 140°C, а зеленый перхлорат разлагается при 210°C. 134) известен популярный тип взрывчатого адиумфизического комплекса Mj [3 (Na) e]для Rh. 1D и РН. Производные роданида описаны относительно родственника родителя. Красный Kj [Rh (SCN) » l легко растворяется в воде.
Анна в этой соли является октаэдром rf (RhS)—2.40 A. оранжевый Rh (SCN) 3-2h20 N желтый (Rh (SCN) tPy.] также известен.] Для темно-синего ruscn задается значение K = 1•10〜’. 135) комплексов С тиомочевиной, красно-коричневой (Os (Thio) e] Clj., Наиболее широко известно его образование в растворе, применяемом при колориметрическом определении осмия. Типы тиомочевинных комплексов 3-валентных родственников иридия значительно более разнообразны. Желтый[Rh (Thio) e) Clj и почти нерастворимый красный (Rh (Thio) jCljJ.
Родий и иридий также очень характерны для образования комплексов С органическими sulfides. In большинство органических растворов, красно-коричневый RhCU-3S (CH») желтый RhCls-3S (C H Ht) s(mp.126 * с) очень растворим, и зависимость растворимости от длины углеводородного радикала очень ясна. 136) сульфит 3a (S03) — 6Hj0 известен своими родственниками (Белый, растворимый в воде) и иридием (желтый, плохо растворимый).Например, K3 [3 (SO*) ((OHth] и NaJ3(SOj)|(NH>) j] * nHjO. Также были получены различные комплексные сульфиты обоих элементов типа I-6 (Rh) или 7 (1g).
Ионы SOJ, вероятно, связаны с центральным атомом этих соединений через серу. 137) RtbfSOOs-tHjO сульфат известен в виде желтого (L » 14)и красного (l = 4) и имеет различную связь с BaCl: желтый раствор желтого BaS04 осаждается полностью немедленно, но начинается только медленный раствор красного раствора. После долгого стояния. Это указывает на то, что структура обоих кристаллогидратов заметно отличается. Это, вероятно, соответствует формулам[Rh(0H.) eJ, (S04) — 2H20 ″ и ((H}) 2S04RhS04RhS04 (0H2) 2].
Как и оранжевые Родиевые квасцы-KfRh (S04) J * 12HjO-свинцово-желтая форма. В отличие от кровных родственников, желтые Irt (S04), — * Hj0 и K(Ir (S04) J-l2HjO несколько легко окисляются на воздухе. Для платины соединение H {Pt (SOi) i] −5HjO n K( Pt (S04hJ-H 00.Возможно, оба они на самом деле не Pt 11, а Pt и Ptiv. 138) тип K * | 3 (C204) j]сложные оксалаты известны в Rh (красный), 1 г (желтый), Ru (зеленый).Они очень растворимы в воде и очень стабильны. Из свободных узлов описаны желтый Hj (Ir (Ci04) i]и темно-зеленый H [Ru (Cx04) s] — 2l / tH> 0.Последний сильно парамагнитен, а красный Hj (Ru (NO)) (CtOJaJ HaO) диамагнитен.
Иридий очень характерен для очень сильной кислоты H |(IrClj (Cj04) i) Красной соли, которая также была получена в свободном состоянии(4H20).Браун K (RuClt (C j04) t) того же типа соединения также описан. * Н20.Желтый (RHP (Cj04) CIJ интересен тем, что он практически нерастворим в воде или пиридине, но заметно растворим в смеси. 139) подобно аналогичным соединениям кобальта, бесцветные комплексные нитриты Kj {Rh(NOt) e]и Kj (Ir (N02) e] слабо растворимы в water. In напротив, красный KJRu(N02) и]желтый Ka {0 $(N02) » для иридия и родия, nzvetites также имеют смешанные нитритные производные, примерами которых являются желтый Kj (Ir (NOt)»CI4]и lr[LR (noj) 2 (NH) 4 (CI) 4].
Нейтральный комплекс-желтый. (Rh (NOj) s (NH.) iJ и бесцветный[Rb (NOthPy » J-очень стабильный и почти нерастворимый в воде- 140)простой нитратов трехвалентного металла платиновой, только желтые сильно гигроскопичные резус(с бортовым номером 03) 3 описан. Для родия и иридия известно несколько солнечных комплексных катионов[3 (N03) (NH3) 5P. 3). 141) соответствующий ацетат является коричневым Ru (NO) (СН3СОО)-нерастворимым в воде, но растворимым в органических растворителях.
Комплексная соль NalRu (NO) (CHjCOO) jl HtO, полученная из нее, растворима в воде. Оба соединения являются диамагнитными. 142) для близких родственников, формиат зеленого гидрида Rh (H) (HCOO) aO, 5HjO был obtained. In водные растворы, аммиак и красный HsNHRh (HCOO) образуют j. используют пиридин-розовый PyHRh (HCOO).
Соединения, содержащиеся в обеих водах, практически нерастворимы(но легко растворимы в HCOOH за счет образования гидрокормата исходного материала). на воздухе он стабилен. 143) ацетат и Ланцет 3 (CsH; Oi) 3 желтого цвета(Rh. Ir) или красный (Ru. It представляет собой кристаллическое вещество. Они могут плавиться при температуре около 260°C и сублимироваться, не распадаясь в вакууме. Центральные производные
144) типа (C3H5) aEH (X-одновалентный Анон) известны в Rh и 1d. As как правило, они очень хорошо растворимы в воде, а потому трудно выводятся из организма. Диссоциация архох (CsH») по основному типу характеризуется значением «/ C * MO«.1. Rha (CeHe) e-также сообщалось 145) окислительный потенциал четырехвалентного платинового металла сильно зависит от природы аниона. Например, для системы EH «- f 2e EH * + 2X’ они находятся в кислой среде{c): сы ’4 т ки» Бр ДР + я. эо 1.29 0.99 ПТ + 1.Г 0.74 0.64
Потенциал системы E * 4-f e * t E * ^в среде соляной кислоты равен (e) j +0.90 (Ru). 0.45 (ОС), 1.20(РЗ),1.02(ИК).Из приведенных выше данных видно, что четырехвалентное состояние имеет более высокое свойство тяжелого платинового металла, чем соответствующий легкий металл. Для эффективного радиуса E4* приведены следующие значения(A): 0.65 (Ru). 0.64 (ПД). 0.67 (ОС). 0.66 (ИК). 0.60 (Пт). 146) для теплоты образования Эоа-оксидов приведены значения 72 (Ru), 62 (Os) и 66 (Ir). 41 (Pt) kcal1 моль. За счет взаимодействия элементов при нагревании образуется только сине-черный 1С3. RuOa и РУ2 (последний оксид находится под давлением кислорода 150 атмосфер).
Весь диоксид титана нерастворим не только в воде, но и в большинстве кислот. RHOA можно также получить путем длительного нагрева RHOA до 800°C под высоким давлением кислорода. Оксид рутения наиболее устойчив к разложению по схеме-2RuOa * * Ru04 + Ru4 + RuO * * RuO » +О, свыше 1300 эк. Оксид иридия начинает выделять кислород при температуре более 800°с диплатин (rf (PtO)= −1,9 а) превышает 570 * С. Известно, что черный промежуточный оксид Pt $ 700, стабильный до 04 ° С (теплота образования NC элементов 41 ккал / моль), оплачивается как красный свинец (x§ 6).Черно-коричневый OsOa получают дегидратацией гидроксида Os (OH) 4.Мелкодисперсный oemindnokend легко окисляется на воздухе до tetr9xnd.
А в атмосферах инертных газов выше 500°С они неизменны по схеме 20s0j 0s04-f Os. In соляная кислота, она растворяется с образованием OsCl4.При нагревании в атмосфере водорода Все рассматриваемые оксиды легко восстанавливаются до металлов. 147) сульфид типа 3S*.Кроме того, сходство состава селена и Теллурида известно во всех платиновых металлах (за исключением родственников, их существование может быть сомнительным). как правило, эти серые iln черные ve-
Вещество получают сухим способом (например, ПТС из элемента при 650°с).Для производящей сульфиды теплоты указаны значения 48 (Ru), 24 (Os) и 30 (Ir). 21 (Pt) ккал /моль он нерастворим в воде и большинстве кислот. Кристалл ptsj типа Cdl (ПК. Построенный согласно X111-60). В мелкодисперсном (загрязненном примесями) состоянии PtS2 осаждается действие HsS на раствор pscl. 148) четырехвалентный гидроксид платинового металла представляет собой по существу нерастворимый в воде аморфный осадок цвета ниже. РУ (о) » резус(ой), ПД (о)4-оС (о) ИК 4 (О) 4 ст(О) 4」
Черный Тенко-темный черный темный. Красный Зеленый, красный, синий, коричневый Лучше всего изучены производные палладия и платины. 149) при действии щелочи на раствор красного сложного хлорида MJPdCleJ осаждается четырехвалентный палладий-пентоксид. Сразу после осаждения он растворяется в кислоте и концентрируется NaOH. Поскольку Pd (OH) является сильным окислителем, он » медленно деградирует в нормальных условиях.
При нагревании до 200°C он полностью переходит в PdO. 150) цвет гидрата PY2NH * 0 изменяется от желтоватого (n = 4) до желтого (3) и коричневого (2) до почти черного(1). форма n = 2, то есть Pt (OH) 4,стабильна при хранении в серной кислоте, а при нагревании вода начинает теряться, когда она превышает 120°C. форма n»I, то есть HjPtO*, нерастворима в соляной кислоте. Обезвоживание при нагревании предполагает удаление не только воды, но и кислорода.
151) золотисто-желтый K?[Рt (он) е] начинает разлагаться только при температуре 160°C и выше. ХТ[Рt (он) Е] (желтоватый гель в свободном состоянии).Бледно-желтые пластинки нерастворимого в воде серебра и серебра, среди прочих солей t-Agj (Pt (OH) eJ. Один 152) методом сушки (исходное сырье спекают при 1000-1500°с) получены соли Ca, Sr и Ba. Бурение из четырехвалентных гидроксидов Ru, Rh, Ir, Pt.
Их состав соответствует формулам MEOz, MgE04,M4EO. Рентгеноструктурные исследования SrtIrO показали, что это вещество является индивидуальным соединением. Не простой сплав (IX§ 3 add.51). 153) например <для всех платиновых металлов Галогенида известен только фторид. Фторид можно получить путем нагревания элементов (только если давление фтора повышено).
Этнически твердые соединения в нормальных условиях имеют следующие цвета: RuF4 RhF4 PdF4 OsF4 IrF4 PtF4 Желтый красный красный желтый чай Они более тесно взаимодействуют с водой быстрее и в конечном итоге подвергаются полному гидролизу. Исключение составляет PdF4.It окисляет воду энергетически. 154) интересным методом является образование четырехфторированной платины при 2 ptcu + 4 HF *4Н1-fPt 4-PtF4 200-250°С по схеме. Такие процессы обусловлены отсутствием платины и трифторонов (в отличие от палладия).
Тетрафторид осмнита плавится при 230°C, что приводит к сублимации и пиролизу других тетрафторидов без предварительного плавления. Магнитные свойства определяются PtF4 (диамагнетизм), RuF4(Л* 8ff = 3.0) и RhF <(Л1, фф = 1.1). 155) например другие железы характерны для платины. Теплота образования NS элементов составляет 54 (CI), 34 (Br) и 10 (I) ккал / моль.
В коричневом PtCl4 обнаружена тетраэдрическая структура с атомами платины в центре (rf(PtCI)= 2.26 A).Оба других галогенида имеют более темный цвет. Растворение в воде、 Аква-кислота типа Hg(P1G»(OH) a).кроме того, растворимость уменьшается в серии C1-Bg-1.Если вскипятить золотисто-желтый раствор HJ{PtCl4 (OH) a]в воде, то получится Pt (OH)».
156) из оставшихся тетрагаллидов платиновых металлов наиболее стабильными являются черные OsCI»и OsBr».Оба спина получены взаимодействием элементов при температуре около 500°C (для брома-под давлением).Хлориды могут быть сублимированы в вакууме, образуя желтый раствор при взаимодействии с водой (он становится черным из-за гидролиза).Бромид нерастворим в воде и поступает в осмий при нагревании в вакууме при температуре около 350°С. четырехвалентный иодид осмия не получают.
Давление диссоциации 1Cl1 при комнатной температуре достигает 5 атмосфер, в то время как RuCl4 устойчив только ниже −30°C. 157) снижение ос04 концентрированным HCl было генерацией оксокролоно O (0sCl -) j. подобные соединения известны для рутения. 158) комплекс железа из четырехвалентного платинового металла соответствует типу Mz1EGV1.Фторид и хлорид известны в яххе, но бромид и норид известны только некоторым людям.
Цвет и магнитные свойства (M ff ff) наиболее хорошо изученной калиевой соли (в случае хлорида родия-Cs) сравниваются ниже. Хлорид жидкости Ру резус ПД 0 * Если PT ру резус ПД ОС ИК-Пт Желтый, такой же желтый, влажный красный, желтый, зеленый зеленый, красный, красный, желтый 3.0 1.7 Нижний IJSS DIAA 3.07 W DIAA 1.44 1.65 DIAA Структура Иона [EHv] * — соответствует октаэдру с атомом Е и центром. Расстояние d (3F) было определено для Rh (1.96), Pd (1.89) и Pt (1.91 A). 159) общее отношение фторида к рассматриваемой воде определяется тем, что сродство к е *он больше, чем к F〜.
Таким образом, они получаются только путем сушки (действия F на исходный материал), а при взаимодействии с водой подвергаются всему гидролизу, последний протекает более или менее медленно (с одновременным восстановлением трехвалентного или двухвалентного состояния металла) в Rh и Pd при 0$, Ir, Pt, Ru. Получены в свободном состоянии) приведены следующие значения (г / л): 205(Na), 7,5(K), 2,8(R b), 4,8(Cs), 73(NH4). 160) поскольку сродство Е *К С1-больше, чем он’, можно получить комплекс M ^ ES1 «]окислением соответствующего низшего производного в водной среде хлором.
Это наиболее трудно для родия: слаборастворимый зеленый Csj/RhCle] получают взаимодействием розового CsjJRhCUJ с четырехвалентными нитратами в насыщенной хлором азотной кислоте medium. It это очень сильный окислитель, который частично удаляет хлор, который уже находится в контакте с водой. 161) комплекс хлорида платины является наиболее важным. Хлоридно-платиновая кислота сама по себе представляет собой красновато-коричневый кристаллогидрат Na [P1SCH 6H, 0.It является сильной двухосновной кислотой, которая очень хорошо растворима не только в воде, но и в спирте и эфире.
Введение нового Ag в водный раствор HJPtCU осаждает новый AgCl, а светло-коричневого серебра-Agjptcl. Последняя ситуация наглядно показывает, насколько мала концентрация ионов SG и в растворе, то есть насколько устойчивы комплексные ионы[PtCUf. для d (PtCI) задается значение 2.32 A.
162) тем не менее, решением является схема [PtCW + H»0 * * (PtCUOHj)’ + SG. Для константы равновесия(K-(PtCUOH ^ CIT / ltcul) этой реакции было значение ideode 3-10.®Ioi (PtCl «OHs /’ — слабая одноосновная кислота (#С «3-Н> −4), Ион lPtCl» OH)».Далее, добавляя щелочь, анион С1-последовательно замещали На ОН, m ^ pt (OH).Вы можете получить промежуточные продукты MJ (PtCI») и MjIPt (OH) e], такие как Cl. 。из iah, только производная от 3 163) хлороплатина обычно желтого цвета. Растворимость в воде у некоторых из них составляет Инже(мас.% )
Сравнивается с: 0 10 20 30 40 60 80100°C ……….-это очень хорошо. 0.48 0.00 0.77 0.09 1.34 2J9 3.58 4.71 RbjPtCJ ,. 。 。 。 это хорошая вещь. 0,014 0,020 0,028 0,040 0,057 0,10 0,18 0,33 CsjPlCIe. 。 。 。 0.006 0.009 0.012 0.016 0L29 0.052 0.001 (NH4hPtCI | …* 0.29 0L7 0.50 0.63 0.81 1.42 2.12 3.26 Из-за своей низкой растворимости, соли рубидия и соли сезона подобны хлорауатам(кассок XIII-34).Сила сцепления постоянная Pt-C! С увеличением радиуса катиона (т. е. с уменьшением энергии кристаллической решетки), с хлорированной платиной щелочного металла он линейно уменьшается от 1,83 до 1,75.
164) Красный Hj (PtBre) — 9HaO и черный Hj {PtM-9HjO сходен по свойствам с хлорогеном acid. In в растворе, который одновременно содержит SG и G, равновесие устанавливается по общей схеме: [PtCM * + 61 ′* * iPtle] » + 6CG [HjJPtCle]при добавлении в раствор конкреции это равновесие перемешивается вправо, и цвет жидкости изменяется от желтого до темно-красного или почти бесцветного до розового при очень низкой концентрации. Реакция очень чувствительная, и поэтому открытие платины.
165) среди производных других платиновых металлов наиболее важным является малорастворимый в воде (1: 100) ультра-черный (NH4) карбонат. При температуре более 200°C oi разлагается на металлы, и Ч / Б может быть использован для получения чистого иридия. Его необычный координационный номер 8 интересен для красного этиленового комплекса Ki (lrCle (CtH4), J-3HjP. Интересна также диамагнитная бурая соль состава Kj (Ru (OH) CU).Рентгеноструктурные исследования показали, что dnmeria и d (RuRu) — параметры модели (XII§ 2 ext.) принят в уточнении параметра 3.60 А. Согласно 30), кристаллы состоят из [CURuORuCfs) 4 — [ионов rf (RuCl) 2.34 A], ионов калия и молекул воды.
Линейный, ad (RuO)= = 1.80 Å очень мал, и природа связи рутения и кислорода остается неизвестной. Отметим, что положение атома кислорода не является прямолинейным, не исключены модели с 2 сшитыми Индо-гидроксильными группами между атомами рутения. Это также относится к комплексу рения[rf (ReRe) » 3,72 AJ с аналогичным составом. 166) описаны также продукты присоединения других Галогенидных молекул, PtF4-2SeF4, 2PlF4SeF4, 2RhF4-SeF4, PtF4-2BrF$. PtCl4-2PCI. IrCI4-2PClj.
Это включает в себя темно-синий IrF4-2SO.」 167) нитрозогалиды платиновых металлов, особенно четырехвалентных. Бактерии рутения. Красный Ru (NO) Clj-5HjO легко растворяется в воде, черный бромид хуже, а черный йодид растворяется незначительно. Под действием раствора Ru (NO) Cl|щелочи осаждается коричневый Ru (NO) (OH) j, растворимый как в избытке щелочи, так и в разбавленной кислоте. Для рутения и осмия также известен Нитрогалогенид типа 3 (NO) CI l l.Где L-нейтральный лиганд. 168) диамагнитных комплексов типа Mj {Ru (NO) re], розовый (черный в крупных кристаллах) Kj (Ru (NO) Cls]изучен лучше других.
Эта соль очень хорошо растворима в воде (25 г / л при 120°С), кроме того, красный раствор очень стабилен. То же самое относится и к red Kj(Os (no) Cls). (Выполнения) −1.80 а ZRuNO-171е, РФ (нет) — = 1.09 в, Колорадо (нет)=-1919 ″ ЦТК «по данным других источников, является<д(нет)» = 1614 ЗАС, и связь между ру и не осуществляется через атом кислорода. В диамагнитных кДж (Пт (нет) cl5 имеют), состав которой похож на jeremiom, Колорадо (нет)«17 1711 ы * г ’был найден. 2-й диамагнитный Pd (NO) jClj имел тетраэдрическую структуру с атомом Pd вблизи его центра, и аналогичная длина хлорида железа наблюдалась для платины.
169) сложный цианид является наиболее характерным для платины. В дополнение к длинным тетракноидам типа M * [Pt (CN) «G»} (G-CI, Br, I) получены индивидуальные представители пентацианида M£[P1 (CI)$ G]и гексациида. Желтоватый KJPt (CN) d Он очень стабилен(только prn 395°С начинает разлагаться) и очень растворим в воде(80 г / л prn 20 ° С).Для константы силы объединения не- [Pt (CN)$ p » даны значения(PtC)= 2.9 и k(CN)-17.5.
Также получается бесцветный Hj {Pt(CN)»]-2HaO. K (Pd (CN)) el (удельное сопротивление до 160°С), который является сильной двухосновной кислотой в воде, синтезирован для использования в палладии, А K * [3 (NO) (CN) NIT известен для рутения, осмия и платины. sb 170) взрывчатый сложный тип МДж (Пт (Н3) Джей Джей он известен своей платину.
Кармин Красный комплекс роданида Ks (Pt (SCN) e] −2H} 0 легко растворяется в воде. {Пт (СКС) е).Образование сложных родандов в растворе также наблюдалось в Osxv, и они не были разделены. 171) соединение нитрита Ka {Pt (NOj) el, которое является светло-желтым (зеленым, согласно другим источникам), получают взаимодействием KalPt (NOih) с жидкостью NNO. It является диамагнитным, хорошо растворимым в воде, и при нормальных условиях не вступает в реакцию с восстановителями. Известны все промежуточные формы между ним и K2 {PtCI«]. KJ {кроме PtCI (NOJ) 6l.
смешанный нитритный комплекс рутения-NaiRu (NOa) ((no) (OH)] — в случае 2HtO, содержащего группу NO-OH в транс-положении друг к другу, задается следующий параметр: d (Ru-NO?))= 2 2 08,<Ф(ру-нет)1.75, РФ (ру-ах)= 1.95,<Ф(НР) = 1.13 (никакая) НЛ 1.21 а (нет), ZONO −119°. 172) [при взаимодействии Pd (NOj) a и N, 0&] из nnsratone четырехвалентного платинового металла получают только коричневый диамагнитный Pd(N03) 4.Его желтый водный раствор не окисляет Fe, но он окисляет 1 ′ количественно. 173) наиболее широко представлены наиболее характерные интрозоитриаты лютеии. Темно-красный Ru (NO) (N03) 3-4HjO получали восстановлением азотнокислого раствора Ru04 оксидом азота.
При температуре 50°C, в вакууме, oi переходит в (Ru (NO) (no)) j (OH.).J разлагается при 150°C до Ru02.Темно-красный K [Ru (NO) (NO.) также известен. «Охе» н Браун[(с бортовым номером 03) J (никакие) RuORu(не)(с бортовым номером 03)ЭйДжей. Смешанные диамагнитные комплексы типа KJ3 (NO) (N0a) 4N03 известны для Pt (желтый) и Pd (красный). (Но не чистый в чистом виде) и черный (Pd (NOh (NOj) j]). 174) для осмия характерны сложные сульфиты. Бесцветная на40 (S0j») Е)Н К * и HJ {ОС (так») эль, а некоторые смешивают соль, например бесцветный Мп | ОС (найти) sOHj], где М-Na, К, фиолетовый нае [0С( С03)4(0н) В]и желтый Na40s(системы s0s) 4Cli].
Для платины известен очень нестабильный коричневый золь типа M |(Pt (SOi) a (OH)}]. 175) из комплексных оксалатов платины известна желтая соль M2 {Pt (Ci04) aCl2], которая легко растворима в воде. Где M-Na, K. n red Ka(Ryu (SK) 4) a] — 2NaO. Для nrnnya очень нестабилен красный [CsJIrfC ^ 1CU], но для рутения мы получили черный аморфный Ka | Ru (Cj04)«]. Четыре 176) комплексы четвертичного аммония известны для многих структурных типов: [Ст(НСЗ) Эльче [видеорегистратор PTX (НГ.) sJX3 [видеорегистратор PTX.), (NН3) 4) Х2 fPtX3 (НГ.) 2] х [видеорегистратор PTX (NН3) а] м [видеорегистратор PTX, (НГ.)], где X и M-одновалентный номера-катиона.
Вся серия представлена менее чем 1 желтым водорастворимым хлоридом. Производные других анионов получены не для всех его членов. Был также описан зеленый диамагнетизм [PtCI(no) (NH3) 4) CIj. Бесцветный и слабо растворимый в воде[Pt (NH3) α) (OH) 4 является сильным base. In октаэдрический Катон rf (PtN) 2.01 A, константа диссоциации non (Pt (NH3) e] SO составляет 310 «4, то есть SOJ» очень прочно связан с катионом соединения.
Интересна желтая соль катионных[Pt (NH.) 4NHaCl] 3 ^и[PT (NH3) 4NH3AG} 4, а также общий состав pt2 (NH3) ECL7NH2, который четко соответствует структуре [NH3) 4clptnhptci (NH3) 4LCLCL5.Некоторые этилен-аминопиридина комплексов того же структурного типа, например, бесцветный[PtEn3) Cl4 N желтый[PtCl4Pya]известно. 177) некоторые аммиачные комплексы также характерны для четырехвалентного Рутений. Гексамин не был получен, но некоторые соли диамагнитного катиона пентамина (Ru (no) (NH3) 5p \известны, и приведены следующие параметры: d (Ru — NO) » 1.80 A. ^ RuNO-167°, d(NO) −1.11
A,<o (NO)-1922 cmKg этот оранжевый катион в кислой среде очень стабилен, поэтому даже при комнатной температуре концентрированная серная кислота не может его разрушить. Щелочь представляет собой желтый катион (Ru (NO) (OH) (NH3) 4] A \золь различных анионов, а также замещенный продукт гидроксильных групп, например оранжевый красный[R u(NO) Cl (NH3) 4] Cla и оранжевый (Ru (no) OHj (3) 4) CI3.Последнее соединение обладает свойством слабой кислоты. 178) из аминных комплексов других четырехвалентных платиновых металлов лишь небольшое число составляют known.
An примером является[PdClt (NH3) 4] Cls, почти нерастворимый фиолетовый [IrCl4PyJ], который является желтым и слабо растворим в воде. Окислительные свойства последнего аналогичны свободному Брому (в частности, он окисляет NH4OH до Ns).Осмий Ethnlandnamn комплексы интересны-розовый[ОС (Ан -) 2En] Br2 и зеленый[осень «(англ.).] Br3l ванной—в NH, СН, СН, NН -. 179) пятивалентный платиновый металл в основном представлен фторидами. Из простого фторида 3F5 известно следующее. Руффье РГНФ » ОСФ » ИСБР ПТФ» Цвет………Зеленый, красный, синий, желтый, красный Температура плавления. ……. 87 96 70 105 80 RuFj изучен лучше других элементов, теплота образования элемента составляет 213 ккал / моль, а парамагнетизм определяется величиной M » φ= 3.5.Кристаллы этого вещества состоят из тетрамеров, структура которых показана в РНС. XIV-53.
Причина различий между ядерными расстояниями FRu (l) и FRu (2), а также отдельными углами Руфру (127°и 137°) в полностью идентичных частях общей структуры не ясна. Это происходит потому, что общий состав кристаллов, то есть когда отдельные тетрамеры упакованы вместе в кристаллическую решетку, отдельные тетрамеры влияют друг на друга. Однако можно рассмотреть и другую причину-неточность выбранной модели (add. Увидеть, 165). Не все рассматриваемые пентафтороны являются очень стабильными, они очень летучие и являются мощными окислителями.
Это свойство относительно менее заметно на OsF»(Л4 ″ фф = 2.1) и наиболее выражено на ptf5 (который окисляет brf3). 180) из 5ВАЛЕНТНОГО оксофторида платинового металла описан бледно-коричневый PtOF, полученный фторированием PY2 при 200°C. It является нелетучим и медленно разлагается во влажном воздухе. 181) комплексный фтор известен во всех пятивалентных платиновых металлах, кроме палладия. Простейшим из них является солнечно-щелочной металл типа M {3Fe].Самая слабая-только красно-коричневая соль цезия-является родной. Производные Pt имеют желтый цвет, а остальные платиновые металлы бесцветны. Они характеризуются значением M9ff. Это соответствует среднему 3.7 (ру), 3.2 (ОС), 1.2 (1г) и 0.9 (Пт).
Их разложение водой протекает наиболее медленно в случае осмотического давления. Для восьмигранного OsFJ, я нашел</(OsF) −1.82 A. 182) оранжевый CIFjPtFj (Мп.170°C) и » — PtF $(mp.140°C), вероятно, имеет аналогичную структуру m [3Fi].Оба являются парамагнитными и быстро разлагаются водой. SF4-IrF5 (mp 125°C) n BrF3 RuF также известен. 183) XeFj и 3F $фторид (е-Пт, ру ОС 1д) соединений известны 3 формулировки 2XeFj-3Ф», XeFj-3Ф»и Xefj-23Ф «(за исключением ОС).
Это кристаллические вещества, около 50〜 Рисунок X1V-53. схема построения ируф)) 4. Аналогичные соединения не были получены для 1b0°C XeF4, и кристаллы XeF—PtFe были построены из IXeFj ^ PtFJ-ионов. Ионы [XeFg] +имеют четырехугольную пирамидальную структуру со средним d(XeF) 1,85 А. атом ксенона находится на 0,34 а ниже базовой плоскости и связан с 2 ближайшими атомами фтора октаэдра и со слабыми связями (2,52 и 2,65 а) [PtF]-и его d(PtF) 1,89 А. Также известны соединения XeFe и IrFs, которые близки по составу.
184) почти никаких других пятивалентных производных платинового металла не сообщалось. Под давлением (320 г) при медленном нагревании Ru2 (CO) t, содержащего N0 до 190°С, образуются красные кристаллы Ru (NO). Используя смесь хлора и воздуха при 700°с, мелкодисперсный осмий обрабатывали в течение длительного времени с получением очень гигроскопичного оксокролида 0 (0sCl4). при осмотическом давлении черный парамагнитный (MΦ= 1,7) этилэдиаминовый комплекс[Os (En -) tEn) l | — 3HiO(add.
It также известен (см. 178), а в иридии известен коричневый диамагнитный K [Ir (NO) Br5).Солубле в воде и много органического solvents. As для родия был получен RhtSs, а также целиды и теллуриды аналогичного состава. 186) для шестивалентных платиновых металлов наиболее распространенной формой существования является фторид. ОРФ, RhFt Сайту Osfe МАФ#ПТФ » Цвет………Коричневый красный желтый черный Температура плавления. С……. 54 70 33 44 61 Они очень изменчивы[т. завеса. 47 (Os), 54(Ir), 69°C (Pt)] и нестабильные вещества могут быть получены взаимодействием элементов.
Например, синтез PtF (и красного пара) проводили при 1000 * 0 с быстрым охлаждением продуктов реакции до температуры жидкого азота. Самые нестабильные RhF. In в соответствии со схемой 2RhF-2RhF $ — f F, он естественным образом разлагается даже при комнатной температуре. Подобный распад других гексафторидов происходит только тогда, когда они медленнее или нагреваются.
186) молекулы 3F имеют октаэдрическую структуру с атомом платинового металла в центре. Все рассмотренные фториды являются очень сильными окислителями (в частности, они окисляют воду).Например, при 60°С nnndehexfluoride восстанавливается свободным хлором(по схеме: IrFt-F-C1 «IrF4-f 2CIF»), а PtF легко окисляет BrF3 до BrF8. Электронное сродство гексафторида Os, Ir и Pt оценивается в 120, 140 и 160 ккал / моль соответственно. Наверное, в Орф он почти такой же, но в РФБ он несколько выше.
Производные ксенона, подобные платине, известны в обонятельном смысле этих фторидов (add 189). 187)ОСФ сделал некоторые лучше, чем другие исследования.«rf(OsF) -» 〜 = 1.83 A, k (OsF) −4.9, I, fp-1.50 и тройные точки (33.4°C и 475 мм рт. ст.) известны. Этот фторид дает уточненный и яркий пример экспериментальных данных. В 1913 году появились 2 летучих фторированных осмиума под названием OSF Alpha и OsF®obtained. It считалось так в 1958 году, и оказалось, что на самом деле оно соответствует формулам OsF $и OsF*.В течение 45 лет, освещенных в научной литературе, Осфе фактически не существовало.
Подобные случаи «замыкания» вышеупомянутых соединений не так уж редки(например, XI§ 4 add. В частности, сомнительно наличие бесцветного кристаллического Кируфа *. 188) из продуктов взаимодействия 3F с различными веществами наиболее интересными являются производные молекулярного кислорода и ксенона. Ojptfe] красные кристаллы » могут быть получены прямым взаимодействием сухого O *и PtF в нормальных условиях.
Кислород в этом случае окисляется. То есть, кислород играет необычную роль в качестве восстановителя. В вакууме выше 90°с эти кристаллы сублимируются и плавятся в герметичной трубке при 219°С. Для структурных параметров молекулы значения rf (PtF) составляют 1,74 а(по другим данным-1,82 а) и d(00)= I, 13А. это вещество является парамагнитным (MF-2,57), бурно реагирует с водой и является одним из 1 самых мощных известных окислителей. 189) потенциал ионизации Oj (12.2 В) и Xe (12.1
Было высказано предположение, что ксенон может также реагировать с PtF. Эксперименты, поставленные для проверки этого предположения, привели к образованию твердого оранжевого Xe [PtF], который может быть сублимирован в вакууме и разложен водяным паром по схеме: 2Xe {PtF»] + 6H » 0-2Xe + 12HF + 2PY * + O. это интегрирование(Bartlett.1962) пробил первый пробел в установившемся представлении о незыблемости внешних электронных октетов атома и заложил основу для развития Химина в инертном газе (VII§ 1, 12).
Немного позже было обнаружено, что желтый Xe [PtFe] a также присутствует, и обычно образуется смесь обоих веществ и их относительное содержание, в зависимости от условий эксперимента. 190) из оксофторида был получен только бесцветный RuOF4 (mp 115°C).Коричневый 0 / 0sc (mp 32°C) также known. It растворим в органических растворителях, а под действием воды N-константа гидролизуется до 0s04 и OsOj. 191) электролиз раствора Pt (OH) 4 в кон с сильно охлажденным анодом приводит к выделению осадка состава 3 ptto | * KiO.
При тщательной обработке разбавленной уксусной кислотой была получена красновато-коричневая триоксидная платина (РУ>).Этот оксид очень нестабилен, и уже при комнатной температуре он медленно отделяет 1 атом кислорода. Одновременно с одновременным образованием Hj он высвобождает хлор из разбавленной соляной кислоты (PtCUj. Для других платиновых металлов туриноксиды не получают, но они присутствуют в потоке кислорода. ОС, летучесть ИК составляет 800-1500°С, что, очевидно, связано с ее образованием (Rh и Pt летают в виде Эоа.) Для иридия, сульфида Ir3j, Селена описан состав терурина. 192) кристаллический и проникающий.
И калий рутениевой кислоты, вода удаляется только при температуре около 200 ° С (в атмосфере нейтральных газов).Оба Золя легко растворяются в воде. Их решение, по-видимому, включает различные аноны-RuO «и (Oso J (OH) 4] ’r. 193) oso4 и OsOj образуются одновременно за счет подкисления осмотического solution. In в этом отношении осмата похожа на manganese.
In кроме солей Осминовой кислоты известно много органических производных(в основном сложных эфиров).Они создаются не только из обычной формы H30s04.Также из более гидратированных-H4OsOs и N OzO. 194) Рентгеноструктурное исследование осмиевой кислоты калия показало, что ее следует назначать в виде K * 10z02(0H) 4).Октаэдрический анион этой соли образован квадратом гидроксильной группы [</(OsO) = 2.03 A) и линейной осмильной группы 0 0 0s = 0 [d (OsO) −1.77 A].Последняя также включает производную типа Mj [0s02X4]. она может быть представлена красным KatOsOjCI4] — 2HjO (d (OsO)= 1.75).Д (ОБСЕ)= 2.38 А].МН[ОСО, ХД]является неустойчивым.
Например, желтый (NH4) i (OsOsC1j1.Вода и обе соли гидролизуются для осаждения черного осота (OH).j. производная черного типа Mj[RuO, CI4f, M — Cs. Rb. Также известный как рутений. Ru0 (S04) j. 195) для шестивалентного осмия очень характерны некоторые производные азота. Простейшие композиции из них-зеленовато-пиридинового комплекса ОСО » Py2.Типичным для типа [osuj (NHj) 4 | Xi катонным комплексом является желтый IOsOj (NH.) 4] CIj, слабо растворимый в water. In кроме того, композиция этилен-аминопроизводных[Os (En -) 4} Ir3HaO (add.
По сравнению с 184) также описывается. Анионный комплекс характеризуется типом Mj (OsNCU).Где М-это к. Rb. Cs. It это NH4. 196) красный диамагнитный K ^ OsNCU исследовали методом рентгеновской дифракции. Согласно 4 исследованиям, проведенным почти одновременно на 8-факторизованном Аноне тетраэдрического хлора d (OsCl), на расстоянии по оси N = Os-C1 значения сильно расходятся. d (OsN) » = 1.73 или 1.61 A и d (OCI) −2.50 или 2.61 A. Этот случай служит хорошим примером возможной двусмысленности в определении структуры(XII§ 2 add.25).
197) при анодировании соединений родия в хлорсодержащей среде получается фиолетовая жидкость, по-видимому, содержащая H2Rh04.Соответствует этой кислоте Голубая калиевая соль, вероятно, образуется при окислении хлора сильным раствором Koh Rh (0H), но затем растворяется. 198) производные платинового металла, соответствующие семи валентным состояниям, известны только о рутении и осмии.
Если хлор осторожно поместить в красный раствор KiRu04, то последний станет зеленым из-за образования калий-KRu04-лерутениевой кислоты. Когда раствор нагревается во время реакции, из него выделяются черные кристаллы плохо растворимого KRu04. solution. In этот солнечный тетраэдрический анион, rf (RuO)= = 1.79 A. нагрев KRu04 над 200 ° С приводит к переходу к K2Ru04. Такой же результат может быть получен при обработке KRu04 щелочным раствором solution. In напротив, при подкислении раствора KiRu04 последние разлагаются с образованием Ru02 и KRu04.
Следовательно, рутений и перрукит находятся в таких же отношениях, как марганец и Пермь. Для перехода потенциальных Руо,+ е Руо присваивается значение-Ф −0.59 дюймов. 199) OsF7 получали быстрым охлаждением жидких продуктов взаимодействия осмия и фтора (300-400°с, 500-600 ° с) с жидким воздухом. Его молекулы имеют структуру пей Гойя Руби прамунда. Это бледно-желтое вещество разлагается OsF4, и фтор уже выше −100°С. 200) парамагнитный OsOF $(Af » φ= 1.47), полученный фторированием Oso J, более стабилен.
Летучее зеленое вещество (Мп 59, Мп.101°C), оно стабилизирован в сухом воздухе и может быть разложен в воде. Описаны также вещества, полученные спеканием K20s04 со специфическими пероксидами металлов, которые соответствуют солям анионов (fOsO4) и 10oso $ P〜в составе, и их индивидуальные свойства неопределенны(см. IX§ 3 additional 51). Приведены следующие значения © для окислительного потенциала валентности рутения (201) и осмия (8):+1.00(Ru * e + e * * Ru * 7),+ 1.4(Ru * «+4е * * Ru44),+ 0.96(Os * * + 4e Os * 4),+ 0.85(Os * e + 8e * * Os). Теплота образования RuO <(mp 25°C) и 0s04 (mp 41°C) составляет 57 и 93 ккал / моль соответственно.
Молекулы обоих четырех оксидов представляют собой тетраэдры с атомом платинового металла в центре. Для диамагнетизма 0s04, d(OsO)= 1.74 A и k (OsO)= 8.0 известны. Для Ru04 дано k =■6.7.Критическая температура тетродотоксина осмия составляет 405°С, а критическое давление-170 атмосфер. Обратите внимание, что в нормальных условиях нестабильные Ru04 и 0s04 могут быть стабилизированы при высоких температурах (около 1000°C).
Потенциал ионизации обеих молекул составляет 12,3 и 13,0 вольт соответственно. 202) как Летучий тетраоксид, так и вода vapor. In в водных растворах он ведет себя как очень слабый амфотерный электролит, в котором преобладают кислотные свойства. Для константы кислотной диссоциации приведены значения/ Ci = 7-10 — „(Ru) или K \ „1-10““, Kt = 3-10 * ’*(Os), а диссоциация основных типов в случае рутения оценивается Ci / Ci = 6-10-15 values. It следует отметить, что истинное значение константы диссоциации гидратного типа тетрады должно быть выше, так как равновесие 0404 + lH * 0 * * =»*Э04-lH20 очень сильно смещено влево(ср. Х§я дополнительные 47).
Водный раствор Ru04 (растворимость 20 г / л) разлагается вполне quickly. In по сравнению с водой интересна заметно высокая растворимость RuO <и 0s04 в органических жидкостях. При 25°C 100 г CC14 растворяется в 375g Os04, но при тех же условиях 100 г воды составляет всего 7 г. коэффициент распределения Ru04 между CC14 и водой (VII§ 4, 13) равен 58. 203) при использовании соляной кислоты Ru04 восстанавливается до RuCl9, и нестабильные RuOjCl » и RuCl4 образуются сначала в концентрированной кислоте. Разбавленная соляная кислота не работает на 0с04, но сконцентрированная соляная кислота преобразовывает тетроксид осмия к OsCl4.
To разделите оба элемента, важно, чтобы соотношения азота и азотной кислоты были разными. Под его действием Ru04 переходит в нелетучие продукты, а 0s04 не изменяется и может быть дистиллирован off. In слегка подкисленный раствор йодида калия 0s04 дает темно-зеленый цвет, но это может быть связано с образованием H (OsljOH2]или H ^ OsUOH]. — Кристаллический продукт присоединения типа Mj(0s04(0Hh).
Тетроксид рутения под действием щелочи отсекает кислород, сначала перемещается в KRuO, затем в KiRu04. 204)Osmiitetroxnd используется в органическом hnmnn в качестве окислителя и в качестве катализатора для окисления других веществ(например, ОСО в незначительном количестве в слегка кислой среде «резко возрастает окислительная активность KC10»).Он также применяется для изготовления микроскопических образцов различных тканей животных (на основании того, что волокна, содержащиеся в ткани, восстановить 0-04 н и окрашивают в черный цвет с двуокиси осмия).
205) взаимодействие между тетрокснд и аммиаком prn −25°С привело к образованию крайне нестабильного (уже более-20°decomposition разложения) продукта добавления 30 ″ NH. Известен гораздо более стабильный Ru04-2Py. 20c) при одновременном воздействии на ОСО *концентрированного раствора NH Koh образуется калиевый золь осмиаминовой кислоты по следующему уравнению:0s04-f 4-NHj + KOH K(NOsOj1 4-2H, 0. (Добавлено к IX§ I. 47).Желтые кристаллы, слабо растворимые в воде. Другие соли того же Анона также известны много, и статистическое среднее d (OsO)= «= d (OsN)= 1 75 A.
Для константы прочности соединения значения k(OsO) » ■ = 6,8 и k(OsN)= = 8,0.Обработка оснамата калия x-концентрированным HCl включает в себя появление хлора и образование K * {OsNCl$] (add 196). Из 207) ОКСОФТОРИДА был получен только оранжевый OsOjF (температура плавления 172°C).Это сложный солнечный M(0s03FJ, M-Ag, Cs, K и M?(0s04F.], M соответствует Cs, Rb).Интересно, что газообразный фтор OsOjF играет роль восстановителя, то есть фтора в данном случае, но это очень необычно для него, а для осмия, для лютеина известен высокогигроскопичный продукт присоединения сажи, типа 2304PFS и 304 J. (Ру) нлн 70°с (ОС).
208) физиологические эффекты соединений платинового металла не изучены. при использовании nnmn имеются признаки отдельных случаев аллергии и поражения кожи (дерматит, экзема).Платиновое Солнце иногда вызывает респираторные инфекции («платиновая астма»).Высоколетучая Тетра-о-Муния (pr 25°С давление пара и ММ Hg.
It очень токсичен и особенно опасен для глаз. 209) каталитическая активность металла велика, поэтому чем прочнее его поверхность, тем больше он старается максимально увеличить ее при приготовлении катализатора. Для этой цели металлы часто осаждаются в некоторых посторонних пористых материалах, таких как asbestos. In в частности, асбест на основе платины получают пропиткой разбавленного (1-2%) раствора HJPtCUJ асбестом и последующим обжигом (вызывающим разложение по формуле H ^ PtCU)= =2НС1 + 2С1 * + PT).
Но металлические катализаторы часто получают без индифферентных оснований. Требуемая степень измельчения металла достигается при этом применением различных способов его разделения. Например, губчатую платину получают слабым прокаливанием (NH4h [PtCI|].
Раствор-Ha (PtCU), содержащий мелкодисперсный металлический платиновый черный металл(H»(PtCle)+ 32p-32pC1″ + Ng-f Pt), тот же раствор восстанавливают хлоридом олова (H ^ PtCU] + 2SnCla = 2SnCI4 + 2НС1-FPT) до дальнейшего фрагментированного коллоида в платине. 210) наиболее устойчивая сила в нормальных условиях платинового металла зависит от природы связанных с ним элементов. Например, наиболее распространенной формулой для лютения, быков и хлоридов является RuF ^ RuO, RuClj. Однако, учитывая, что соединения кислорода являются наиболее важными с точки зрения химических линий, мы можем в целом предположить, что рутений является наиболее типичным квадратичным состоянием.
Смотрите также:
| Поляризация ионов | Комплексные соединения |
| Семейство железа | Периодический закон как основа химической систематики |
