Поляризация
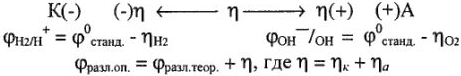
Перенапряжение (л) зависит от материала катода и его состояния.
В 1905 году Тафелем установлена зависимость перенапряжения от плотности тока при достаточно больших плотностях тока (до 10 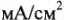 ):
):
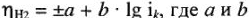 — коэффициенты; знак (+) перед а относят к анодному перенапряжению, а знак (-) — к катодному.
— коэффициенты; знак (+) перед а относят к анодному перенапряжению, а знак (-) — к катодному.
К уравнению Тафеля в настоящее время добавляют адсорбационные факторы 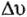 (Капустинский и Вяселова):
(Капустинский и Вяселова):
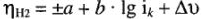
Значение а зависит от природы металла электрода, от состояния его поверхности, состава раствора и температуры. Значение а в 1 н кислоты 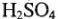 при 20 °C: для РЬ = 1,56; Hg = 1,41; Cd = 1,40; Zn= 1,24; коэффициент b постоянен для всех металлов (для поликристаллических структур) и равен, по данным Л.И. Антропова, 0,12 В. Для электродов монокристаллической структуры, для каждой ее грани металла она разная, но не выше указанного значения.
при 20 °C: для РЬ = 1,56; Hg = 1,41; Cd = 1,40; Zn= 1,24; коэффициент b постоянен для всех металлов (для поликристаллических структур) и равен, по данным Л.И. Антропова, 0,12 В. Для электродов монокристаллической структуры, для каждой ее грани металла она разная, но не выше указанного значения.
На перенапряжение влияет добавка ПАВ, с ростом температуры перенапряжение падает.
Перенапряжение возникает из двух процессов:
1) реакция разряда иона водорода и переход его атомов в адсорбационное состояние:
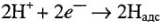 — электрохимическая реакция.
— электрохимическая реакция.
2) соединение атомов в молекулы:
2НадС —> Н2Т — химическая реакция.
Ионы водорода, приближаясь к поверхности электрода, отталкиваются друг от друга как частицы, имеющие заряды одного знака. Это препятствует одновременному разряду двух таких ионов в непосредственной близости на поверхности электрода. Поэтому на первой стадии процесса разряда образуются нейтральные атомы водорода, а не молекулы.
Эксперимент подтверждает, что и замедленный разряд, и замедленное соединение (десорбация) водорода могут оказаться причинами перенапряжения.
Если металлы 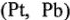 хорошо адсорбируют водород, то скорость разряда у них велика, а скорость соединения атомов мала, и лимитирующей стадией является образование молекулы водорода у атомов. И наоборот, если металл плохо адсорбирует водород
хорошо адсорбируют водород, то скорость разряда у них велика, а скорость соединения атомов мала, и лимитирующей стадией является образование молекулы водорода у атомов. И наоборот, если металл плохо адсорбирует водород 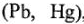 , то скорость образования молекул у них велика, и перенапряжение определяется стадией разряда. В общем случае перенапряжение нежелательно. В отдельных случаях перенапряжение способствует правильному течению процесса (для восстановления
, то скорость образования молекул у них велика, и перенапряжение определяется стадией разряда. В общем случае перенапряжение нежелательно. В отдельных случаях перенапряжение способствует правильному течению процесса (для восстановления 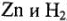 ).
).
Эта теория взята со страницы подробного решения задач по всем темам химии:
Возможно эти страницы вам помогут:
| Электролиз водных растворов в химии |
| Кинетика электродных реакций в химии |
| Законы электролиза (фарадея) в химии |
| Выход по току в химии |
