Оглавление:



Практическое применение методов ионообменной хроматографии
- Практическое использование Ионообменная хроматография в основном используется для ионного разделения. Количественная оценка компонентов после разделения может быть выполнена соответствующим образом. Простейшая методика ионообменного разделения состоит в поглощении компонентов смеси ионообменником, а затем элюировании каждого компонента подходящим растворителем.
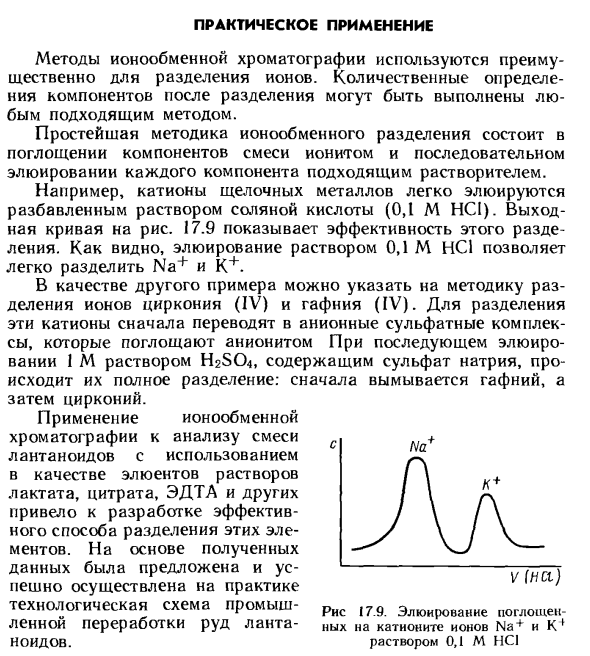
- Например, катионы щелочных металлов легко элюируются разбавленным раствором соляной кислоты (0,1 М HCl). Выходная кривая 17,9 на рисунке показывает эффективность этого разделения. Как видите, Na + и K + можно легко разделить, элюируя 0,1 М раствором HCl. В качестве другого примера мы покажем, как разделить ионы циркония (IV) и гафния (IV).
Для разделения эти катионы сначала превращаются в анион-сульфатный комплекс и поглощаются анионообменной смолой. Людмила Фирмаль
При элюировании раствором сульфата натрия IM, содержащим H2SO4, достигается полное разделение. Использование ионообменной хроматографии для анализа смесей лантаноидов с использованием молочной кислоты, цитрата, ЭДТА и т. Д. В качестве элюента позволило разработать эффективный метод разделения этих элементов.
На основании полученных данных была предложена и успешно реализована техническая схема промышленной переработки лантаноидных руд. Рис. 17.9 Элюирование ионов Na + и Kf, абсорбированных катионообменной смолой, 0,1 М раствором HCl Технология ионного обмена также известна разделением изотопов. Например, 4N и 5N могут быть разделены на сульфозоле в форме NH 2.
Метод ионного обмена используется для определения общего содержания катионов или анионов в растворе и для анализа чистого солевого раствора. Прохождение Hf-формы катионообменной смолы в растворе, например, натриевой соли, в результате процесса ионного обмена HR + Na + = NaR + H + Такое же количество ионов H + появляется в растворе.
Концентрация ионов H + в этом растворе может быть определена, например, титрованием, поэтому можно найти концентрацию Na + в исходном растворе. Процесс опреснения воды на основе ионного обмена имеет большое практическое значение. Суть в следующем. Солевой раствор или вода для опреснения воды обрабатываются одновременно с помощью катионита в форме Н + и анионита ОН ~ -.
Результаты HR + M + = MR + H + и OH к ионному обмену на анионообменной смоле: ROH + X «= RX + OH- Однако Н + и ОН в растворе взаимодействуют с Н + + 0Н ~ = Н20 и сдвигают ионообменное равновесие до полного удаления ионов из раствора и получения чистой деминерализованной воды. Процесс ионного обмена также используется для перевода плохо растворимых соединений в раствор.
- Для этого суспензия труднорастворимой соли MX должна быть обработана HR-ионитом до достижения равновесия. MX + HR = MR + H + + X- Удалить M f с помощью ионообменной смолы, содержащей подходящий растворитель. Способность растворяться четко определяется сродством M к R и растворимостью MX. В настоящее время известен способ растворения с использованием ионного обмена осадков, таких как BaSO4 и AgCl.
Специально для электрохимических целей изготавливаются так называемые ионообменные мембраны. Поскольку они получены в форме листов ионообменной смолы, они имеют как характеристики ионообменника, способного к ионному обмену, так и характеристики мембраны как полупроницаемой перегородки.
Электрохимические аспекты использования ионообменных смол интенсивно развиваются. Людмила Фирмаль
Однако ионная проницаемость Избирательные мембраны — катионообменные мембраны пропускают только катионы, в то время как анионообменные мембраны пропускают анионы. Это открывает возможность их практического применения.
Например, ионообменную мембрану можно использовать для приготовления чистого раствора NaOH и H2SO4 путем электролиза раствора Na2SO4 в ячейке, разделенной двумя ионообменными мембранами (рис. 17.10). Катодное пространство отделено от раствора Na2S04 катионами МР. МР катионы пропускают ионы Na4, но SO? ~ T улавливает ионы.
Вода восстанавливается при электролизе водного раствора в катодном пространстве: 2H20 + 2- = H2 + 20H- В анодном пространстве происходит окисление воды. H20 = 7202 + 2H ++ 2- Таким образом, чистый NaOH образуется в катодном пространстве, чистый H2SO4 образуется в анодном пространстве, и, наконец, деминерализованная вода остается в центральном отсеке. В принципе, такие устройства можно использовать для очистки или опреснения морской воды.
Рассмотренные способы использования ионообменных смол, конечно, не исчерпывают всех типов, но показывают широкий спектр возможностей для открытия использования ионообменников в аналитической химии и технологии. Мистер RA 4 Na2SO4, f Na + SO, Ох Рисунок 17.10. Электролиз раствора Na2S04 в кювете. Ионообменная мембрана
Смотрите также:
Решение задач по аналитической химии
| Типы ионообменных смол | Ионная хроматография |
| Ионообменное равновесие | Общая характеристика метода хроматография |
