Оглавление:




Практическое применение
- Практическое использование Гравиметрический анализ является одним из наиболее универсальных методов. Используется для идентификации почти всех элементов. Большинство гравиметрических методов используют прямое определение, когда интересные компоненты извлекаются из анализируемой смеси и взвешиваются как отдельные соединения.
- Некоторые элементы периодической системы (такие как соединения щелочных металлов) часто анализируются косвенным образом. В этом случае два конкретных компонента сначала разделяются, преобразуются в гравиметрическую форму и взвешиваются. Затем переместите одно или оба компонента в другой формат взвешивания и снова взвесьте. Определение воды.
Содержание каждого компонента определяется простым расчетом. Людмила Фирмаль
Знание содержания влаги в образце необходимо для точного расчета результатов анализа и содержания других компонентов. Кроме того, вода входит в состав многих соединений с определенным стехиометрическим соотношением (кристаллогидрат). Прямые и косвенные методы измерения воды были разработаны.
В косвенном методе вода измеряется путем уменьшения массы образца во время дегидратации путем нагревания воды или путем выдерживания в эксикаторе, содержащем вещество, которое может принимать энергетическую воду (P2O5, концентрированная H2SO4 и т. Д.).
В то же время этот метод дает правильные результаты, если не происходит никакого другого процесса, кроме удаления влаги из образца, то есть образец не содержит других летучих веществ. Для измерения влажности образец обычно выдерживают при температуре 105 или 110 ° С до постоянного веса.
В этом случае стехиометрическая вода или кристаллическая вода не всегда удаляются, и дегидратацию некоторых веществ, например гидроксидов, таких как железо, алюминий и т. Д., Можно проводить при довольно высоких температурах (выше 700 … 800 ° C). ) Требуется. При измерении содержания воды в органических веществах часто используется вакуумный нагрев при температуре ниже 100 ° C.
В методе непосредственного измерения влажности пары воды поглощаются осушителем (специальным веществом, которое сильно поглощает влагу (CaCl2, Mg (C104) и т. Д.)). Содержание влаги определяется Конечно, если осушитель не впитывает вещества, кроме воды, разделите на увеличение массы осушителя. Измерение кремниевой кислоты.
Кремниевая кислота или ее соли входят в состав многих горных пород, руд и других объектов. Когда камни и минералы обрабатываются кислотой, в осадке остается кремнезем с различным содержанием воды. Когда анализ начинается со слияния образцов, в результате кислотного выщелачивания расплава образуется гидратированный диоксид кремния.
Большинство элементов в этом процессе образуют растворимые соединения, которые легко отделяются от осадка фильтрацией. Однако разделение может не завершиться, поскольку гидратированная кремниевая кислота может частично проходить через фильтр в виде коллоидного раствора.
Следовательно, перед фильтрацией осадка кремниевой кислоты он имеет тенденцию к полному обезвоживанию путем испарения соляной кислоты. Во время обжига кремниевая кислота переводится в безводный БЮХ, который является гравиметрической формой. В зависимости от его массы результаты анализа часто рассчитываются.
Гидратированный диоксид кремния EHl-1NgO является отличным адсорбентом. Поэтому отложения БЮГ загрязнены адсорбированными примесями. Истинное содержание диоксида кремния определяется обработкой осадка плавиковой кислотой во время нагревания, что приводит к образованию летучего SiF. SiOa + 4HF = SiF <+ 2NgO Потеря массы после обработки осадка плавиковой кислотой равна содержанию S1O2 в образце. Определение железа и алюминия.
При анализе силикатов, известняка, некоторых руд и других пород эти элементы определяются гравиметрическим методом в смеси титана, марганца и фосфата в виде суммы так называемых 1,5 оксидов. Есть часто. Обычно после отделения кремниевой кислоты от кислого раствора сульфиды (медь и другие элементы) выпадают в осадок, а после удаления сероводорода с помощью аммиачного буферного раствора в фильтрат выпадает сумма аммиака и 1,5 оксидов. вы.
Гидроксидный осадок промывают декантацией, повторно осаждают, фильтруют, промывают и обжигают. Прокаленный осадок содержит оксиды RegO3, Al2O3, TiO2 и MnOg. Поскольку достаточно определить только сумму оксидов и нет необходимости определять содержание каждого компонента, анализ на этом может закончиться.
Если требуется более подробный анализ, прокаленный осадок легируют пиросульфатом калия для превращения оксида в растворимый сульфат, и после растворения лизата отдельные компоненты в растворе титруют или определяют гравиметрически. В случае железа титан и марганец измеряются фотометрически, а титан и марганец измеряются гравиметрически (марганец и фосфор обычно являются отдельными аналитическими стержнями).
- Содержание алюминия рассчитывается по разнице. Прямое измерение веса Общее количество триоксида основано на восстановлении сероводорода Fe (III) до Fe (II) и осаждении FeS в аммиачной среде в присутствии винной кислоты в качестве маскирующего агента. Осадок FeS растворяют в HCl, нагревают азотной кислотой для окисления, а гидроксид железа (III) осаждают аммиаком.
Измерение калия и натрия. Гравиметрия щелочных металлов представляет собой относительно сложный анализ, главным образом из-за высокой растворимости этих солей металлов. Калий и натрий могут быть определены один в присутствии другого, но также часто используется косвенный анализ: определяется количество хлорида или сульфата этих металлов, а затем содержание одного является экспериментальным.
Анализ завершается взвешиванием прокаленного Fe203. Людмила Фирмаль
Другое содержание рассчитывается по разнице. Иногда используется метод определения общей массы калия и хлорида натрия, и после обработки H2S04 определяется общая масса сульфата. Если rn — масса хлорида, t2 — масса сульфата. a w — массовая доля (%) KCl в хлоридном осадке. m, tt> Af (K2SQ4) m, (100 Вт) Af (Na2SQ4) _100 2M (KCl) + 100-2M (NaCl) ~ ~ м2 откуда w легко вычисляется. Калий в присутствии натрия осаждается в виде CrOb или KCO4.
В настоящее время соединения платины редко используются для этой цели из-за их высокой стоимости. В присутствии органических жидкостей растворимость перхлората калия в воде быстро уменьшается. На практике осадок KC10 * часто используют в присутствии смеси равных частей бутилового спирта и этилацетата. Гравиметрическую пену сушат KSSh при 350 ° C.
В присутствии калия Натрий в составе СНзС00Ма. (СНзС00) 22п.З (СНзС00) 2и02 триацетат осаждают ацетатом цинка, то же соединение в виде осушенного воздухом осадка имеет гравиметрическую форму. Измерение органических соединений.
Гравиметрический анализ органических соединений использует способность нескольких реагентов взаимодействовать с функциональными группами (карбонил, азо, сульфо и т. Д.). Это позволяет анализировать целый класс веществ с определенной атомной группой.
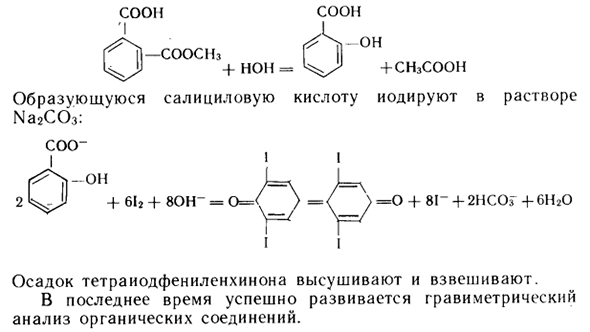
Например, соединения, содержащие метоксигруппы, определяются по схеме. ROCH3 4- HI = ROM 4- CH3I CH3! -f A * G + H20 = Agl + CHzone + Результат анализа рассчитывается по массе в формате веса Агла. Анализируя ацетилсалициловую кислоту (аспирин), она сначала реагирует с водой:
Взаимоотношения + Не = + CH3COOH Полученную салициловую кислоту йодируют раствором Na2CO3. Удивительный » Я 1 я + 6l2 + 80H «= 0 = <^ _y> —0 + 81- + 2НС0Г + 6Н20 Я Высушить и взвесить осадок катиона тетрайодфенилена. В последнее время гравиметрический анализ органических соединений был успешно развит. о 0 ‘° «^> — Готовить готовить
Смотрите также:
Решение задач по аналитической химии
| Разделение с помощью органических реагентов | Общая оценка метода |
| Осаждение с коллектором | Сущность титриметрического анализа |
