Оглавление:
Равновесие в растворах комплексных соединений
Реакцию комплексообразования в растворе можно определить как реакцию взаимодействия между ионами металла (комплексообразователя) и лигандами. Значительная часть свойств комплексных соединений обусловлена электронной конфигурацией центрального атома, донорными и акцепторными свойствами лигандов и природой связи между ионом металла и лигандами. Основными признаками комплексного соединения является наличие координационной связи, сохранение структуры в растворе и частичная диссоциация по типу слабого электролита.
Термодинамическая устойчивость комплексного иона определяется энергией связи металла с лигандом и выражается константой равновесия реакции комплексообразования 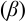 , называемой константой устойчивости (табл. 4 приложения).
, называемой константой устойчивости (табл. 4 приложения).
Образование комплексов происходит ступенчато, причем каждая ступень характеризуется константой равновесия 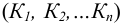 . В упрощенном виде процесс можно представить следующим образом (принимая ионную силу равной нулю):
. В упрощенном виде процесс можно представить следующим образом (принимая ионную силу равной нулю):
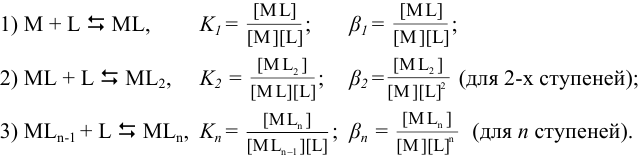
Например, для равновесий в растворе, содержащем ионы кадмия и аммиак:
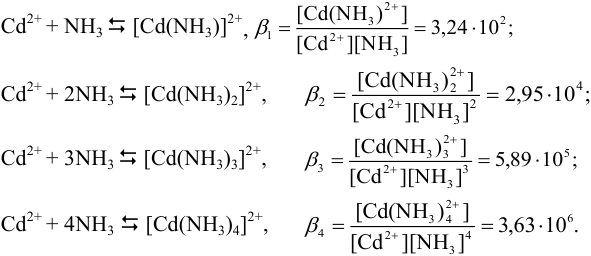
Комплексообразование широко используется в анализе для обнаружения ионов, маскирования мешающих ионов; с целью предупреждения осаждения и растворения малорастворимых соединений; изменения окислительно-восстановительного потенциала, а также для проведения количественного анализа. Зная константы устойчивости и условия проведения реакции, можно рассчитать равновесную концентрацию любой комплексной формы или свободного иона в растворе. В основе расчета лежит условие материального баланса (см. раздел 2.2).
Пример 4.1.
Рассчитайте равновесную концентрацию ионов серебра в 0,010 М растворе 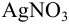 в присутствии 2,0 М раствора аммиака (см. также пример 2.6, раздел 2.2).
в присутствии 2,0 М раствора аммиака (см. также пример 2.6, раздел 2.2).
Решение:
В растворе устанавливаются равновесия:
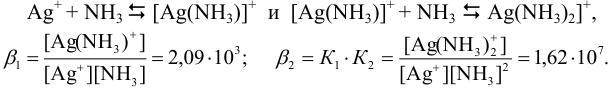
Составляем уравнение материального баланса, учитывая, что ионы серебра в растворе к моменту равновесия переходят в комплексные ионы и частично остаются в свободном виде:
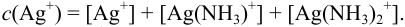
Выражаем 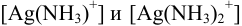 из соответствующих констант устойчивости:
из соответствующих констант устойчивости:
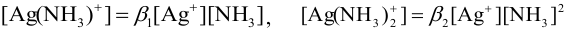
и подставляем в уравнение материального баланса:
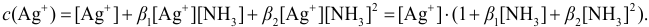
Отсюда: 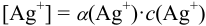 ,
,
где 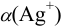 (тождественные обозначения:
(тождественные обозначения: 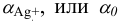 — молярная доля свободных (гидратированных) ионов
— молярная доля свободных (гидратированных) ионов 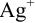 :
: 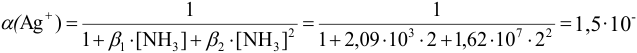
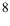 , (поскольку
, (поскольку 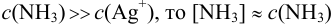 );
);
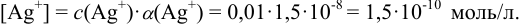
В расчетах часто вместо констант устойчивости используют обратные им константы нестойкости 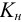 , характеризующие равновесие в реакции диссоциации комплексного соединения. Например, для соединения
, характеризующие равновесие в реакции диссоциации комплексного соединения. Например, для соединения  :
:
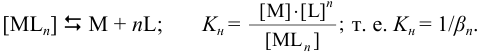
Исходя из значений констант нестойкости комплексных соединений, можно вычислять концентрации ионов, присутствующих в растворах комплексных соединений, а также степень их ионизации.
Пример 4.2.
Вычислить концентрацию ионов 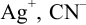 и степень ионизации комплексного иона в 0,100 М растворе
и степень ионизации комплексного иона в 0,100 М растворе 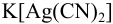 .
.
Решение:
Комплексное соединение 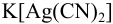 диссоциирует в водном растворе по типу сильного электролита:
диссоциирует в водном растворе по типу сильного электролита:
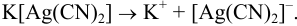
Далее комплексный ион 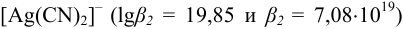 диссоциирует по типу слабого электролита по суммарному уравнению:
диссоциирует по типу слабого электролита по суммарному уравнению:
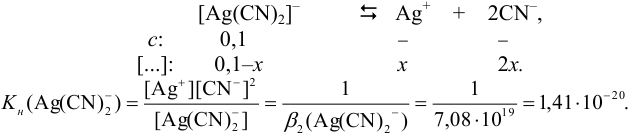
Предполагаем, что 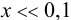 , тогда
, тогда 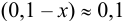 ;
;
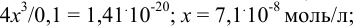
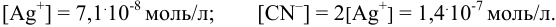
Степень ионизации комплексного иона:
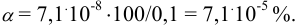
Пример 4.3.
К 0,20 М раствору сульфата меди добавили равный объем 2М раствора аммиака. Вычислить концентрацию иона 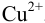 , если считать, что в растворе образуются комплексные ионы
, если считать, что в растворе образуются комплексные ионы  .
.
Решение:
Образование комплексного иона можно представить суммарным уравнением:
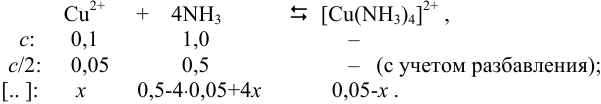
Подставляем значения равновесных концентраций в выражение для 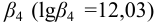 и, пренебрегая величиной
и, пренебрегая величиной 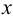 в разностях, проводим расчет
в разностях, проводим расчет 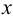 :
:
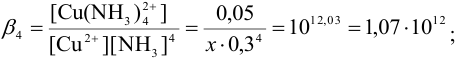
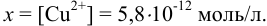
Влияние одноименного иона на равновесие в растворах комплексных соединений учитывается подобно тому, как это показано в примерах вычисления растворимости осадков (примеры 6.11, 6.12 раздела 6.2).
Пример 4.4.
Рассчитайте степень образования 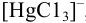 , если известно, что равновесная концентрация иона
, если известно, что равновесная концентрация иона 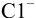 в растворе равна 1,0 10 ~ моль/л (определена экспериментально).
в растворе равна 1,0 10 ~ моль/л (определена экспериментально).
Решение:
Степень образования или молярную долю комплексных ионов ртути 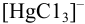 , т. е.
, т. е. 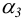 , можно вычислить по формуле (см. 2.8 — 2.10), подставляя в нее справочные значения констант устойчивости и [
, можно вычислить по формуле (см. 2.8 — 2.10), подставляя в нее справочные значения констант устойчивости и [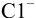 ]:
]:
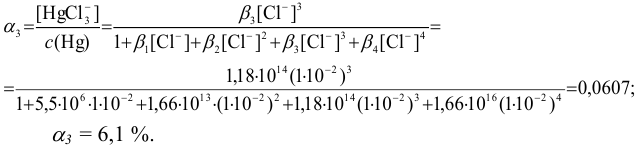
Пример 4.5.
Определите, какой комплекс преобладает в растворе, содержащем 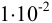 моль/л кадмия (II) и 1 моль/л аммиака?
моль/л кадмия (II) и 1 моль/л аммиака?
Решение:
В растворе, содержащем ионы кадмия и аммиак, устанавливаются следующие ступенчатые равновесия:
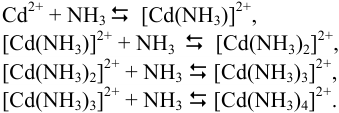
Общие константы образования (устойчивости) соответствующих комплексных ионов (см. выше) составляют:
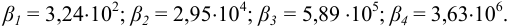
Учитывая, что 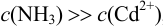 , полагаем
, полагаем 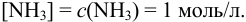
Расчет молярных долей соответствующих форм с учетом формул (2.8 -2.10) показывает, что в растворе преобладает комплекс состава 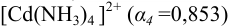 :
:

Пример 4.6.
Какое количество вещества 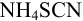 необходимо ввести в 1 л
необходимо ввести в 1 л 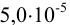 М раствора
М раствора 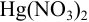 , чтобы снизить концентрацию ионов
, чтобы снизить концентрацию ионов 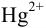 до
до 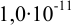 моль/л за счет образования комплексных ионов
моль/л за счет образования комплексных ионов 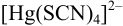 ?
?
Решение:
Реакция образования комплекса:
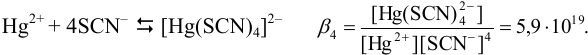
Отсюда:
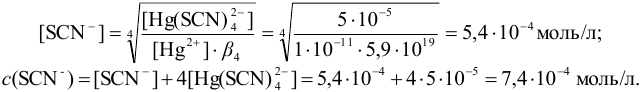
В 1 л раствора необходимо внести 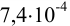 моль соли
моль соли 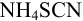 .
.
Пример 4.7.
Рассчитайте максимальное значение pH, при котором в 0,0200 М растворе 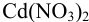 99,0 % кадмия находится в виде гидратированных ионов
99,0 % кадмия находится в виде гидратированных ионов 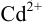 , а 1,0 % — в виде гидроксокомплекса
, а 1,0 % — в виде гидроксокомплекса 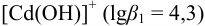 .
.
Решение:
Составим уравнение материального баланса:
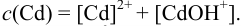
Из условия задачи следует: 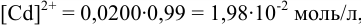 a
a 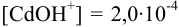 моль/л. Из константы устойчивости присутствующего в растворе гидроксокомплекса кадмия найдем
моль/л. Из константы устойчивости присутствующего в растворе гидроксокомплекса кадмия найдем 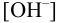 :
:
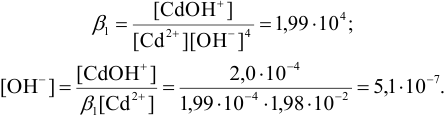
Отсюда 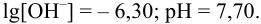
Пример 4.8.
Вычислите условную константу образования комплексоната никеля 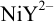 (комплекс никеля с анионом этилен-диаминтетрауксусной кислоты (ЭДТА)
(комплекс никеля с анионом этилен-диаминтетрауксусной кислоты (ЭДТА) 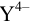 состава 1:1) в буферном растворе, содержащем 0,050 М
состава 1:1) в буферном растворе, содержащем 0,050 М 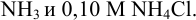
Решение:
Реакция образования комплексоната никеля
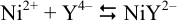
в указанных условиях сопровождается побочными реакциями образования аммиакатов никеля и протонирования аниона слабой четырехосновной кислоты — 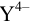 . В таком случае равновесие образования
. В таком случае равновесие образования 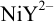 описывается условной константой :
описывается условной константой :
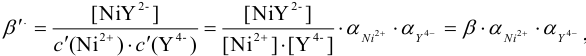
где 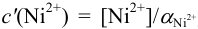 — общая концентрация ионов металла, не прореагировавших с
— общая концентрация ионов металла, не прореагировавших с 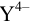 (свободные ионы никеля и входящие в состав всех аммиакатов);
(свободные ионы никеля и входящие в состав всех аммиакатов); 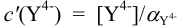 — общая концентрация всех форм ЭДТА, за исключением входящих в комплексонат никеля (свободные ионы
— общая концентрация всех форм ЭДТА, за исключением входящих в комплексонат никеля (свободные ионы 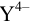 и протонированные формы).
и протонированные формы).
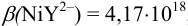 , а для аммиачных комплексов никеля
, а для аммиачных комплексов никеля
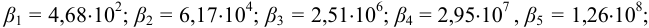
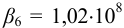 (из табл. 4 приложения). Рассчитаем молярную долю свободных ионов металла
(из табл. 4 приложения). Рассчитаем молярную долю свободных ионов металла 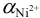 с учетом формулы (2.8):
с учетом формулы (2.8):
Доля свободных лигандов 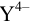 зависит от pH, задаваемого аммиачным буферным раствором. Значение pH определяется по формуле (3.11):
зависит от pH, задаваемого аммиачным буферным раствором. Значение pH определяется по формуле (3.11):
Молярную долю 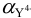 при pH = 9 можно рассчитать по формулам (2.4, 2.5) или взять из табл. 7 приложения:
при pH = 9 можно рассчитать по формулам (2.4, 2.5) или взять из табл. 7 приложения: 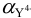 = 0,052.
= 0,052.
Используя найденные значения 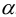 , вычислим условную константу образования комплексоната никеля:
, вычислим условную константу образования комплексоната никеля:
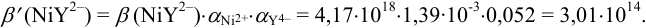
Эти примеры взяты со страницы примеров решения задач по аналитической химии:
Решение задач по аналитической химии
Возможны вам будут полезны эти страницы:
