Оглавление:





Равновесия в растворах координационных соединений
- Раствор соединения равновесный Поскольку ионы в водном растворе гидратированы (потому что они сольватированы в неводном растворе), формула образования комплексного соединения в растворе имеет вид М (Н> 0)! T + flUHjO)? «= MU (H20) J, ~ 1 Вт, + (m + nl-p) H20 (4.1) Однако схема (4.1) является проблематичной.
- Для удобства уравнения реакции комплексообразования обычно записываются в более простой форме. M ‘; + i1 / g = ML? * 1 » Имейте в виду, что участники реакции гидратированы (сольватированы). Для простоты опустите ионный заряд и получите простую схему реакции образования комплекса в растворе. M + / iL = MU (4.2) Ионы функционируют не только как лиганды, но и как нейтральные молекулы (аммиак, амины, тиомочевины и т. Д.).
Константа равновесия (4.2) комплексообразующей реакции называется константой устойчивости комплексного соединения. Людмила Фирмаль
Mamaru Процесс образования и диссоциации сложных соединений на самом деле протекает поэтапно. M + L = ML ML + L = ML * ML, + L = ML, соответствующая константа равновесия AML , FlL Формула называется ступенчатой константой устойчивости, в отличие от общей или полной константы устойчивости, определяемой уравнением (4.3) *. Постепенная константа устойчивости связана с общими простыми отношениями.
Pn = X | X2 ••• Xn-1 Xn- Для простейшего комплекса ML, такого как Ni’NH ^, понятия общих констант и констант стабильности шага совпадают. Ni2 ++ NH-, = NiNH | + ооqN.nh ^ p, = x, -. K ° p * Обратная величина константы устойчивости называется константой нестабильности: Я P * о ми .. И соответственно, шаг нестабильности постоянен: 1 0 мл .., л к х «ми …
Учитывая взаимосвязь между активностью частиц сажи и ее концентрацией (2.4), уравнение (4.3) можно переписать следующим образом: ГМУ [ML. ) Umi _ VMU P «aMat: (M) [L | n YmYL P» YMYL ‘ Где rl — константа стабильности концентрации, равная ML, (Ml (L) 4 Зависимость коэффициента активности от ионной силы раствора дается уравнением (2.8).
В сочетании с логарифмом (4.4) и (2.8.) // 7 «\ -igP «+ (| d- ° -2 /) • I-6) Где RC и RL — константы термодинамической и концентрационной стабильности соответственно. A — коэффициент, рассчитанный по теории Дебая-Хюккеля (для водного раствора при 25 ° A = 0,509). / -Из силы Авз? = -π [. Чем выше заряд реагирующих частиц, тем сильнее влияние ионной силы. Область применения уравнения (4.6) ограничивается растворами с ионной силой от 0,7 до 0,8.
Когда ионная сила увеличивается, константа стабильности начинает увеличиваться с увеличением ионной силы. Для растворов с постоянной ионной силой константа стабильности концентрации остается постоянной, поэтому равновесную концентрацию раствора можно рассчитать напрямую.
- Чтобы найти константу устойчивости, обычно используется специальная функция, которая легко вычисляется из экспериментальных данных и связана простой математической зависимостью от константы устойчивости. -_ cl- (L) Где и — общие концентрации лиганда и неметаллического комплексообразующего агента (центрального иона), соответственно: (L) — равновесная концентрация лиганда.
Функция образования n представляет собой отношение концентрации лиганда, связанного с одним или несколькими комплексами, к общей концентрации ионов металла в комплексообразующем агенте.
Физически функция образования является своего рода средним числом корректировки, которое может варьироваться от нуля (c? = [H), когда решение не сложное, до максимального максимального числа корректировки. Людмила Фирмаль
Связь между образовательными функциями и константами устойчивости может быть установлена на основе следующих соображений: жулик (4.5) Комплекс ML, MLo ….. Централизация лигандов, связанных с MLn Будет равным cL ° — | L | = (ML) + 2 | MU | + — + «(MLn) или задано (4.5): cf- [L] = pt | M] | L | + 2p, | Ml | L | 4 … + «Pn |
Общая концентрация металла может быть выражена как сумма: «M- | M | + | ML | + (MU | + … + | MU | или рассмотрение (4.5) <= | М] 4-р. | M) | L | + MM | | L) 4- + p2 | M] | L | \ (4,8) (4,7), деленное на Л-Щ ML] + 2p, | L) * + … + PM1G I i + P. [L] + P2 [L] ‘+ … + P4′-G’ Существует несколько способов вычисления констант устойчивости с использованием образовательных функций и других экспериментальных данных.
Наиболее точным методом является недавний общий метод расчета, основанный на статистическом принципе максимальной вероятности. При решении некоторых задач необходимо найти долю этого комплекса MLm, то есть относительную концентрацию: (MLM) * MU —— rg или , _ MM] [I] ML — 3J- Подставляя уравнение (4.8) в (4.9) pm [L] m_ * MU я + р. | L | + MCH2 + … + ML] «‘
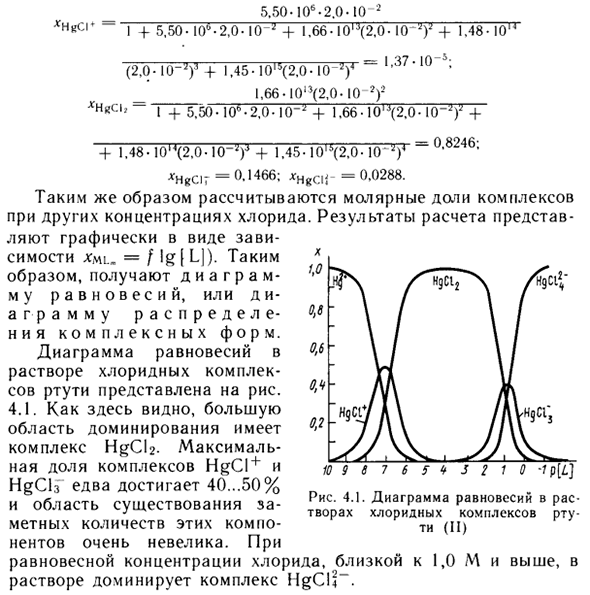
Значение xyilm изменяется от jcml- = 0 (если [MLm] = 0, т.е. без этого комплекса) до jcmu = 1 (если нет другого комплекса [ML *] = c%). В качестве примера приведены выходы различных продуктов ступенчатого комплексообразования в растворе, содержащем 1,00 * 10 «* 3 моль / л Hg (CI04) 2 n 0,020 моль / л NaCl в присутствии 0,5 М HSC * Рассчитывает при 25 ° C для предотвращения гидролиза, предоставляет конкретные значения для ионов Hg2 + и ионной силы.
В растворе образуются хлоридные комплексы HgCl +, HgCh, HgClf и HgCl2-, и константа стабильности в этих условиях составляет Rnk + g. = 5.50-10 . рНкс = 1,66-10м. pHkCb = 1,48 • 10 м, pHgcif = M5.I01 «Равновесная концентрация хлорид-иона в растворе близка к общей концентрации этого иона, т.е. | C1]» 0,020 моль / л. Это связано с тем, что концентрация ионов Hg2 + значительно ниже.
Доля каждого комплекса рассчитывается по уравнению (4.10). (4.9) (4.10) 5,50-106-2,0-10 2 1 f 5,50-10 ° -2,0-10 ‘-f 1,66- IOIJ (2,0-10’) ‘4-1,48-10’ 1.37-10 (2,0-10 «7) 1 f 1,45-10l5 (2,0-10″ 2) 4 1.66-10 ^ (2.0-10?) 3 xHkC \, -, + 5.50-10-2.0-10 » + 1.66-10, J (2.0- KG *) * + * Hgcr б. 0,8246; -f 1.48-10M (2.0.10-Y + 1.45-10us (2.0’10 * HgCir = 0,1466; * HgCij- = 0,0288. Аналогично, мольная доля комплекса рассчитывается при других концентрациях хлорида.
Результаты расчетов графически представлены в виде jcml-зависимостей. = / lg | L |) -Таким образом, получается диаграмма равновесия или комплексная диаграмма распределения. На рисунке показана диаграмма равновесия в растворе комплекса хлорида ртути. 4.1. Как видите, комплекс HgCl2 имеет большую доминирующую область.
Максимальный процент комплексов HgCl + и HgCh достигает только 40-50%, а площадь присутствия значительных количеств этих компонентов очень мала. При равновесных концентрациях хлорида, близких к раствору, комплекс является доминирующим В Рисунок 4.1 Создатель • ‘RM Диаграмма равновесия ртути (II) las хлоридного комплекса 1,0 М и выше HgCIJ-
Смотрите также:
Решение задач по аналитической химии
