Оглавление:




Равновесные соотношения
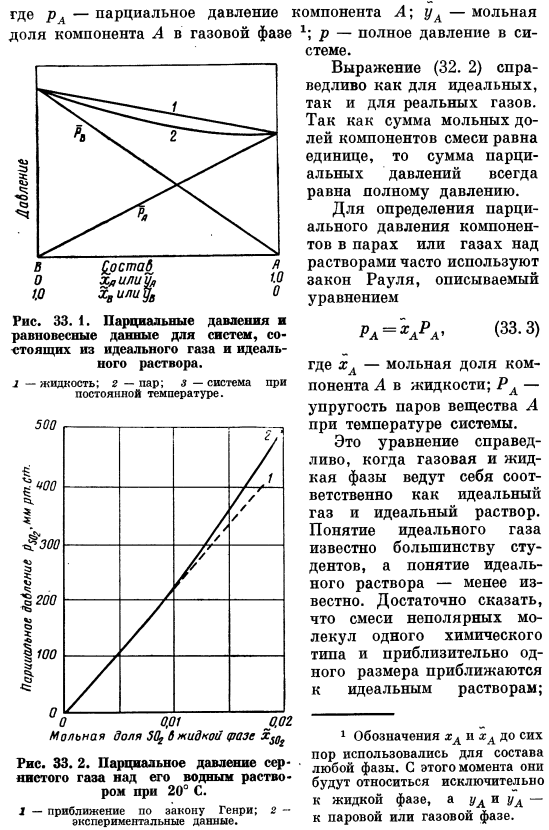
- Здесь мы рассмотрим несколько уравнений для расчета равновесного состава. Эти и многие другие полезные уравнения равновесия можно найти в книге по физической химии. Он ограничивается рассмотрением лишь нескольких простых уравнений, связанных с равновесием системы пар жидкость-газ. Другие зависимости описаны в следующих главах. -При необходимости. Представлено парциальное давление компонента газовой фазы Где pA-парциальное давление компонента A. Молярная доля компонента A в газовой фазе st*; p-полное давление в системе. Уравнение (OD 2) справедливо как для идеального, так и для реального газа.
Сумма молярных долей компонентов смеси равна 1, поэтому сумма Парциальное давление всегда будет равно общему давлению. Для определения парциального давления компонента в парогазовом растворе часто используется закон Рауля, который описывается следующим уравнением: Рл = «лрл — (33.3) Где ха-молярная доля компонента а в жидкости. RA-давление паров вещества A при температуре системы. Это уравнение эффективно, когда газовая фаза и жидкая фаза ведут себя как идеальное решение и идеальный газ соответственно. Концепция идеального газа Большинство студентов знают, а понятие идеального решения известно немногим. 1.
Распределение теплопроводности можно представить эллипсом, оси которого соответствуют максимальному и минимальному значениям теплопроводности. Людмила Фирмаль
Достаточно сказать, смесь неполярных молекул одного химического Подход примерно того же размера, что и тип, является идеальным решением. 1 Название xA использовалось для композиции любой фазы вплоть до отверстий xA и xA. С этого момента они становятся исключительно жидкими, а я и я-к Пар или паровая фаза. Примером может служить связанный член гомологического ряда. Для идеального решения тепловой эффект смешивания и изменение объема при смешивании равны нулю. Парциальное давление обоих Как показано на рисунке, компоненты отображаются в зависимости от молярной доли при постоянной температуре. 33. 1,они представлены прямыми линиями, наклон которых соответствует давлению пара.
- Закон Рауля обычно наилучшим образом описывает экспериментальные данные при высокой концентрации компонентов. * Закон Генри-обобщенная зависимость, частным случаем которой является закон Raul. It выражается следующим образом (33.4) Рл = ’хлна’ отражает линейную зависимость парциального давления от состава. Значение NA является постоянной величиной и обычно определяется experimentally. In В некоторых случаях постоянная Генри будет равна давлению пара компонента A. закон Генри обычно низок Например, концентрация, указанная экспериментальными данными, показана на рисунке. 33. 2.Закон Генри играет определенную роль в вычислении процесса Многие из них работают с разбавленными смесями.
Пример 33.1. 80°С . Идеальный газ. При 80°C давление паров бензола и толуола равно. Бензол является компонентом а, а толуол-компонентом В. парциальное давление, согласно закону Рауля, равно: (1) (2) (3) (4 )) Комбинация урана (5) (6) Принимаются следующие сокращения.%моль. — Молярный массовый процент; вес%. — Процент по массе;%об. — (Примечание, редактировать) В дальнейшем、 «Л + * б=’ — Уравнение (5)-(7) решается относительно 3 переменных:= 0.415; Полное давление равно сумме парциальных давлений. Р=Рл+₽в= *лра+ *врв= «Лрл+(1-«л)РВ ’ При постоянной температуре давление пара Рл и РВ равно constant. So, состав жидкости xA является линейной функцией от всей фигуры.
Что-бы применить к этим анизотропным материалам уравнение теплопроводности, его необходимо соответственно пересмотреть. Людмила Фирмаль
Полное давление изменяется от p = Pb、 ХЛ =1.Состав пара、 Откуда РЛ = Улр = ’ hlrA- Составьте уравнение равновесного состава пара и жидкости в системе, где давление равно constant. In в этом случае фаза действует как идеальный газ и идеальная жидкость. Представляет 2 компонента системы в A и B.
Смотрите также:
| Массопередача между фазами | Коэффициенты массоотдачи |
| Фазовое равновесие | Коэффициенты массопередачи |
