Оглавление:

Реакции кислотно-основного взаимодействия
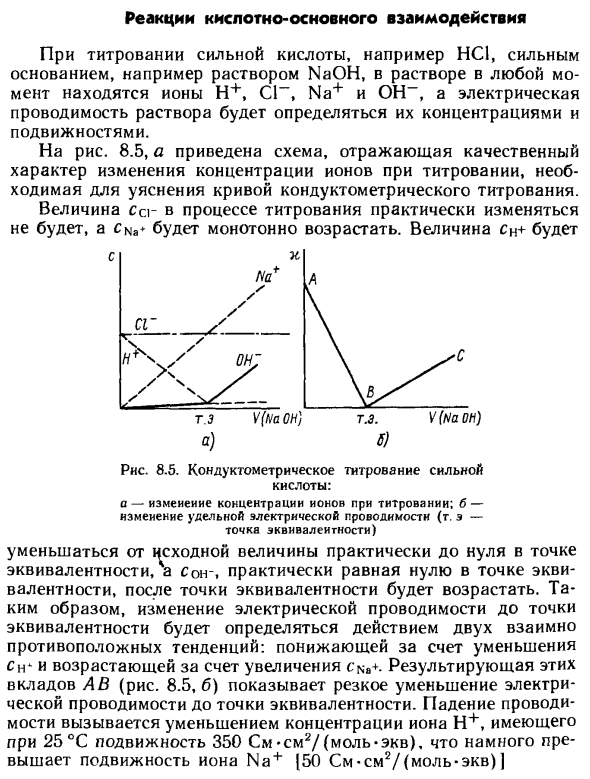
- Кислотно-основная реакция При титровании сильных кислот, таких как HCl, с сильным основанием, таким как раствор NaOH, ионы H + t Cl ~, Na + и ОН всегда находятся в растворе, и проводимость раствора зависит от его концентрации и подвижности. Рисунок 8.5 и схема, которая отражает качественный характер изменения концентрации ионов во время титрования, необходимого для понимания кривой титрования проводимости.
- Значение cc в течение процесса титрования существенно не изменяется, и CCa + монотонно возрастает. Титрование проводимости сильных кислот: a-изменение концентрации ионов во время титрования; b-изменение электропроводности (т. е. эквивалентная точка) а) б) Sleep-, который уменьшается от начального значения в изо-точке до почти нуля и почти до нуля в изо-точке, увеличивается после изо-точки.
Значение sn + равно Рисунок 8.5. Людмила Фирмаль
Таким образом, изменение проводимости до точки эквивалентности определяется действием двух противоположных трендов, которые уменьшаются с уменьшением Cn и увеличиваются с увеличением cNa +. Результаты этих вкладов AB (рис. 8.5.6) показывают, что электропроводность быстро уменьшается до эквивалентной точки.
Снижение проводимости вызвано уменьшением концентрации ионов H + с подвижностью 350 см · см2 / (моль-экв) при 25 ° C. Это Na + | 50 см-см2 / (моль-экв) | После равной точки начинается быстрое увеличение электропроводности (ветвь BC). Концентрация ионов Na + и ОН увеличивается в растворе, и его подвижность составляет 199 см-см2 / (моль-экв), но увеличение BC более умеренное, чем уменьшение.
Поскольку подвижность ионов ОН- почти в два раза выше подвижности ионов водорода, они движутся вдоль АВ. Точка эквивалентности титрования проводимости обычно определяется графическим построением. Как видно из рисунка, экспериментальные значения электропроводности раствора в непосредственной близости от 8,5, б, точки эквивалентности не имеют особого значения.
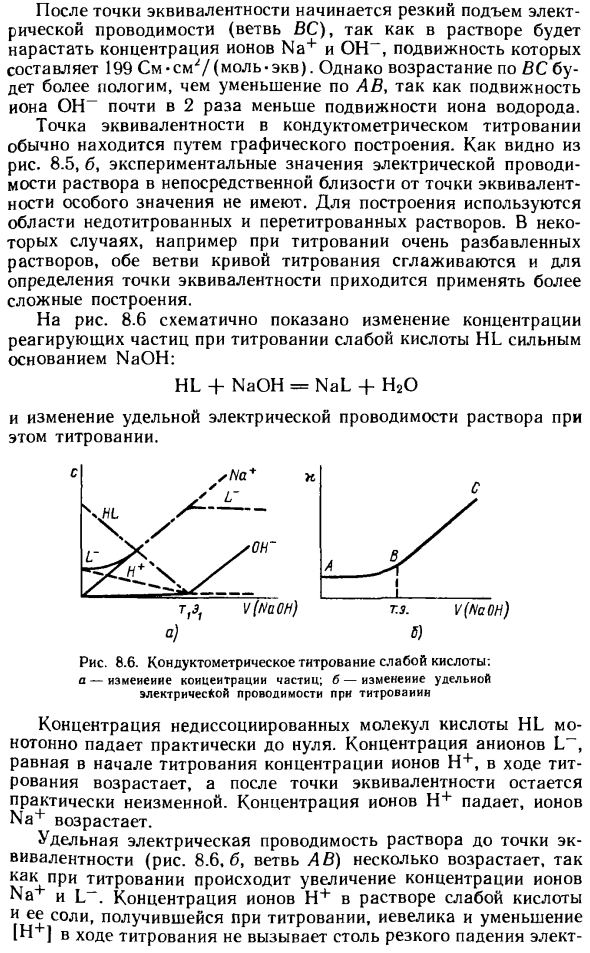
Конструкция использует области нетитрационного раствора и раствора для повторного титрования. Например, при титровании очень разбавленных растворов обе ветви кривой титрования сглаживаются, и для определения точек эквивалентности необходимо применять более сложные структуры. На рис. 8.6 схематически показано изменение концентрации реакционных частиц при титровании слабой кислотной HL сильным основанием NaOH.
HL + NaOH = NaL + H20 Изменение электропроводности раствора при этом титровании. Рисунок 8.6. Титрование проводимости слабой кислоты: изменение концентрации a-частиц, изменение b-электрической проводимости во время титрования а) б) Концентрация недиссоциированных молекул HL-кислоты монотонно уменьшается почти до нуля.
- Концентрация анионов равна концентрации ионов H + в начале титрования, увеличивается во время титрования, и точка эквивалентности остается практически неизменной. Концентрация ионов H + уменьшается, а ионов Na + увеличивается. По мере того, как концентрация Na и L в ионах увеличивается во время титрования, проводимость раствора до точки эквивалентности (рис. 8.6.6, ветвь AB) немного увеличивается.
Концентрация ионов H + в растворе слабых кислот и их солей, полученных при титровании, уменьшение [H) при титровании не вызывает столь резкого падения Рическая проводимость наблюдается при титровании сильной кислоты. При титровании кислот средней силы на кривой AB может иметь место минимальная проводимость, отражающая общий эффект уменьшения концентрации ионов Hb и увеличения концентрации ионов Na +. 8.6, б, филиал БК).
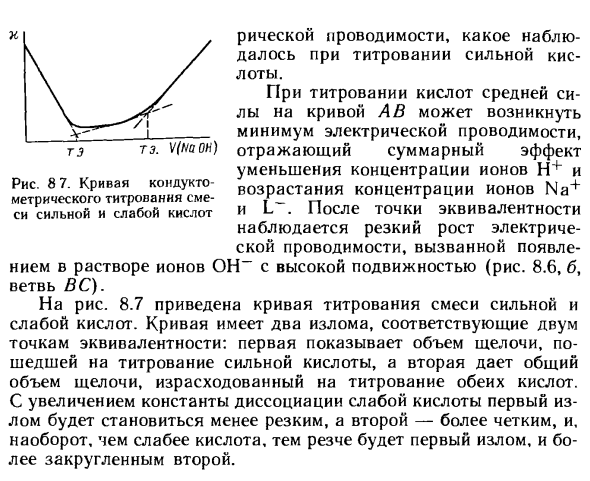
На рисунке 8.7 показана кривая титрования для смеси сильных и слабых кислот. Людмила Фирмаль
Кривая имеет два поворота, соответствующих двум эквивалентным точкам. Первая показывает количество щелочи, используемой для титрования сильной кислоты, а вторая показывает общее количество щелочи, используемой для титрования обеих кислот.
Когда константа диссоциации слабой кислоты увеличивается, первый излом становится острее, второй излом становится острее, и, наоборот, чем слабее кислота, первый излом становится острее, а второй становится более округлым. вы. Рисунок 8 7. Кривая титрования электропроводности смеси сильных и слабых кислот
Смотрите также:
Решение задач по аналитической химии
| Прямая кондуктометрия | Реакции осаждения кондуктометрического титрования |
| Кондуктометрическое титрование | Реакции комплексообразования кондуктометрического титрования |
