Оглавление:









Соли
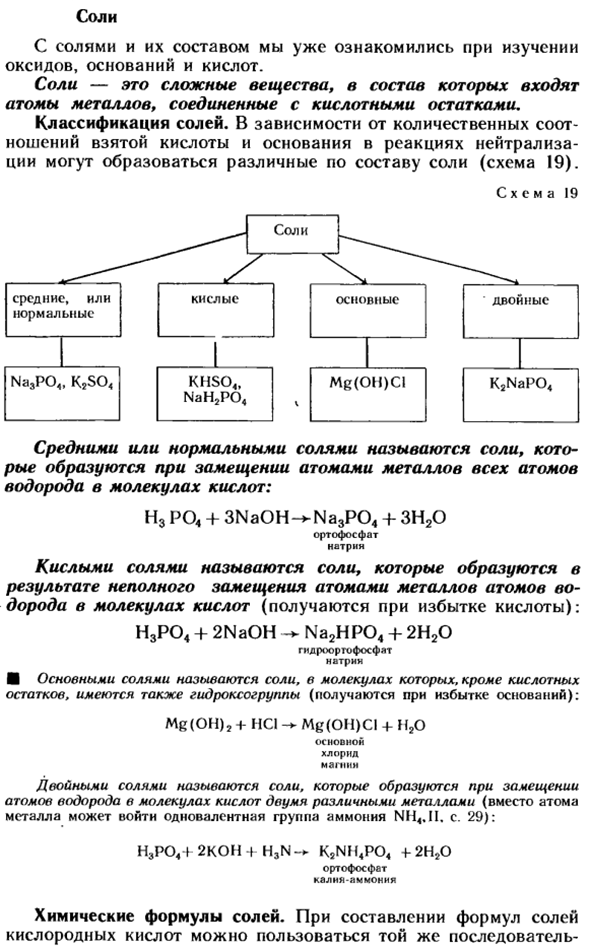
- Соль Уже привыкли к соли и ее составу при изучении оксидов, оснований и кислот. Соли-это сложные вещества, которые содержат атомы металла, связанные с кислотными остатками. Классификация солей. В зависимости от количественного соотношения используемой кислоты и основания в реакции нейтрализации могут образовываться различные составы солей (схема 19).
- Схема 19 Средняя или обычная соль-это соль, образующаяся, когда атом металла вытесняет все атомы водорода в молекуле кислоты. Н3Р04+ 3Na0H — * Na3P04 +ЗН20 Ортофосфат натрия Кислотные соли-это соли, образующиеся в результате неполного замещения атомами металла атомов водорода молекул кислоты(полученные с избытком кислоты).
Н3Р04+ 2NaOH + Na2HP04 + 2NgO Гидрокарбонат натрия ортофосфат ■ Людмила Фирмаль
Основные соли-это соли, в которых, помимо кислотного остатка, молекула содержит такокехидлоксогруппу (полученную с избытком оснований). Мг(о),+ Нсl мг (о) ки + н, о Основной хлорид магния Двойные соли-это соли, образующиеся при замещении атома водорода молекулы кислоты 2 различными металлами (вместо атома металла-моновалентное аммониевое основание NH4.II может войти: стр.): H, P04 + 2K0H + H3N-h. K2NM4P04 4-2H20 Ортофосфат калия аммония Химическая формула соли.
Такая же последовательность может быть использована для создания формулы кислород кислота соль Составление химических формул(стр. 27). Например, если вы хотите составить химическую формулу сульфата алюминия и ортофосфата кальция: 1.Далее напишите химический символ металла и кислотного остатка. AIS04 CaP04 2.Над химическим знаком остатков металла и кислоты записывается их валентность.
Болезнь II болезнь AIS04 CaP04 3.Найдите наименьшее кратное числа, которое представляет валентность остатков металла и кислоты. 0, 0. Ii ii болезнь L1SUI CA TOT 4.Минимальное кратное делится на валентность металла, чтобы найти индекс, затем валентность кислотного остатка, чтобы найти индекс. Если в молекуле содержится несколько остатков кислоты, то они заключаются в круглые скобки.
AI2 Lani и n (S04), Ca3 (P04) 2 Это рекомендуется делать при создании графических формул солей типа AI2(S04) 3,Ca (H2P04) 2 и (Cu0H) 2C03. I. напишите 1 под другими химическими символами металлов и атомов водорода. Валентность обозначается тире: АУ£[} — КР < ЦС <Н-Н- Си Ai6 успешно 2.
Химические символы атомов металла и водорода с тире связаны с атомами кислорода. «Φa = 8 = c <°- НЕ-Е-Е- а N8z Н-О- 3.Химический знак атома кислорода с тире также связан с центральным атомом кислотного остатка, а в основной соли-с атомом водорода гидроксо-группы. О ч-ов о 11-О-s-SH-0 — > с< N9 ^ S Ca — ^ AlfO-S H-O ^ Y и Y Н-СК С \ Большинство солей имеют молекулярную структуру. Да. 4.
Химический символ оставшегося атома кислорода присоединяется к центральному атому кислотного остатка с помощью тире. О ^ ^ О нет Al-O ^ OH-О-Р= 0 5 = << Ал-0.^ O I-0-P = 10 Да. Название соли. В настоящее время соль, как и другие соединения, названа в соответствии с международной номенклатурой(таблица 13). Таблица 13.Название и формула соли и соответствующей кислоты
Название и формула соли название и Формула кислоты NaF-фторид натрия A1C13-хлорид алюминия AgN03-нитрат серебра (1) CuS04-сульфат меди (II). Znns03-сульфит цинка CaCOe-карбонат кальция Ba3 (P04) 2-ортофосфат бария HF-плавиковая кислота HCI-соляная кислота HN03-азотная кислота H2S04-серная кислота II2S03-серная кислота I2COe-двуокись углерода N, P04-ортофосфорная кислота В ответ на этот вопрос, упражнения 1-4 (стр. 92).Решите задачу I и 2(стр. 92).
Способ получения соли. Реакции, приводящие к образованию солей, неоднократно изучались в предыдущих работах. section. It затем эта информация записывается в определенную систему. 1.Соли получают путем воздействия кислот на металлы, основные оксиды и основания. 2Н3РО» + 6N»I-2na3p04 *» 3H2f Ортофосфат натрия 3H2S04 + Fe203-Fe2 (S04) 3 \ ЗН20 Сера / 11 желез «(III) 3HNO,+ Cr (OH) e-V Cr (N03)3 + 3HtO Нитрат хрома (III)
2.Соли образуются при взаимодействии кислых оксидов со щелочами, а кислых оксидов с основными веществами. N2Ofi + Ca (OH), -; Ca (NO.)2 + H20 Кальциевая селитра P208 + 3CaO-V Ca, (P04) 2 Фосфат кальция 3.Соль получают взаимодействием солей с кислотами, щелочами. Металлы, нелетучие кислотные оксиды и другие соли.: Ca, (PO»), I-3H2S04 3CaS04-f 2H, P04 * Сульфофосфат Кальций. кальций. с = о В иFc, (So Alpha), b CNaOH 2Fe (OH)34+ 3Na2S04 В)711.подъем от f: и Солил (III)» CuSO, а. к. а. ПК-Фесо «+ КР Дж сульф. п в «.11.Ф; 1Т 111 МС) xi и**; <(II) CaCOj + Si02 L CaSiO, f C(\ f KIRLMZHLT СИЛ ВТОРОЙ.
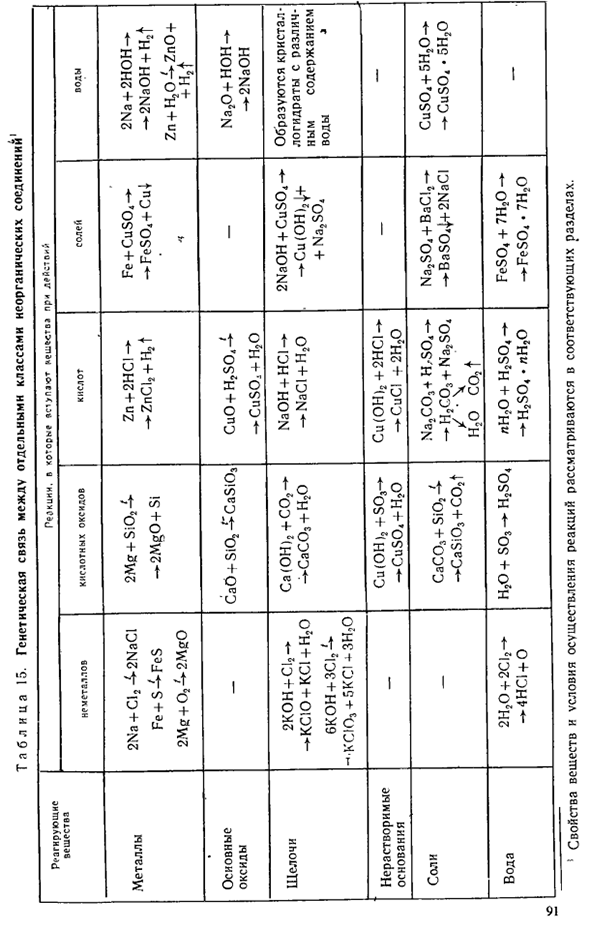
Это Киришм. AI,(S04)3 f 3BaCI2 3BaS04J + 2AICI、 резюме О. фталат поливинилхлорид Алюминий Валиум gmria алюминий 4.При взаимодействии металлов и неметаллов образуются соли. Сжигание 2tt1212-2feci3 Хлорид FSDS 3.1 (III) Реакция, в которой образуется соль, описана также в таблице 15 (стр. 91). Вопрос 5-9 (стр. 92).Решите задачу 3 (стр. 92). Физические свойства соли. Соль-это твердое вещество разных цветов.
Их растворимость различна. Некоторые соли, например, все нитраты, очень растворимы в воде. Другие, такие как карбонат кальция CaCOe и сульфат бария BaSO4, практически нерастворимы(см. Приложение I, стр. 187).Таблица 14 позволяет легче запомнить растворимость наиболее важных веществ, которые чаще всего встречаются на курсах химии средней школы.
Таблица 14 информация о наиболее важной растворимости соли НЛ. Более высокая растворимость соли Нитрат ацетат все соли растворимы Все соли, за исключением хлоридов информацию agci и PbC12 растворимы Все соли кроме AR из сульфита CaS04, SrS04, BaS04, PbS04 растворимы? S04 Сульфид карбонат силикат фосфат к. почти все соли, кроме Na и аммониевых солей, нерастворимы. Химическая природа соли.
При изучении способа приготовления солей мы уже знакомы с некоторыми их химическими свойствами. Мы подробно разберем этот вопрос. 1.Соль вступает в реакцию с металлом(стр. 33).Некоторые N составляют уравнение этих реакций. Н. Н. Кетова (с. 79).Поскольку эти реакции протекают в водных растворах, литий Li, натрий Na, калий K, кальций Ca, барий Ba и другие активные металлы, которые реагируют с водой в нормальных условиях, не могут быть использованы в реальных экспериментах.
2.Соль вступает в реакцию с кислотами. При проведении этих реакций они обычно берут сухую соль и действуют концентрированной кислотой(стр. 79).. 3.Соль вступает в реакцию со щелочью в водном растворе. Так получают нерастворимые основания(стр. 72). 4.Соль реагирует с солью. Реакция протекает в растворе и используется для получения практически нерастворимых солей(с. 89).
5.Некоторые соли разлагаются при нагревании. Типичным примером такой реакции является прокаливание известняка, основным компонентом которого является карбонат кальция. CaCOe Као-fC021 Карбонат кальция Использование соли. Большинство солей широко используются в промышленности и быту. Например, все знают об использовании поваренной соли, то есть хлорида натрия, в быту life.
- In индустрия, она использована для произведения окисоводопода натрия, соды, хлора, натрия ЕТК. Соли азотной и фосфорной кислот являются в основном минеральными удобрениями. Многие средства защиты растений от болезней, вредителей и некоторых лекарственных веществ также относятся к классу salt. In более подробно использование отдельных солей будет рассмотрено при дальнейшем изучении химических элементов.
Генетическая связь между отдельными классами неорганических соединений. Из 1 класса вещества можно получить другой класс вещества. Взаимосвязи между отдельными веществами могут быть представлены следующими схемами: Калифорния-> — САО Са(он) Два Общий формат: Металл — > основная оксидная основа — ^ 3 ^Соль Неметаллическая кислотная окись — * ■ кислота^
Эта связь называется наследственностью (от греч.«Генезис» — происхождение). Людмила Фирмаль
В более детальной и обобщенной форме генетическая связь между отдельными классами неорганических соединений описана в таблице 15 (стр. 91). Выполните упражнение 10.^ 1.Показывает химическая формула вещества: метил, NaHS04, размере 20,Фе (о)3,£С(с бортовым номером 03) 3, Са(HC03)2,N205,ч, В03. Ли20. С02, ва (он) 2, СА3 (пд)
2. Нарисуйте таблицу в блокноте и поместите формулу в соответствии с соответствующим столбцом. Osiochs KIICL <P IIUC Окисленная соляная кислота 2.Химическая формула и диаграмма следующих солей написаны: карбонат магния, бикарбонат железа (II), сульфат железа (III), гидрофторитрат кальция, карбонат магния и дигидрооритрат кальция.
3. Напишите название соли, данное по формуле: NaC1, NaN03, CaCI» KHS04, AI (N03) 3, K3P04, Na2S04. Na2S03, Ca (HS) 2, FeS04,ArN03. Fe2 (S04)3, Na2C03, Cr2(S04) 3,NaHC03, Ca (HC03) 2. 4.Напишите формулу самой важной соли следующей кислоты. б)серная кислота; в)азот; г) ортофосфорексия; д) уголь. Что это за соли? 5.Перечислите способы получения солей и опишите 2 уравнения соответствующих химических реакций.
При необходимости используйте таблицу 15. 6.Составьте уравнение химической реакции, схема которой приведена below. Ca H-CaS04 t P. P, 05 + …- *Ca3 (P04) 2 IH20 ПК3 + …- *Касо <Би. Из, Л -…- «- Ca (N03) 2 СА (он) 2 + …- *- CaS04 Н20 ЦАО-CnS03 7.To получают следующее вещество, которое следует наносить на хлористый кальций. б) карбонат кальция; в)ортофосфат кальция; г) гидроксид кальция; д) хлористый водород? Напишите уравнения реакции и объясните, почему они идут до конца.
8.Что получается из оксида кальция 2 способами: а) сульфат кальция. б)ортофосфат кальция? Создайте уравнения для этих реакций. 9.Напишите уравнение нейтрализации reaction. As в результате образуется соль. Его формула: a)A1C13; b) BaS04; c)Ba(N03) 2; d) Na3P04; d)NaNO; e) NaHSO; g) KH2R04; h) K2HP04 под соответствующей формулировкой вещества напишите его название.
10.Создайте уравнение реакции. Схема: а)Ка-vCaO — * компакт-диск (ах)2 —С»(с бортовым номером 03), CaS04 б)А1203 — * А12(S04)3-АИ (он) 3 — * Alj03 c) CaCOe — * ■CaO Ca (OH)2 — * — CaCOg — * — Ca (NO.) s d) Cuo CuS12 Cu (ONSi Cuus04 Sp (OH) 2 е) мг- * -МГО-«-мг (сайт OHB-MgS04 f) С^С02-N <isC03-С02 CAC CaC03 g) Fe2 (S04) 3-Fe (OH) 3-Fc, 0, Fc, (SO «)、 h)P — * — P20s — ^ H3P04 — ^ Ca3 (P04)2 — ^ H3P04 — ^ Ca (H2P04)2 i) AI2 (S04)3-v AI (OH), A1203-A1C13-A1 (OH), AI (OH)2C1 j)S03〜 * ZnS04-Zn (OH) 2 — * K, Zn02 fl.
Рассчитайте, какие из следующих азотных удобрений являются наиболее распространенными Otom: NaN03, Ca (N03)2, KN03,NH4N03,(NH4) 2S04. 2. Экспериментально установлено, что 1.35 может быть. 5/2/4 алюминиевое время соединения. Содержит серу. Выведите химическую формулу этого вещества и дайте ему имя. 3.Рассчитайте массовое соотношение, в котором необходимо смешать гидроксид кальция с фосфатом, чтобы произошла полная реакция нейтрализации.
Лабораторные опыты Свойства растворимых и нерастворимых оснований. Рассмотрим гидроксиды натрия, кальция, меди (II) и железа (III), полученные in vitro、 Агрегатное состояние и цвет. Налейте 3-4 мл воды в пробирку и встряхните it. It будет фильтровать мутную жидкость. Добавьте несколько капель раствора фенолфталеина. * Гидроксид натрия растворим в воде, гидроксид кальция частично растворим, гидроксид меди (II) и железа (III) практически нерастворимы в воде.
Раствор гидроксида натрия и гидроксида кальция окрашивает фенолфталеин в малиновый цвет. Фильтрованный раствор, перемешанный с гидроксидом меди (II) и гидроксидом железа (III), не действует на раствор фенолфталеина. Задача. На основании проведенных экспериментов сделаны выводы о растворимости основания. Влияние кислоты на показатели. Поместите 9 трубок в стойку.
Налейте 1 мл разбавленной серной кислоты в первые 3 пробирки, 1 мл разбавленной соляной кислоты в следующие 3, такую же разбавленную азотную кислоту в другие 3. В первую пробирку, содержащую серную кислоту, добавляют несколько капель раствора пурпурной лакмусовой бумажки или каплю пурпурной лакмусовой бумажки, несколько капель раствора фенолфталеина, вливают во 2-ю пробирку и кладут 3-й метиловый апельсин.
Выполните тот же эксперимент с использованием соляной и азотной кислот. Лакмусовая кислота покраснеет, фенолфталеин останется бесцветным, а метиловый апельсин станет розовым. Задача. Показаны некоторые решения. Как я могу доказать, что 1 из них является кислотным раствором, а другой 1-щелочным раствором? Влияние кислот на металлы. Положите 2 части цинка в 2 пробирки, налейте небольшое количество железа в оставшиеся 2 части, а последние 2 части с медной стружкой.
Налейте 1 мл серной кислоты в одну пробирку, содержащую цинк, и такое же количество соляной кислоты в другую пробирку. Цинк бурно реагирует с acids. In в этом случае газ высвобождается. Можно сжечь. Аналогично добавьте кислоту в пробирку с железом и медью. Железо реагирует с кислотами медленнее, чем цинк, а при нормальной температуре медь не реагирует с серной или соляной кислотами. При нагревании медь реагирует с концентрированной серной кислотой acid.
In в результате этой реакции выделяется бесцветный газ с резким запахом.) И в пробирке образуется синий раствор. Задача. 1. Н. Н. найти железо, цинк и медь из серии Бекетова и думать, основываясь на характеристиках этой серии была отредактирована. 2.Напишите уравнение химических реакций, наблюдаемых в этом эксперименте. С какими реакциями они связаны? Взаимодействие кислот с основными оксидами. Опыт.
Залейте оксид меди (II) в 2 трубки. В 1 из них влить 1 мл разбавленной соляной кислоты, а в другой 1 мл такого же количества разбавленной серной кислоты. Пробирку слегка. При нагревании в пробирке, содержащей оксид меди (II), раствор становится синим. Вылейте несколько капель раствора из каждой пробирки в стеклянную тарелку и, выпарив, проверьте, что осталось на тарелке.
После выпаривания раствора, кристаллы кристаллизуются на стеклянной пластине. Проделайте тот же эксперимент с оксидом железа (III). Назначение. I. каковы признаки, подтверждающие реакцию основных оксидов с кислотами? 2.Какие вещества выделяются в стеклянную пластину после испарения раствора? Напишите химическую формулу этих веществ. 3.Создайте уравнение для реакции, которая произошла в этих семгах.
Взаимодействие кислоты и щелочи(реакция нейтрализации). Налейте в пробирку 1 мл раствора гидроксида натрия и добавьте в»ЧУ»несколько капель раствора фенолфталеина. Используйте пипетку с соляной кислотой. капните в раствор для окрашивания губ. Встряхивайте трубку каждый раз, когда вы ее роняете. Происходит нагревание и обесцвечивание раствора. Затем полученный раствор переносят на стеклянную пластину и выпаривают.
Белый кристалл изолирован. Задача. I. рассмотрим причины, по которым необходимо тщательно капать раствор кислоты. 2.Какие вещества выделялись при испарении раствора? Напишите его химическую формулу. 3.Делает реакцию хлористо-водородной кислоты и окисоводопода натрия равной. С какой реакцией это связано? Взаимодействие кислот и нерастворимых оснований. Получить немного меди (II) hydroxide.
To для этого налейте 1 мл раствора гидроксида натрия в 2 пробирки и добавьте такое же количество раствора сульфата меди (II) или другой растворимой соли меди. Добавьте соляную кислоту в пробирку с полученным осадком до полного растворения, затем добавьте серную кислоту в другую пробирку. На обеих трубках образуется синий раствор. Несколько капель полученного раствора переносят на стеклянную пластину и выпаривают.
Синие кристаллы выделяются. Задача. 1.Напишите химическую формулу вещества, в котором Кристалл выделяется на стеклянной пластинке. 2.Создайте уравнение реакции, наблюдаемое в этом эксперименте. Взаимодействие оксидов кислот с водой и щелочью. Эксперимент I. налейте около 5 мл воды в пробирку, добавьте 1-2 капли раствора фенолфталеина и разбавьте раствор гидроксида натрия до появления небольшого пятна.
Избыток оксида углерода (IV) пропускают через раствор. Обесцвечивание произойдет. Эксперимент 2,2-3 мл свежеприготовленной известковой воды заливают в пробирку, пропуская окись углерода (IV) до тех пор, пока раствор не станет мутным. Задача. 1.Объясните, почему обесцвечивание раствора произошло в первом эксперименте. Напишите уравнение соответствующей реакции.
2. Почему во 2-м эксперименте получается раствор мутности? Напишите уравнение реакции. Наличие и свойства гидроксида цинка. Раствор с массовой долей 0,05 или 5% гидроксида натрия 1 мл наливают в 2 пробирки и добавляют раствор сульфата цинка до образования осадка. Добавьте избыток гидроксида натрия в 1 пробирку с гранулой и встряхните*влейте серную кислоту или соляную кислоту в другую пробирку.
Для сравнения поставьте 2 пробирки с гидроксидом железа (III).Добавьте кислоту в осадок первой пробирки и избыток щелочи в осадок второй пробирки. Осадок гидроксида цинка реагирует с кислотой и щелочью, гидроксид железа (III) — только с кислотой. Задача. I. напишите 2 уравнения химических реакций, которые вы можете получить. а)гидроксид цинка. b) гидроксид железа (III). 2.Опишите формулу реакции взаимодействия гидроксида цинка. а)с соляной кислотой; б)с гидроксидом натрия.
Как называются эти гидроксиды? Практика 1 Получение сульфата меди (II) путем взаимодействия оксида меди (II) и серной кислоты. 1. 0,2 массовой доли, или 20%раствор с серной кислотой около 20 мл наливают в стакан, ставят его на асбестовую сетку и нагревают раствор до кипения. 2.Небольшое количество оксида меди (II) заливают в горячий раствор серной кислоты и перемешивают содержимое стеклянной палочкой.
Если весь оксид меди (II) вступает в реакцию, добавляйте до тех пор, пока не останется незначительного избытка. Всегда нагревайте раствор, но не доводите его до кипения. Затем поместите воду в пробирку и нагрейте раствор, пока он не закипит. 3.Пока раствор нагревается, подготовьте фильтр. Полученный раствор фильтруют в фарфоровую чашку. 4.Раствор выпаривают в фарфоровой чашке до появления первых кристаллов соли.
Затем прекращают нагрев и наблюдают дальнейшую кристаллизацию, которая происходит в результате охлаждения раствора. Практика 2 Решение экспериментальной задачи на тему «важнейший класс неорганических соединений».Задача 1.Экспериментальное доказательство того, какая пробирка является решением. хлорид натрия. б) гидроксид натрия; в) соляная кислота. *
Задача 2.Одна пробирка содержит дистиллированную воду, а другая-раствор хлорида калия. Выясните, в какую трубку подается каждое вещество. Задача 3. 2 пробирки будут даны следующее: B) оксид цинка. Определите пробирки, содержащие каждое из этих веществ. Задача 4.На основе металлического цинка получают гидроксид цинка. Задача 5.Дан оксид меди (II).Получают гидроксид меди (II). Задача 6.Дают раствор гидроксида кальция (известковая вода).
Получают карбонат кальция, а из него-раствор хлористого кальция. 」 Задача 7.Получают оксид железа (III) из хлорида железа (III). Задача 8.Давали кристаллический хлорид магния. Затем получают гидроксид магния. Задача 9.Из раствора сульфата меди (II) получают раствор хлорида меди (II). Задача 10.It фактически осуществляет следующее превращение: карбонат меди (II) — хлорид меди (II) гидроксид меди (II) оксид меди (II).
Смотрите также:
| Оксиды | Моль — единица количества вещества |
| Амфотерные гидрокды и оксиды | Молярная масса |
Если вам потребуется заказать решение по химии вы всегда можете написать мне в whatsapp.
