Способы выражения состава раствора
Растворы. Молярная концентрация. Моляльность.
Массовая и молярная доля растворенного вещества. Плотность раствора. Титр раствора вещества.
Растворами называются однородные (гомогенные) системы переменного состава, содержащие не менее двух компонентов. Среди компонентов раствора выделяют один, который считают растворителем; другие компоненты раствора считают растворенными веществами.
В широком смысле под растворами понимаются гомогенные системы в любом агрегатном состоянии. Под твердыми растворами понимают системы переменного состава, в которых различные атомы образуют общую кристаллическую решетку. Примерами твердых растворов с полной взаимной растворимостью могут служить сплавы серебра с золотом или меди с никелем. Газовые растворы — это смеси любых количеств различных газов.
В химической практике более важны жидкие растворы, которые представляют собой гомогенные смеси, приготовленные на основе жидкого растворителя. Наиболее распространенным и широко применяемым растворителем является вода. Кроме нее, в качестве жидких растворителей часто применяют органические жидкости: этанол, ацетон, бензол и др. Важно то, что после смешивания жидкого растворителя и растворенного вещества в любом агрегатном состоянии, образующаяся гомогенная смесь (раствор) остается жидкой.
При смешивании жидких веществ и воды, растворителем, как правило, считают воду, даже если се количество в системе меньше, чем других жидких веществ. Например, при добавлении 70 г жидкой серной кислоты к 30 г воды образуется 70%-ный раствор 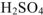 в воде. Если же смешиваются две неводные жидкости, то жидкость, взятая в большем количестве, считается растворителем.
в воде. Если же смешиваются две неводные жидкости, то жидкость, взятая в большем количестве, считается растворителем.
Растворы подразделяют на истинные и коллоидные. В истинном растворе дробление частиц растворенного вещества осуществляется до размеров молекул (молекулярнодисперсная система), которые невидимы ни визуально, ни с помощью микроскопа. В коллоидных растворах размер частиц растворенного вещества составляет примерно от 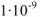 до
до 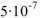 м (коллоидно-дисперсная система). Такие частицы можно обнаружить с помощью ультрамикроскопа.
м (коллоидно-дисперсная система). Такие частицы можно обнаружить с помощью ультрамикроскопа.
Способность вещества переходить в раствор называется растворимостью. Растворимость зависит от природы растворяемого вещества и растворителя, температуры и давления (для газов).
Растворимость веществ в воде обычно измеряют массой вещества (г), которая может максимально раствориться в 100 г воды при данной температуре. Визуальным показателем максимальной растворимости вещества является наличие осадка, над которым находится прозрачный раствор. Система, представляющая собой раствор над осадком, является устойчивой равновесной системой. Раствор, в котором данное вещество при данной температуре больше не растворяется, называется насыщенным. Растворимость вещества обозначается буквой s, верхним индексом указывается температура растворения.
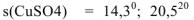 , что означает, что при температуре 0°С в 100 г
, что означает, что при температуре 0°С в 100 г 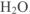 растворяется максимально 14,3 г
растворяется максимально 14,3 г 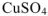 , а при температуре 20°С — 20,5 г
, а при температуре 20°С — 20,5 г 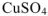 .
.
Если в 100 г воды при комнатной температуре растворяется более 1 г вещества, то такое вещество принято называть хорошо растворимым (Р), например, 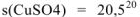 , если от 0,1 до 1 г — малорастворимым (М), s(CuSO4) = О.1620 , если менее 0,1 г — практически нерастворимым (Н), например,
, если от 0,1 до 1 г — малорастворимым (М), s(CuSO4) = О.1620 , если менее 0,1 г — практически нерастворимым (Н), например, 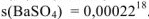
Растворимость большинства твердых и жидких веществ в воде с ростом температуры увеличивается. Так, для сульфата меди (II) при возрастании температуры от 0 до 25°С растворимость возрастает в 1,56 раза.
Понижение растворимости с ростом температуры наблюдается лишь для немногих веществ, например, сульфата натрия, гипса, гидроксида кальция (гашеная известь). Для 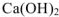 , например, с ростом температуры от 0 до 25°С растворимость уменьшается в 1,14 раза.
, например, с ростом температуры от 0 до 25°С растворимость уменьшается в 1,14 раза.
В отличие от большинства твердых веществ и жидкостей растворимость газов в жидкостях с повышением температуры уменьшается. Так, растворимость азота составляет 2,35  в 100 г
в 100 г  при температуре 0°С и 1,43
при температуре 0°С и 1,43 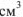 при температуре 25°С.
при температуре 25°С.
В некоторых случаях раствор может удерживать больше растворенного вещества, чем это продиктовано величиной растворимости. Такой раствор называется пересыщенным. Пересыщенные растворы представляют собой неустойчивые, неравновесные системы. При введении, например “затравки” — кристаллика твердого растворяемого вещества, избыточное количество этого вещества выпадает в осадок и образуется насыщенный раствор.
Ненасыщенным раствором называется такой раствор, в котором можно еще растворить добавочное количество растворяемого вещества, т.е. в таких растворах нет осадка.
Насыщенный и ненасыщенный растворы нельзя путать с разбавленным и концентрированным. Разбавленные растворы — растворы с небольшим содержанием растворенного вещества, концентрированные растворы — растворы с большим содержанием
растворенного вещества. Понятие разбавленный и концентрированный растворы являются нс количественными, а качественными понятиями, это относительные понятия, выражающие только соотношение количеств растворенного вещества и растворителя. Насыщенные растворы малорастворимых веществ являются разбавленными, а растворы хорошо растворимых веществ — даже ненасыщенные, являются довольно концентрированными.
Например, в 100 г воды максимально растворяется всего 0,97 г бромида свинца (II) при 25°С. Таким образом, насыщенный раствор
является разбавленным.
При растворении наблюдается взаимодействие частиц растворяемого вещества с растворителем, называемое сольватацией. Частный случай взаимодействия растворенного вещества с водой называется гидратацией. Процессы сольватации включают взаимодействие различной природы от слабых межмолекулярных ван-дер-ваальсовых сил и водородных связей до сильных координационных взаимодействий. Так, при растворении хлорида железа (III) в воде, образующийся при диссоциации ион 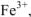 , образует прочную комплексную частицу
, образует прочную комплексную частицу 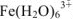 . При испарении воды из раствора выделяется не безводный
. При испарении воды из раствора выделяется не безводный 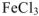 , а кристаллогидрат
, а кристаллогидрат 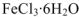 (аквакомплекс
(аквакомплекс 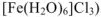 . Следствием химического взаимодействия между растворителем и растворяемым веществом является поглощение или выделение теплоты, наблюдаемое при растворении. Так. при растворении 1 моль
. Следствием химического взаимодействия между растворителем и растворяемым веществом является поглощение или выделение теплоты, наблюдаемое при растворении. Так. при растворении 1 моль 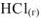 в воде выделяется тепловая энергия в количестве 75 кДж.
в воде выделяется тепловая энергия в количестве 75 кДж.
Состав растворов количественно характеризует следующими величинами:
Моляльность раствора (обозначение 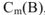 , единица измерения — моль/кг).
, единица измерения — моль/кг).
Выражается числом моль растворенного вещества в 1 кг растворителя (воды):
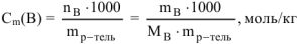
где 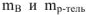 — масса растворенного вещества и растворителя, г;
— масса растворенного вещества и растворителя, г; 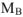 — молярная масса растворенного вещества, г/моль.
— молярная масса растворенного вещества, г/моль.
Например: Определить моляльность раствора, если в 200 г этого раствора, содержится 16 г 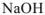 :
:
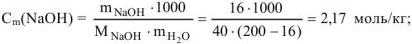
Массовая доля растворенного вещества (В) (обозначение 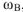 , единица измерения -доля от единицы или процент. % масс.). Определяется отношением массы растворенного вещества
, единица измерения -доля от единицы или процент. % масс.). Определяется отношением массы растворенного вещества 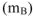 к массе раствора
к массе раствора 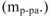

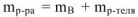
Масса раствора 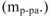 связана с объемом раствора
связана с объемом раствора 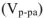 следующей формулой:
следующей формулой:
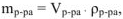
где 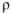 — плотность раствора, г/
— плотность раствора, г/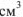 ,
, 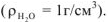
Эта теория взята со страницы помощи по химии:
Возможно эти страницы вам помогут:
