Оглавление:






Сравнение свойств водородных соединений неметаллов разных подгрупп
- Сравнение свойств водородных соединений неметаллов разных подгрупп При изучении химических свойств элементов IV-VII группы основной подгруппы я убедился, что водородные соединения неметаллов этих подгрупп в водных растворах обладают различными свойствами.
- Например, аммиак H3N, водородное соединение азота, имеет основные свойства в водных растворах. В то время как фтористый водород HF, водородное соединение элементов фтора, имеет кислотные свойства. Водородное соединение фосфора-фосфин РН3 обладает основными свойствами, хлороводородное соединение хлора-цианистый водород 1 в водном растворе является сильной кислотой.
Такая же закономерность наблюдается даже в неметаллах в 3-м триместре-фосфоре и хлоре: Людмила Фирмаль
Если проследить изменение свойств водородных соединений неметаллов в водных растворах в группе, то также наблюдается определенная закономерность observed. So например, фосфин PH3 является более слабым основанием по сравнению с аммиаком H3N. соляная кислота HCl в водном растворе образует более сильную кислоту, чем плавиковая кислота HF.
Из вышесказанного можно сделать следующие выводы. 1) повышает кислотные свойства неметаллических соединений водорода в водных растворах в период слева направо за счет увеличения заряда атомного ядра и уменьшения степени отрицательного окисления. 2)с увеличением атомного радиуса соответствующего аниона в верхней-нижней группе усиливаются кислотные свойства, ослабляются основные.
Каково объяснение этих закономерностей? При изучении теории электролитической диссоциации мы убедились, что кислоты — это электролиты, в водородных растворах они разделяют ионы водорода (протоны), а основания-это электролиты, которые объединяют ионы водорода. Исходя из этих представлений, нетрудно понять, почему водный раствор фтористого водорода HF является кислотой, а аммиачный раствор H3N-основанием.
Поскольку атом фтора имеет больший положительный заряд ядра, то есть+9 и кислород+ 8, атомы фтора отталкивают протоны сильнее. Происходит следующий процесс: Н И: b: n И: о:2Н + Н•••• Или стенография: Н20 ″ 2 + ВЧ-М30 ++ Ф» Из этого уравнения видно, что фтористый водород (HF) в водном растворе представляет собой расщепление протонов, т. е. acid. In этот процесс, другой фактор также играет важную роль. Атом кислорода имеет нерасширенную пару электронов, которые могут образовывать дополнительную ковалентную связь.
Далее рассмотрим процесс, который происходит, когда аммиак растворяется в воде. Атом кислорода имеет больший положительный ядерный заряд (+7), чем азот (+8).в результате атом кислорода отталкивает больше протонов, чем азот atom. In кроме того, атом азота имеет одинокую пару электронов.
Таким образом, протоны от молекул воды отделяются и переходят к молекулам аммиака. +: Ф: H: 0: I + H: N: H Н Ил в сокращенном виде: H2SG2 + H3N-3 Н Н: Н: Н: Н [О компании: и] НХ * + ООН Поэтому молекулы аммиака в водных растворах осаждаются протонами. То есть аммиак-это основа. Таким образом, усиление слева направо периода кислотных свойств соединений водорода в водных растворах объясняется увеличением заряда атомных ядер. В группе атомный радиус элемента увеличивается сверху вниз. bottom.
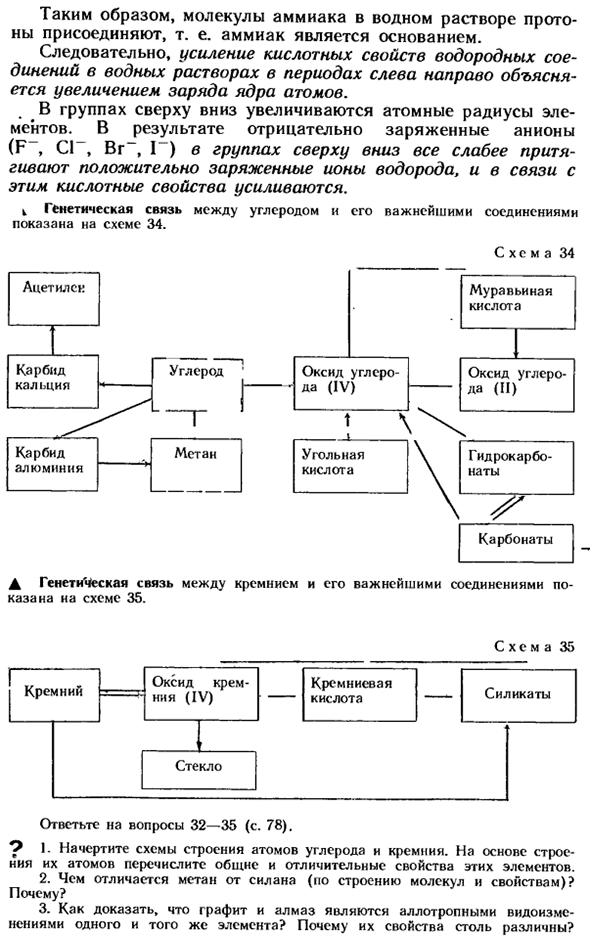
As в результате отрицательно заряженные отрицательные ионы верхней-нижней группы (F -, C1 -, B g»», I«) перестают притягивать все больше положительно заряженных ионов водорода, что в этом отношении усиливает кислотную природу. генетическая связь между углеродом w и его основными соединениями показана на схеме 34. Рисунок 34 Муравьиная кислота Ацетилен. Углерод окись углерода (IV)) Кальций Т-т-н-т Карбид железная угли Алюминиевая кислота Окись углерода Гидрокарбонат Карбонат Семь Генетическая связь между кремнием и его наиболее важными соединениями показана на схеме 35. Рисунок 35
Кремниевая кислота Силикатный Вопрос 32-35 (стр. 78). ^ 1.Нарисуйте схему строения атомов углерода и кремния. Исходя из строения их атомов, перечислим общие и характерные свойства этих элементов. 2.В чем разница между метаном и силаном (молекулярная структура и свойства).Почему? 3.Как я могу доказать, что графит и Алмаз являются аллотропными модификациями одного и того же элемента? Почему это свойство так отличается?
4.Какие процессы производят древесный уголь? Какова его структура, свойства и применение? 5.Как вы можете доказать, что хлеб, молоко и мясо содержат углерод? 6.Опишите химические свойства углерода и его применение. 7.Следующие оксиды используются для создания уравнений реакций, протекающих при нагревании угля. I) оксид железа (III). 2) оксид олова (IV).
Укажите переход электронов, подчеркните его 1 строкой с окислителем, 2 восстановителями. 8.Основываясь на свойствах углерода, рисунок 110 используется для описания применения углерода. 9.Процесс образования монооксида углерода (II) и молекул ионов аммония и гидроксо-Пи описан с электронной точки зрения. Что общего в этих процессах?
- 10.Как получить окись углерода (II) в лаборатории и в промышленности? Напишите уравнение соответствующей реакции. 11.Перечислите условия, при которых может образовываться окись углерода (II). 12.Используйте конкретные примеры для объяснения химической природы окиси углерода (II). 13.Какой газ является более ценным топливом: генератор или вода? Почему?
14.Создайте уравнения для реакций, которые способствуют производству окиси углерода (IV) в природе, в повседневной жизни, в лаборатории и в промышленности. 15.«Окись углерода (IV) может быть только окислителем и не может быть восстановителем. Объясните значение слова » что это такое?».Почему?
16.Горящие свечи (свет) исчезают как в атмосфере азота, так и в атмосфере окиси углерода (IV).Почему? Людмила Фирмаль
Как можно отличить эти газы друг от друга? 17.При пропускании монооксида углерода (IV)через раствор гидроксида кальция сначала образуется суспензия, а затем растворяется. Напишите уравнение соответствующей реакции. 18.Как сдвинуть обратимый процесс реакции: а) вправо и Б) влево: Колорадо,+ H205H, Ц0,+ м Почему эта реакция обратима?
19.To изучив химические свойства угольной кислоты, мы опустили олово с раствором монооксида углерода (IV), другой-магния, а третий-натрия-насыщенного 1.В каком случае вы могли бы доказать, что углекислота, хотя и инертная, все же реагирует с металлами? Почему? 20.Угольная кислота слабее азотной, но сильнее борной кислоты. Как это можно объяснить?
21.Почему бикарбонат натрия вместо карбоната натрия используется в огнетушителях? 22.Создайте уравнение реакции, соответствующее следующему рисунку. На С03 ^ НС, С03•10×20 Я NaHC03-Na2CO 23.Как получить свободный кремний в технологии или в лаборатории? Напишите уравнения этих реакций и проанализируйте их в электронном виде. 24.Каковы физические и химические свойства кремния?
Приведите уравнение соответствующей реакции. Описаны характеристики кремния, используемого в данной методике. 25.Каковы сходства и различия между высокоуглеродистым оксидом и кремнием? 26.Создайте уравнение реакции, характеризующее химические свойства оксида кремния (IV). 27.Как получить кремниевую кислоту из оксида кремния (IV)?Напишите уравнение реакции.
28.Какие соли являются более гидролитическими-силикатные или карбонатные? Почему? 29.Создайте уравнение реакции. Это сформирует а) обычное стекло. б)калиевое стекло; в) хрустальное стекло. 30.Объясните суть производства. б)бетон и железобетон. в) стекло. 31.Как изменяются свойства водородного соединения элемента от углерода к свинцу в основной подгруппе IV группы? Почему?
32.Основываясь на теории периодической системы и атомной структуры, она объясняет, как изменяются свойства неметаллических водородных соединений периодов и групп. 33.Почему фосфин по своим основным свойствам слабее аммиака? 34.Составьте сводку разделов по веществам, которым дана формула: СО, С02, na2c03, Nahcqt, sioa, h2si03, Na2si3 () 3 (для образцов, I, стр. 43).
35.Составьте уравнение реакции по схемам 34 и 35. Я думаю, что это хорошая вещь. Какое количество монооксида углерода (IV)выделяется при прокаливании известняка с массовой долей примесей 0,1 500 тонн? 2. Сколько кристаллической соды необходимо для нейтрализации 196 г серной кислоты? 3. Для полного расщепления 11,2 г карбоната натрия, сколько нужно 0,05 массовой доли, то есть раствора, содержащего 5% хлористого водорода.
4.Кристаллическую соду 135 г растворяют в воде 365 г. определяют массовую долю и процентное содержание безводной соли в полученном растворе. 5.Смесь, состоящая из карбоната натрия и бикарбоната натрия 146 г сильно прокалена. Масса остатка после выпечки составляет 137 г, что указывает на состав смеси по массовой доле. 6. Сколько сырья необходимо для производства 1 тонны стекла? Лабораторная работа Адсорбция угольного газа.
Налейте небольшое количество активированного угля в пробирку, содержащую оксид азота (IV), и энергично встряхните. Коричневый цвет газа постепенно исчезает. Сжигание угля в кислороде(I, с. 41). Восстановление металлов из оксидов путем coal. In в фарфоровой чашке готовят смесь, состоящую из 0,2 г угольного порошка и 2 г оксида меди (II).Вылейте полученную смесь в пробирку и закройте пробку вентиляционной трубой.
Поместите конец вентиляционной трубы в отдельную пробирку, содержащую свежеприготовленную известковую воду. Пробирки, содержащие смесь угольного порошка и оксида меди (II), очень горячие. Раствор известковой воды становится мутным. смесь in vitro постепенно становится желто-красной. Четыре Задача. 1.Как сделать уголь из дерева? 2.Почему коричневый цвет газа меняет цвет в присутствии активированного угля?
3.Почему при нагревании оксидов металлов с углем образуются свободные металлы? Напишите уравнение соответствующей реакции. Что окисляется и что восстанавливается в ходе этих реакций? Получение монооксида углерода (IV) и определение его свойств. 1.Подготовьте оборудование, как показано на рисунке 117.Положите несколько кусочков мела или мрамора в пробирку и добавьте небольшое количество разбавленной соляной кислоты. Происходит «кипение» — выделяется газ.
2.Быстро закройте трубку вентиляционной пробкой. Поместите конец трубки в другую пробирку, содержащую 2-3 мл известковой воды. Раствор мутный. 3.Продолжайте пропускать газ в течение нескольких минут-суспензия растворится. 4.Удалите края вентиляционной трубы из раствора и промойте ее дистиллированной водой. Затем поместите пробирку в отдельную пробирку с 2-3 мл дистиллированной воды и дайте газу пройти.
Через несколько минут выньте пробирку из раствора и добавьте несколько капель синего лакмусового раствора в полученный раствор-раствор станет розовым. 5. Налейте в пробирку 2-3 мл разбавленного раствора гидроксида натрия и добавьте в него несколько капель фенолфталеина. Затем пропускают газ через раствор-происходит отбеливание.
Задача. 1.Что происходит, когда соляная кислота наносится на мел или мрамор? 2.Почему при пропускании газа через раствор известковой воды он сначала мутнеет, а затем суспензия растворяется? 3.Что происходит, когда окись углерода (IV) проходит через дистиллированную воду? Опишите уравнения соответствующей реакции в виде молекул, ионов и сокращенных ионов. Распознавание карбонатов.
Положите мел в одну трубку и карбонат магния в другую трубку. Положите 1-2 мл разбавленной соляной кислоты в первую пробирку, и такое же количество разбавленной серной кислоты во 2-ю пробирку. Закройте обе трубки пробкой с вентиляционной трубой. Оба конца вентиляционной трубы помещают в трубку с известковой водой. Обе трубки закипят.
Газ высвобождается. От действия извести вода мутнеет. Кристаллическое вещество помещают в 4 пробирки: сульфат натрия, хлорид цинка, карбонат калия, силикат натрия. Проверьте, какие вещества содержатся в каждой пробирке. Задача. На основании проведенных экспериментов можно сделать вывод, что это характерная реакция на карбонат-ионы. При нагревании бикарбонат натрия разлагается.
1.Налейте в пробирку на 3 минуты 1 часть количества бикарбоната натрия. Закрепите пробирку на наклонной треноге так, чтобы выделившаяся вода не попадала в горячую секцию и содержимое было очень горячим. Газ высвобождается. 2.Полученный газ пропускают через раствор известковой воды. Известковая вода становится мутной.
Задача. 1.Что происходит, когда карбонат действует с кислотой? 2.Какие вещества образуются при нагревании бикарбоната натрия? 3.Что такое мутность известковой воды? Опишите уравнения соответствующей реакции в виде молекул, ионов и сокращенных ионов. Основываясь на этих формулах, мы опишем, как определить карбонат-Ион. Карбонатно-силикатный тестовый раствор с индикатором.
Растворите небольшое количество карбоната натрия в 1 пробирке с 2-3 мл дистиллированной воды и растворите силикат натрия в другой пробирке. Бросьте красную лакмусовую бумажку в обе пробирки. Они окрашены в синий цвет. Задача. Почему лакмусовая бумажка синеет? Напишите уравнение соответствующей реакции. Получить кремниевую кислоту. 1.In концентрированный раствор силиката натрия 2-5 мл, разбавленный соляной кислотой 2-2.
Добавляют 5 мл (1: 1).Появляется студенистый осадок. 2,2-3 мл концентрированного раствора силиката натрия заливают в пробирку, пропуская окись углерода (IV).Выпадает студенистый осадок. Задача. 1.Что же это за вещество — образование студенистого осадка, возникающего из опыта? Опишите уравнения соответствующей реакции в виде молекул, ионов и сокращенных ионов. 2. Какая кислота сильнее, чем H2Si03 или H2C03? Рисунок 117.Получение монооксида углерода (IV).
Смотрите также:
