Оглавление:
Суммирование погрешностей
В химических методах количественного химического анализа -гравиметрии и тириметрии в расчетах используют в основном суммы, разности, произведения и частные измеренных величин, определение каждой из которых содержит свою погрешность. Возникает задача вычисления суммарной погрешности, решение которой зависит от вида погрешностей и выполняемых арифметических действий с полученными значениями. В данном пособии рассмотрим суммирование погрешностей только для перечисленных арифметических действий. Правила суммирования представлены в табл. 9.1.
Таблица 9.1
Правила суммирования погрешностей
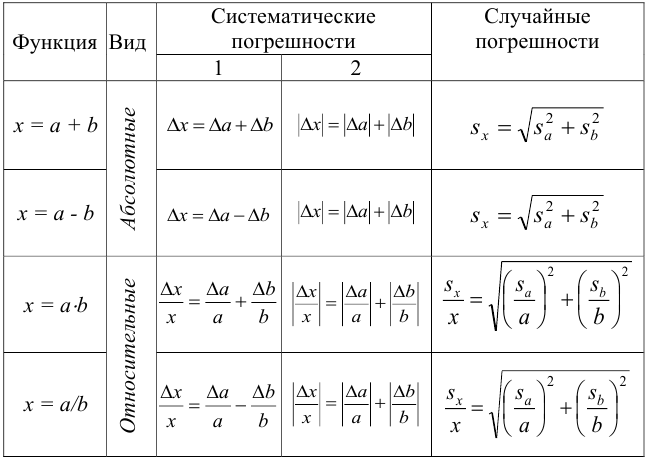
Примечание: суммарную систематическую погрешность рассчитывают по формулам столбца 1, если известны и величина, и знаки отдельных составляющих; если знаки неизвестны, расчет проводят по формулам столбца 2. Определив абсолютную погрешность, можно рассчитать относительную и наоборот.
Пример 9.8.
Вычислите абсолютную и относительную систематические погрешности взвешивания гравиметрической формы 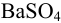 , если масса тигля с прокаленным осадком
, если масса тигля с прокаленным осадком 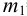 =12,3383 г, а пустого тигля
=12,3383 г, а пустого тигля 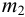 = 12,0112 г. Соответствующие систематические погрешности взвешивания с использованием аналитических разновесов составили
= 12,0112 г. Соответствующие систематические погрешности взвешивания с использованием аналитических разновесов составили 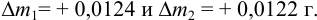
Решение:
Массу гравиметрической формы вычисляем по разности взвешиваний:
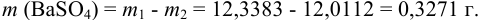
Используя правило сложения систематических погрешностей для разности при известном знаке составляющих (колонка 1 табл. 9.1), получаем:
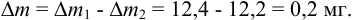
Следует обратить внимание на то, что при использовании одних и тех же гирь при взвешивании тигля с осадком и без него систематическая погрешность уменьшается.
Найдем относительную погрешность определения массы гравиметрической формы:
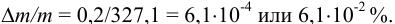
Пример 9.9.
Рассчитайте систематическую погрешность (абсолютную и относительную) концентрации 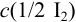 при приготовлении 250,0 мл раствора иода из навески /и 1,2634 г. Систематическая погрешность массы навески +0,4 мг, измерения объема мерной колбой -0,2 мл.
при приготовлении 250,0 мл раствора иода из навески /и 1,2634 г. Систематическая погрешность массы навески +0,4 мг, измерения объема мерной колбой -0,2 мл.
Решение:
Концентрацию раствора рассчитываем по формуле:
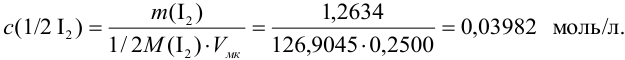
В соответствии с законом распространения систематических погрешностей относительная погрешность частного при известных знаках определяется равна разности относительных погрешностей делимого и делителя, а произведения — сумме (табл. 9.1, колонка 1):
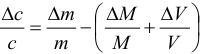
Поскольку погрешность определения молярной массы мала по сравнению с другими погрешностями, ее вкладом пренебрегаем. Найдем относительную погрешность величины концентрации:
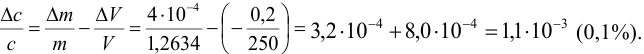
Абсолютная погрешность концентрации составляет:
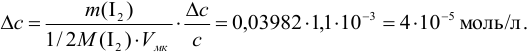
Пример 9.10.
Рассчитайте максимально допустимое относительное стандартное отклонение при определении массовой доли серы в пересчете на 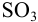 весовым методом, если методика предполагает: из навески пробы около 1 г после разложения и окисления серы до
весовым методом, если методика предполагает: из навески пробы около 1 г после разложения и окисления серы до 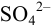 остаток перевести в мерную колбу вместимостью 100 мл, осаждение провести из аликвоты 20 мл и получить массу гравиметрической формы 0,4 г (см. гл. 7). Использована посуда второго класса (табл. 11 приложения).
остаток перевести в мерную колбу вместимостью 100 мл, осаждение провести из аликвоты 20 мл и получить массу гравиметрической формы 0,4 г (см. гл. 7). Использована посуда второго класса (табл. 11 приложения).
Решение:
При осаждении 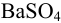 из аликвоты результаты весового анализа могут быть рассчитаны по формуле:
из аликвоты результаты весового анализа могут быть рассчитаны по формуле:
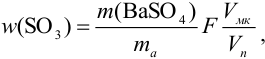
где 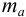 — масса пробы,
— масса пробы, 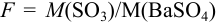 — гравиметрический фактор.
— гравиметрический фактор.
С учетом правила суммирования случайных погрешностей для произведения и частного (табл. 9.1) относительное стандартное отклонение результата можно выразить формулой:
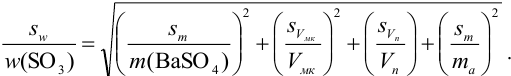
При этом пренебрегаем погрешностью гравиметрического фактора 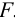
Масса гравиметрической формы 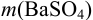 получается как разность двух взвешиваний на аналитических весах:
получается как разность двух взвешиваний на аналитических весах:
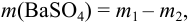
где 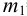 — суммарная масса тигля и
— суммарная масса тигля и 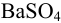 ;
; 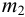 — масса пустого тигля.
— масса пустого тигля.
Аналогично берут навеску пробы. Погрешность взвешивания примерно одинакова в обоих случаях: 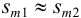 . Вычислим абсолютную случайную погрешность определения массы
. Вычислим абсолютную случайную погрешность определения массы  как погрешность разности:
как погрешность разности:
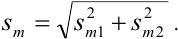
При взвешивании тигля до постоянной массы погрешность взвешивания составляет 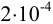 г. Тогда абсолютная погрешность определения массы:
г. Тогда абсолютная погрешность определения массы:
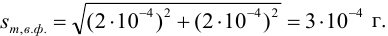
Абсолютная погрешность взятия навески иода на аналитических весах:
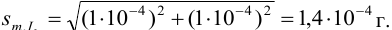
Из табл. 11 приложения берем соответствующие допуски мерной посуды и подставляя в формулу (9,6) вычисляем максимально возможное относительное стандартное отклонение результата:
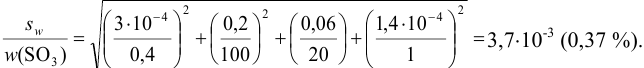
Пример 9.11.
Рассчитайте максимальную допустимую погрешность (абсолютную и относительную) концентрации 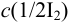 при приготовлении 250 мл раствора иода из навески
при приготовлении 250 мл раствора иода из навески 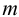 1,2634 г.
1,2634 г.
Решение:
Вычисление проводим с учетом примера 9.9, где найдена концентрация 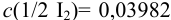 моль/л, используя формулу, подобную (9.6) и рассуждения примера 9.10. Основной вклад в суммарную погрешность концентрации иода вносят погрешность измерения объема и массы:
моль/л, используя формулу, подобную (9.6) и рассуждения примера 9.10. Основной вклад в суммарную погрешность концентрации иода вносят погрешность измерения объема и массы:

Очевидно, что измерение объема вносит больший вклад в погрешность. Вычислим максимально допустимую абсолютную погрешность:
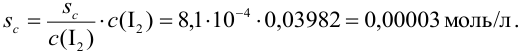
Пример 9.12.
Определите относительную и абсолютную погрешность концентрации раствора тиосульфата, если она устанавливалась по раствору иода, приготовленному как в примере 9.11, по результатам одного титрования аликвоты иода тиосульфатом (расход тиосульфата 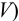 и трех параллельных титрований. Соответствующие данные (с указанием в скобках стандартных отклонений):
и трех параллельных титрований. Соответствующие данные (с указанием в скобках стандартных отклонений):

Решение:
Концентрацию тиосульфата вычисляем по формуле (гл. 8):
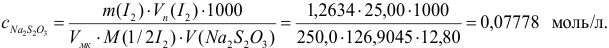
Расчет относительной погрешности проводим с учетом вклада всех измеряемых составляющих, упуская малую погрешность молярной массы:

Из расчета следует, что наибольший вклад в погрешность вносит объем титранта, и с его увеличением погрешность уменьшается. Если титрование повторять 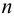 раз с повой аликвотой относительная погрешность концентрации уменьшится в
раз с повой аликвотой относительная погрешность концентрации уменьшится в 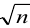 раз, т. е. при трех параллельных титрованиях:
раз, т. е. при трех параллельных титрованиях:
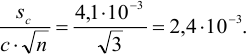
Абсолютная случайная погрешность определения концентрации 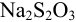 при однократном титровании:
при однократном титровании:
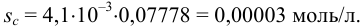
Пример 9.13.
Проведите расчет погрешности результата анализа образца на содержание 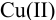 , проведенного йодометрическим титрованием по заместителю согласно реакциям:
, проведенного йодометрическим титрованием по заместителю согласно реакциям:
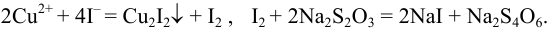
Навеску образца 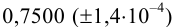 г перевели в мерную колбу вместимостью 200,0 (±0,2/3) мл. На титрование брали три аликвоты по 20,00 (±0,06/3) мл, расход тиосульфата с концентрацией 0,07778
г перевели в мерную колбу вместимостью 200,0 (±0,2/3) мл. На титрование брали три аликвоты по 20,00 (±0,06/3) мл, расход тиосульфата с концентрацией 0,07778 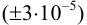 моль/л составил: 10,00; 10,05; 10,07; 10,03 (
моль/л составил: 10,00; 10,05; 10,07; 10,03 (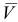 =10,04) мл.
=10,04) мл.
Решение:
Рассчитаем стандартное отклонение объема тиосульфата:
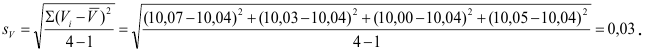
Массовую долю меди вычислим по формуле:
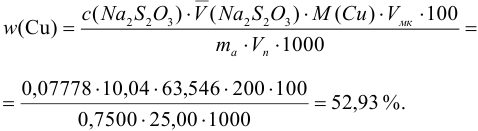
С учетом погрешностей входящих в формулу величин рассчитаем относительную погрешность содержания меди:
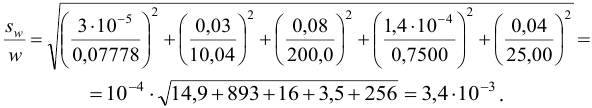
Абсолютная погрешность: 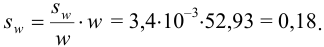
Тогда можно представить результат определения массовой доли меди как 53,27±0,18 (%).
Эти примеры взяты со страницы примеров решения задач по аналитической химии:
Решение задач по аналитической химии
Возможны вам будут полезны эти страницы:
