Оглавление:






Теория вязкости разреженных газов
- Вязкость разреженных газов широко изучалась как экспериментально, так и теоретически. Простейший механизм передачи импульса, основанный на молекулярной кинетике, позволяет вывести теоретические формулы для расчета динамической вязкости. Учитывая чистый газ, состоящий из сферических молекул, которые не взаимодействуют с твердыми телами диаметром A и массой m, можно получить следующее уравнение, в котором концентрация N молекул на единицу объема* (1.18). Где и-средняя скорость хаотического движения молекулы, а X-средняя длина свободного пробега молекулы. Эта формула была оценена Максвеллом в 1860 году.
Используя соответствующую формулу для вычисления d, A и соотношения (1.18), можно легко вывести уравнение, определяющее динамическую вязкость газа, состоящего из твердых тел с низкой плотностью (1.19) обратите внимание, что вам нужно 1 экспериментальное значение q для вычисления значения q. Как только это значение определено, вы можете найти q при других условиях. Вышеизложенное свидетельствует о качественно правильной ситуации локомоционного движения в Газе низкой плотности.
В этих веществах нельзя не учитывать молекулярный обмен количеством движения и тепла в турбулентной зоне, как мы это сделали в предыдущих расчетах. Людмила Фирмаль
Вывод, следующий из Формулы 1.19, что р не зависит от давления, хорошо согласуется с экспериментальными результатами вплоть до давления 10 атмосфер(рис.1-3 и 1-4).Однако оказалось, что температурная зависимость динамической вязкости, основанная на разработанной выше теории, не является удовлетворительной. Экспериментальные данные, полученные на различных газах, показывают, что температурная зависимость p сильнее, чем T ’-’, и не может быть точно выражена какой-либо функцией T. Более жесткий. А. А. теории упражнения> Grafcho Кеннард [23].Заметим, что выражение| A = 1 / 2pX. — Отмечать. Эд. (Рис. 1-3).
Для точного прогнозирования температурной зависимости необходимо заменить модель жесткой сферы более реалистичной моделью молекулярной силы Joules. In кроме того, необходимо тщательно изучить характер отклонения системы от равновесного состояния. Ниже приводятся результаты детального теоретического анализа в обеих этих областях*. Строгая кинетическая теория одноатомного газа низкой плотности была разработана британцем Чепменом незадолго до Первой мировой войны, независимо разработанная энскогом в Швеции.** В теории Чепмена-Энскога коэффициент переноса выражается через потенциальную энергию взаимодействия между молекулярными парами в Газе.
Эта потенциальная энергия связана с силой взаимодействия T отношением P = — f / yr. Где r-расстояние между молекулами. Поэтому, если мы знаем, как силы взаимодействия между молекулами изменяются в зависимости от расстояний между молекулами, мы можем подставить это соотношение в уравнение Чепмена-энсекога для вычисления коэффициента переноса. точная функциональная зависимость f (g) неизвестна. Однако многочисленные исследования показали, что с достаточной точностью это соотношение может быть выражено эмпирической формулой потенциальной энергии, называемой 6-12 потенциалами Леонарда Джонса.
Где а-характерный диаметр молекулы* * * (диаметр эффективной площади поперечного сечения столкновения), е-характерная энергия взаимодействия между молекулами (максимальная энергия притяжения между парами молекул). Эта особенность проиллюстрирована на рисунке. 1-5.Отметим характерные свойства межмолекулярного взаимодействия, то есть слабое притяжение на больших расстояниях между молекулами (почти пропорционально⁻⁶) и сильное отталкивание на малых расстояниях (почти пропорционально −1). Уравнение (1.20) оказалось очень полезным для описания поведения большого числа неполярных молекул. Значения параметров а и Е известны для многих веществ и частично указаны в таблице.
- B-1 (приложение, стр. 675); более подробное изложение этих параметров можно найти в других источниках [24]. Значение Свойства вещества в неизвестной критической точке («cr»), свойства соответствующей жидкости при нормальной температуре кипения («тюк») или твердой фазы при температуре плавления («pl») могут быть оценены на основе следующих эмпирических соотношений: 124, 251: Давай посмотрим. — в; Динамическая вязкость Одноатомные Газы с молекулярной массой M при температуре T могут быть представлены в виде функции параметров a и b типов. г = * .- да. Отто Жанье Очарование К В формуле p представлено g-cm_1-1-s-1.
В Т-К; А-В А. значение u является медленно меняющейся функцией безразмерной температуры kT / b, и значение этой функции показано в таблице. B-2 (стр. Последняя формула была выведена для одноатомных газов, но мы обнаружили, что она вполне пригодна для расчета коэффициента динамической вязкости многоатомных газов. Температурная зависимость Р, предсказанная теорией, хорошо согласуется с соответствующей зависимостью, показанной на рис. 2.1-3 в виде границы разреженного газа. Напомним еще раз, что вязкость благородных газов увеличивается с температурой пропорционально T, от 0,6 до 1 degree. It следует также отметить, что вязкость благородных газов не зависит от давления.
Выводы этого раздела необходимо распространить на вещества с низкими значениями критерия Прандтля, например на расплавленные металлы. Людмила Фирмаль
Если газ состоит из твердой сферы диаметром а (вместо реальной молекулы со свойствами притяжения и силы)、 Функция ц принимает значение, равное 1.Таким образом, функцию yts можно интерпретировать как величину, характеризующую отклонение свойств молекул от свойств твердых сфер. Теория Чепмена-Энскова была распространена на случай многокомпонентных разреженных газовых смесей в исследованиях Кертиса и Хиршфельдера[27].Однако в большинстве случаев результатом является полувоенная формула Уилки[28, 291: Давай посмотрим. — Количество компонентов смеси;, компонент I и]•, ts, ts, — динамическая вязкость компонента g и]при заданных температуре и давлении. L/, M / — соответствующая молекулярная масса.
Параметр ф,>безразмерен; и Ф₁₇ = 1, если/. Установлено, что значение ПКМ, рассчитанное по формуле (1.29), представляет собой отклонение в пределах 2% от среднего значения от измеренного значения. Зависимость СКК от состава существенно отличается от линейной в некоторых смесях, особенно смесях легких и тяжелых газов. Резюмируя вышесказанное, подчеркну, что уравнение (1.28)-(1.30) может быть использовано для расчета коэффициента динамической вязкости разбавленного неполярного газа. —— Назовите смесь исходя из значения пня в таблице.
Однако эти мулы не могут быть надежно применены к газам, состоящим из полярных или сильно вытянутых молекул, из-за выраженных силовых полей, которые существуют между этими молекулами. При расчете вязкости паров полярных молекул, таких как Нмолекул0.1чна, Сн₃он, N001, наилучший результат[ 30] получается при соответствующей модификации формулы (1.20).Из того факта, что эти формулы необходимо корректировать в диапазоне температур менее 100 К для учета квантово-механических эффектов, обычно следуют дополнительные ограничения[24]. Для газов тяжелее H И He влияние квантово-механических эффектов на вязкость можно игнорировать вплоть до еще более низких температур.
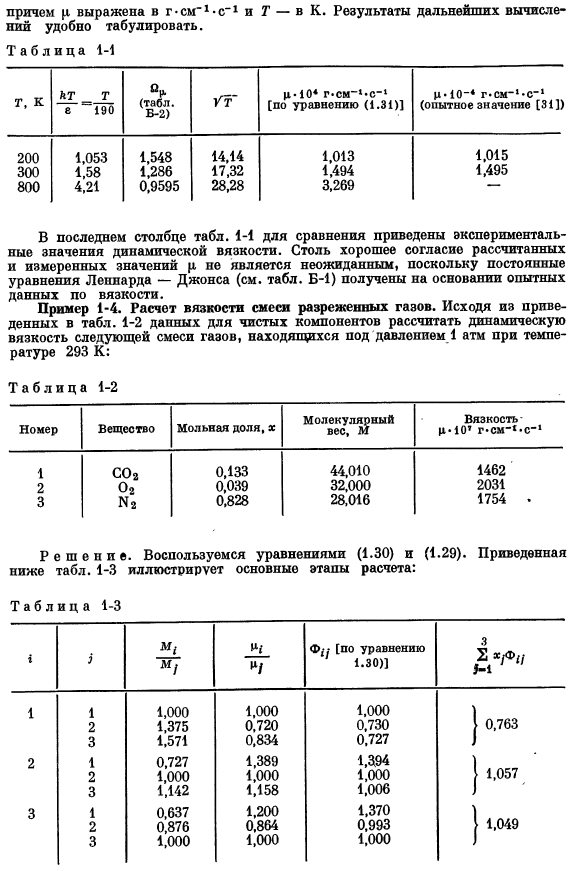
Пример 1-3.Расчет вязкости разреженного газа. Рассчитайте вязкость со при температуре 200, 300, 800 К и давлении 1 атм. Решение: используйте формулу (1.28).Значение константы в уравненииV равно д—?? Not on-CO (см. таблицу B-1, стр. 675): e / 4 = — 1EEE to; o = 3,996 A. молекулярная масса CO составляет 44,010.Если присвоить найденные значения M и a выражению (1.28), то получится: 1 «= 2, e (1-31) Кроме того,| l представлен g-cm, что означает » это удобно для таблицы.
Смотрите также:
| Неньютоновские жидкости | Теория вязкости жидкостей |
| Зависимость вязкости от давления и температуры | Баланс количества движения в тонком слое. Граничные условия |
