Оглавление:






Тепловая функция. Эффект Джоуля Томсона.
- Тепловая функция. эффект Джоуля— Томсон. Как известно, внутренняя энергия идеальна* Кинетический газ Кинетическая энергия молекулы Температура газа. Зависимость внутренней энергии реального газа Объем и давление испытаны в джоулях Опыт. 2 контейнера были взяты и соединены трубкой С помощью крана.1 в баллоне было давление газа
А в другом-образовался вакуум. Когда открыть кран Воздух необратимо расширяется в пустой контейнер、 Он имеет внешнюю работу. Оба корабля Калориметр, причем без последующих изменений температуры Открытия крана не было noticed. In это уважение、 Однако изменение температуры газа при этом Эксперимент определялся изменением температуры калорий Калориметр.
Сделан вывод, что внутренняя энергия газа независима По объему. Людмила Фирмаль
Поэтому точность этого измерения была очень высокой Низкий. Затем этот эксперимент повторили Жюль и Томсо. Г-н и привел к внутреннему учреждению Энергия от объема. В новом эксперименте, соединительная трубка Я положил пробку из пористого материала в контейнер (Шерсть), разница в температуры газа
Через 2 чувствительные термометры развернуть С обеих сторон пробки. Газ, протекающий по трубе Перепад давления на месте установки Пробка. Процесс подачи газа все еще был несовместим. Необратимый. При измерении температуры с обеих сторон Была обнаружена небольшая разница в температуре Температура. Для большинства газов температура равна Сторона пробки с низким давлением、 Ниже. Для водорода, изменение температуры Оказывается, все наоборот.
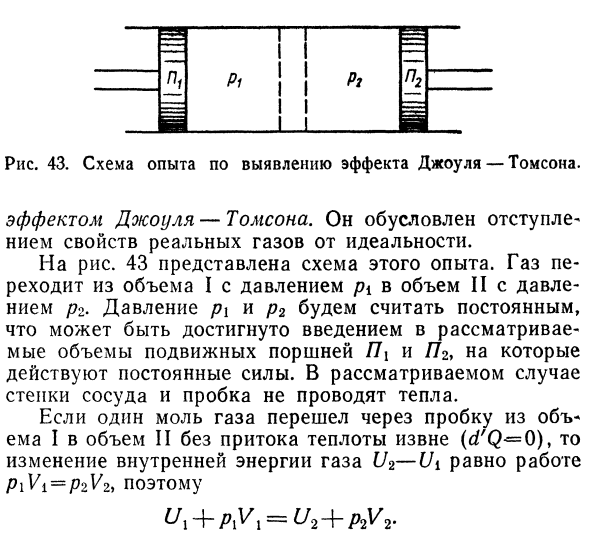
- Влияние этого изменения Изменение температуры газа при расширении, называемое 167. Пирог. Рисунок 43.An экспериментальная схема для выявления эффекта Джоуля-Томсона. Эффект довуля-Томпсона. И отступает. Реальные свойства газа отступают от идеальных. На рисунке 43 показана схема этого опыта. ГАС. Перемещается из объема I давления pi в объем II с давлением Давление/?2.Давления P1 и P2 считаются постоянными、
Чего можно добиться, введя Считается объем подвижной поршневой ПКС и Н2 Действует постоянная сила. 1 когда крот газ проходит через пробку Из Тома I в том II без притока тепла извне(aHB — = O) Изменение внутренней энергии газа U2-Ui равно работе V V2, следовательно Каждая часть равенства-это ТЭП *
Если на стадии рассмотрения Стенка сосуда и пробка не проводят тепло. Людмила Фирмаль
Рыболовная функция, поэтому рассматривается Поток газа происходит при постоянной энтальпии/. Разница в энтальпии G, 17) замените dS выражением для тире переменной Мы получаем: В этом случае, если мы считаем, что это d / = 0、 Нажмите, чтобы изменить и изменить температуру газа Надавите на следующую формулу: dt Сто шестьдесят восемь Где знак / производной указывает на ее значение*
Ная фотографируется с постоянной энтальпией. Из определения Энтропия и теплоемкость при минимальном давлении* (\ДС СР ый Взорвите этот rjfl—затем замените — \ Д)т ДТ) Р * Получите окончательное выражение.т. (Еккл- \ ДПЯ- Производная (- ДТГ) — это、 Когда давление изменяется на 1, температура газа изменяется * Приятно и определяет дифференциальный эффект
Джо Джулс Томсон. Теплоемкость в нашем случае всегда есть Меньше нуля, отсюда и признаки изменения температуры ПРВ * Противоположная сторона знака молекулы. Зная уравнение Вы можете определить состояние газа, масштаб и признаки добычи И(dT \ Для идеального газа используют уравнение состояния Состояние а, 6), находим: \ ДТ) р-р ’ Так… ван дер Ва — * для газов по уравнению Alsa A2, 2), найти выражение — ^ —
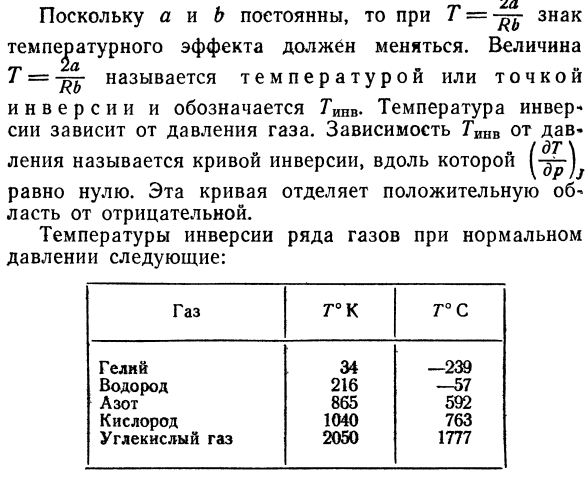
константа Давление от формулы: (\ГУ Р » ДТ Оя Т * «Λ\ ^ /’ Γ » I * \ / л, тгл 〜в〜= — б) д — [(В-С ~~ Т?\ дв = = = 0- Предположим, вы используете V ^ b, RTV ^> a, простое преобразование* Развития мы получаем: 2а б 9,= СП » Г> 72) Сто шестьдесят девять поскольку a и b являются константами, T = Влияние температуры меняется. Значение T = — температура или точка называется Перевернутый и обозначенный тиявом.
Преобразователи температуры Инверсия зависит от давления газа. опора гинв на Дэва — 。 (Второзаконие \ Прямая линия называется кривой инверсии, вдоль которой проходит 1-xy) Равный нулю. Эта кривая является положительной Площадь от негатива. Температура инверсии нормального газа Давление: ГАС.
Гелий Водород Азот Кислород Диоксид углерода T°K Тридцать четыре 216. Восемьсот шестьдесят пять 1040. Две тысячи пятьдесят T°C 239. −57. Пятьсот девяносто два Семьсот шестьдесят три Одна тысяча семьсот семьдесят семь Температура инверсии гелия и водорода значительно Так как она ниже комнатной температуры, необходимо наблюдать за этими газами Температура растет.
Температурная инверсия Другие газы над комнатной температурой, и нормальный Условия должны наблюдать снижение температуры. Это свойства азота, кислорода и углекислого газа. Использовано в холодильной технике для получения низких Так называемая Линда машина низкой температуры, где В результате многократного расширения газа при его температуре Температура будет drop. In в этом случае Интеграл Джулз Томсон: Rx
Смотрите также:
Решение задач по термодинамике
| Свободная энергия и максимальная работа. | Сопло Лаваля. |
| Свободная энергия равновесных систем. | Учение о термодинамическом равновесии в сложных системах. |
