





- В качестве реального газа будем рассматривать водяной пар. Водяной пар широко используется во многих областях техники, в частности в энергосистемах, которые являются основными рабочими fluid. By Процесс газификации. Основные понятия и определения. Рассмотрим процесс генерации пара. Для этого используют 1 кг в цилиндре с подвижным поршнем. Сила P для применения. Затем в поршневой области Р давление остается постоянным и равно р-р / п. нарисуйте технологическую о-диаграмму(рис.4.6). Р это’о’ Начальное состояние воды определяют по температуре DN°DN, DN — = 4 ″ С.
И он начинает увеличиваться, но при нагревании в определенном диапазоне температур в его составе практически нет жидкости possession. In у большинства жидкостей удельный объем монотонно увеличивается при нагревании. Жидкое состояние. Когда точка кипения достигнута, она обозначается точкой a *на диаграмме. И когда вы нагреваетесь Очень маленький объем. Цилиндр содержит двухфазную среду-смесь воды и пара, которую называют влажным насыщенным паром. При подаче тепла количество жидкой фазы уменьшается, а газовой фазы увеличивается. Все тепло расходуется на испарение жидкой фазы, так что температура смеси не меняется и остается постоянным.
Поэтому процесс испарения на этой стадии является изобарно-изотермическим. Наконец, последняя капля воды превращается в пар, и цилиндр наполняется только паром, который называют сухо-насыщенным. Его состояние изображено точно Насыщение называется паром. Тепловое и динамическое равновесие с жидкостью, из которой она образуется. Динамическое равновесие заключается в том, что число молекул, вылетающих из воды в паровое пространство, равно числу молекул, конденсирующихся на его поверхности. surface. In в паровом пространстве этого равновесного состояния возможно максимальное количество молекул при определенном temperature.
С повышением температуры увеличивается количество молекул, обладающих достаточной энергией для выхода в паровое пространство. Давление пара увеличивается равномерно, а плотность увеличивается, что приводит к увеличению числа молекул, которые конденсируются на поверхности в единицу времени. Вода. Таким образом, давление насыщенного пара является монотонно возрастающей функцией его температуры go и остается неизменным. Температура насыщенного пара является монотонной функцией его давления.
Когда объем на поверхности жидкости с насыщенной температурой увеличивается, определенное количество жидкости поступает в пар, а когда объем уменьшается,»лишний» пар снова поступает в жидкость, но в обоих случаях давление пара остается постоянным. Насыщенный пар, в котором нет взвешенных частиц в жидкой фазе, называется сухим насыщенным паром. Его удельный объем и температура зависят от давления. Таким образом, состояние сухого пара может быть установлено с помощью таких параметров, как давление, удельный объем и температура. Двухфазная смесь, пар, в котором взвешены капли жидкости, называется влажным насыщенным паром.
Массовая доля сухого насыщенного пара во влажном состоянии называется степенью сушки пара k, которая выражается буквой x. массовая доля кипящей воды во влажном паре, humidity. In в случае кипящей жидкости x = 0, а сухого насыщенного пара x-I, состояние влажного пара определяется давлением (или температурой насыщения).Это определение давления) и следующие 2 параметра. Когда сухое тепло передается сухому пару под тем же давлением, его температура повышается и пар перегревается. Точка а представляет собой состояние перегретого пара, которое, в зависимости от температуры пара, может находиться на различном расстоянии от точки А.«пар называется перегревом.
Его температура превышает температуру насыщенного пара такого же давления. Поскольку удельный объем перегретого пара при одном и том же давлении больше насыщения, то число молекул, входящих в единицу объема перегретого пара, меньше. То есть, плотность будет ниже. Перегрев Давление газа, определяющее абсолютное давление этого пара p0 = 611 па, обозначено на рисунке 2 независимыми параметрами-Изобарой D’4, которая практически совпадает с абсциссой в метрах.
Учитывая процесс испарения, когда давление пара ниже, он образуется при более высоком давлении и может сосуществовать только в равновесии с последующим изменением за счет льда. Процесс формирования пары Иэпо-точка oo. In реакция на состояние, вызванное льдом, называется новым давлением, 0°С под национальным s U l-1 кг воды. Если соединить одно и то же название с водой, то можно практически не сжимать, потому что она останется почти такой же вертикальной.
Если точка представляет собой плавную кривую, то при увеличении нулевой изотермы / звук под ней увеличивается, так как каждая точка давления увеличивается, температура которой соответствует состоянию 1 кг золы, а температура при 0°С и давлении Р соответствует поднимающейся жидкости. Для граничной кривой II, предварительно испаренной (точка а»), удельный удельный объем жидкости со скоростью объем пара уменьшается из-за высокого кипения, хотя зависимость давления от температуры кипения увеличилась.
Эффект запрограммированного верхнего предела обусловлен увеличением давления по кривой III, определенному объему жидкости дающей зависимость, плотность определенного объема сухого насоса увеличивается, и давление становится постоянным, если пар постоянен, потому что пара уменьшается. Увеличение давления достигает t — все горизонтальные точки между кривой определенного объема II и III равны точкам, соответствующим состоянию жидкости и пара. Эта точка влажного насыщенного пара относится к garlic. In критическое II, состояние точки кипения разности между водой и жидкостью определяется, а состояние кривой III точки-su и пара исчезают. Для воды, параметр высокотемпературный насыщенный пар.
Левая сторона кривой в критической точке K равна p, n = II, а площадь= 221,29-10 до тех пор, пока изотермы не будут равны нулю. Pa; / «N = 374,15°C; o »» =однофазная жидкость без утечки, вперед= 0,00326 ма / кг. * ■ От кривой III-перегретая область Критическая температура-Мак. Таким образом, кривая I и III, которая является наиболее вероятной температурой, коррелирует с областью насыщенного пара, отсутствием 2 фаз, жидкости, воды и перегретого насыщенного пара, выделяя его из области насыщенного пара. vapor. At а температура пара, так называемая р-а-большая, важна, а в некоторых случаях сверх-и важна.
Над точкой K, где Возникновение этой фазы (пар не допускается в жидком или перегретом однофазном состоянии) проводит четкую границу между жидкостями условно до некоторой степени и обычно определяется ее температурой, температурой и температурой пара. Все газы сильно перегреваются, а определение параметров воды и па-над осуществляется попарно. Чем выше температура РА. Благодаря этому вода и сухой насыщенный пар близки к идеальным характеристикам из таблицы тепловых газов. Вода и водяной пар characteristics.
- Самое низкое давление, при котором термодинамические величины все еще возможны, — это равновесие воды, а линия поглаживания относится к воде, нагретой паром шейки матки, давление, соответствующее температуре кипения, а величина-тройная точка. По 2 штрихам (от насыщения до насыщения) последний штрих понимается как единственная пара. Состояние, в котором они могут находиться одновременно-пар находится в равновесии в изобарном процессе, поэтому, согласно (2.29), лед подается в воду (точка а ’на рис.4.6).Параметр жидкости-тепло (y = ya-A), это тройная точка воды. РО= 611 па; свою очередь это соотношение в процессе! а«, / о = 0,01°с; Ко = 0. 00100м3 / кг.
Процесс АБ -Аристотель?= R = A «- испарение, которое происходит в случае A’.(4.28) Параметры, после этого, согласно известным давлению или температуре, значения приняты от таблицы водяного пара Удельный объем, энтропия и энтальпия H 3х, и насыщенного насыщенного пара определяется законом добавка. Потому что 1 кг влажного пара содержит х кг сухого пара и (1-х) кг кипятка С.= Хо +(1-х). ’+ ’ (». -И- Аналогично (4.29) г- + х(з «- з’) — з’ + * г / Я.: (4.30) ЧХ(Л » + ртуть.(4.31) Невозможно получить параметры влажного пара непосредственно из таблицы. Они определяются по приведенной выше формуле в зависимости от заданного давления (или температуры) и степени сухости.
Однофазное состояние некипящей воды и перегретого пара задается двумя параметрами. Из давления и температуры, приведенных из таблицы воды и перегретого пара, значение g ’ T, z схема различных процессов исследования воды с использованием пара, кроме таблицы используется рисунок (рисунок 4.7). он строится путем переноса числовых данных таблицы пара в координаты G, z. Состояние воды в Тройной точке (zo-O; Go 273.16 K) обозначается точкой A ’ на рисунке. Отложите в сторону до рисунка разных температур * ч водяного пара ■ Пара.■ — — — — — Для Симидзу. Слева.
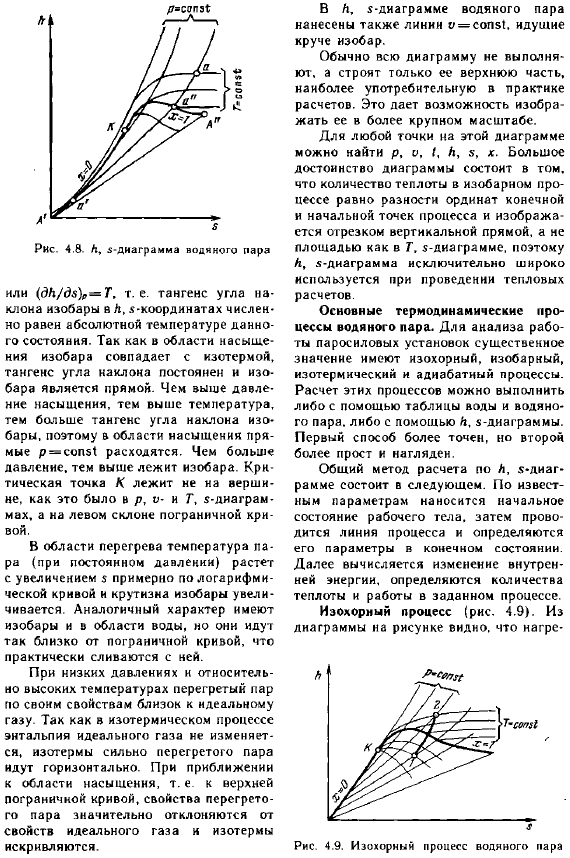
Граничной областью является область жидкости, в то время как между граничными кривыми находится 2-фазная область влажного насыщенного пара, а над верхней граничной кривой-область перегретого пара. Изобары наносятся на фигуру, каждая изобара с определенным количеством деталей соединяется с таким же количеством деталей, а соответствующие точки соединяются линиями x = = F. площадь фигуры ниже нулевой изотермы равна、 K, Z диаграмма водяного пара. Для независимых параметров, определяющих состояние рабочего тела, получаем энтропию s и энтальпию K.
Каждое состояние может быть представлено точкой на КЗ-днограмме. На рисунке 4.8 показана K-Z-dnagram…————— Пара строится координаты k, Z. Координаты считаются тройными точками. Для сухого r отложите различные давления при температуреАристотельk «, чтобы получить нижнюю и верхнюю граничные кривые. Изобары в 2-фазной области влажного пара представляют собой ряд ответвлений lines. In факт, процесс ρ „cs1 Аристотель / s = 6p₽ / T“ Аристотель LL / T、 На рисунке — водяной пар к ’ — ’ нарисуется линия о = СОП $ 1, Перейдите /// круче, чем изобар. / / /Обычно вся схема не выполняется // — ^- ’1» ют. И строят только его верхнюю часть. — что?
На самом деле самый распространенный _ S L расчет. Это позволяет для воображения Жевание в большем масштабе. / g / / g любая точка на этом рисунке 1 / / / ’P, o найдено. Я, н, с, х. Здорово. ^ 7 / ’ преимущества диаграммы. Какое количество теплоты для изобарного про?»cess равен разнице в ординате конечного 。、_________И отправная точка процесса. Ется-отрезок вертикальной линии、 Рисунок 4.8. L. G. 5-dnagraiya область водяного пара, как z-диаграмма. Поэтому он используется при выполнении теплового муха (yL / dz) A = G. То есть тангенс угла расчета.
Изобар Клон А Л,.- Координаты являются численными, а основные термодинамические-пропорциональными, равными абсолютной температуре водяного пара process. To проанализируйте состояние работы. Поскольку существенная Изобара совпадает с изотермами насыщенной области парогенераторной установки, изобарическая, изобарическая важна, градиент постоянен, изотермические и адиабатические процессы просты. Чем выше давление, тем больше расчетов для этих процессов можно выполнить без насыщения. Используйте воду и грунтовые воды, увеличьте тангенс угла наклона пара, или используйте диаграмму k, z для увеличения температуры.
Бар, следовательно, непосредственно в насыщенной области-первый метод более точен, но для меня 2-й-P = — sopz1 расходится. Более простой и интуитивно понятный. Чем выше давление, тем больше изобар. Общий способ вычисления по отношению к Krn-A заключается в том, что Z-динамическая точка K не находится сверху и является: согласно извест-новости, как это было в p, o -, и T, начальный максимум применяется к параметру z-dnagram. На склоне слева от границы находится состояние рабочей жидкости, затем провода. Технологическая линия определена и определена В зоне перегрева температура ПА (при постоянном давлении) параметров конечного состояния возрастает.
Затем вычисляется внутреннее изменение с увеличением приблизительно логарифмической энергии, определяется кривая количества, изобарный градиент увеличивает тепло и работу в данном процессе, а изокольный процесс имеет сходные характеристики(рис.4.9).От изобар и водоемов мы исходим по схеме, но видим, что нагрев очень близок к граничной кривой и действительно сливается с ней. Низкое давление и отиоситель-в р-СТЦ Но высокотемпературный перегрев Его характеристики близки к идеальным//?/■ч Gas. To быть изотермическим процессом—N-diag Энтальпия идеального газа не изменяется… Сильно перегретые паровые изотермы протекают горизонтально.
Характеристики перегретого пара значительно отклоняются, когда он приближается к области насыщения, верхней границе кривой- Приведены характеристики идеального газа и изотермы. Рисунок 4.9.Процесс IsoCore ПАРГ воды Использование постоянного объема позволяет преобразовывать влагу в сушку, насыщение и overheating. It можно конденсировать путем охлаждения, но не до конца. Потому что это количество насыщенного пара при любом низком давлении. Это означает, что изолинии не пересекают нижнюю граничную кривую.
Изменение внутренней энергии водяного пара при o = const Ди =u₂-у=(А,-p₂») — (А, — Р,.). (4.32)) Эта формула справедлива и для всех других без исключения термодинамических процессов. В процессе гомогенизации работа равна 1 = 0.Таким образом, подводимое тепло расходуется и внутренняя энергия пара увеличивается (согласно первому закону термодинамики). (4.33) Изобарный процесс (рис. 4.10).При подводе тепла к влажному насыщенному пару степень его сушки возрастает, он высыхает (при постоянной температуре), а при дальнейшем подводе тепла становится перегретым паром(температура паров атомов повышается). Он считается устаревшим, если Ta = sopz1.
Теплота, полученная в этом процессе, будет равна разнице в энтальпии. Работа процесса рассчитывается по формуле (4.35) Изотермический процесс (рис. 4.11).Внутренняя энергия водяного пара в процессе T = cp1 не остается постоянной (как в идеальном Газе), поскольку потенциальные компоненты меняются. Значение Di определяется по формуле (4.32). Количество тепла, полученного в изотермическом процессе (4.36) Работа расширения определяется первым законом термодинамики: (4.37) Процесс теплоизоляции(рисунок 4.12).Из-за адиабатического расширения давление и температура снижаются, что приводит к перегреву.
Смотрите также:
| Эксергия | Смеси идеальных газов |
| Термодинамические процессы идеальных газов в закрытых системах | Уравнение первого закона термодинамики для потока |
