Оглавление:





Типы химических реакций
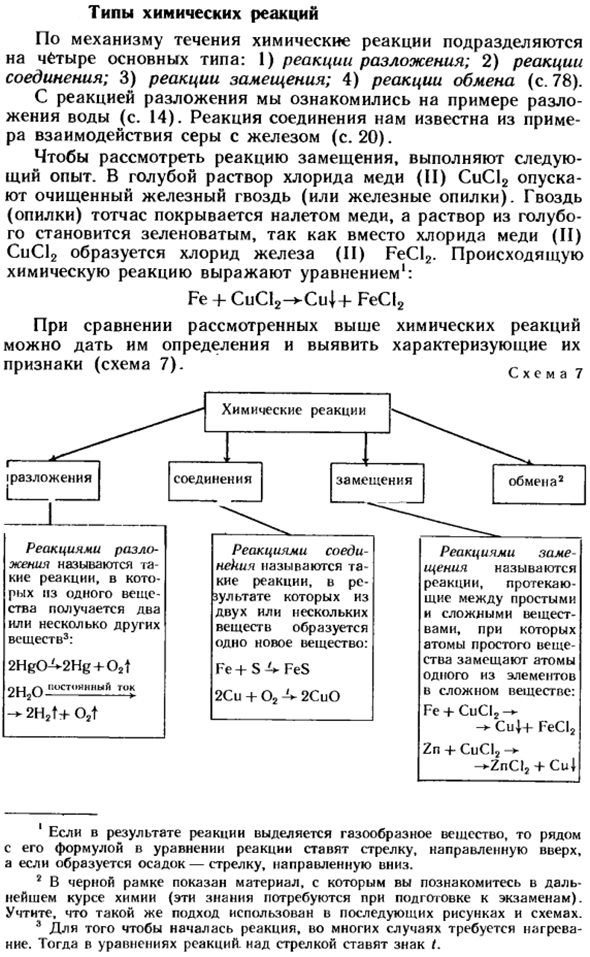
- Виды химических реакций По механизму протекания химические реакции подразделяются на 4 основных типа.1) реакция разложения. 2) реакция соединения; 3)реакция замещения; 4) реакция обмена(стр. 78). На примере разложения воды, мы привыкли к реакции разложения(стр. 14).
- Реакция этого соединения известна из примера взаимодействия серы и железа (стр. 20). Чтобы рассмотреть реакцию замещения, выполните следующий эксперимент: в синий раствор хлорида меди (II) CuCl2 опускаются очищенные железные гвозди (или железные обрезки).
Гвоздь(опилки) сразу покрывается медным покрытием, а вместо хлорида меди (II) образуется хлорид железа (II) FeCl2, так что синий раствор приобретает зеленоватый цвет. Людмила Фирмаль
Полученная химическая реакция выражается в Формуле 1. Fe + CuCl2 — * Cu | + FeCl2 При сравнении химических реакций, изученных выше, можно дать им определение и выявить их свойства(схема 7).Схема 7 1. если в результате реакции выделяется газообразное вещество, то рядом с уравнением уравнения реакции помещается стрелка вверх, если образуется осадок-стрелка вниз.
2. черная рамка обозначает материал, с которым вы познакомитесь в будущем курсе химии (эти знания понадобятся при подготовке к экзамену).Обратите внимание, что тот же подход используется на следующих диаграммах. 3. для начала реакции часто требуется нагрев. Тогда в уравнении реакции, символ находится над стрелкой. Выполните Z упражнений 5-7. 1.
Кто, когда и как открыл законы сохранения массы? Дать объяснение и объяснение этого закона с точки зрения атомно-молекулярной теории. 2.Цинковый порошок высыпают в реторту (рис. 14), закрывают, взвешивают и прокаливают contents. As реторта остыла, вес снова измерили. Измененный ^A b c d e-mail: затем открыл зажим. Я остался. 5 > Почему чаша баланса сбалансирована? Я ж г, 3.
Теоретическая и практическая значимость «УО -’ ^является ли закон сохранения массы вещества? Принести его. ■,.Образцы. 4. Соблюдайте последовательность, показанную на стр. 32, и рассмотрите валентность элемента. 14.Нагрейте метод и создайте уравнение реакции для следующей высоты в реторте. Схема: :- * л * Внутри Т СА + 02 Н + С12-КР + 02-» * Ал + С Л1 + С12 — * Литий + 02 ЗН + С12 Н2 + О2- * 5.
Напишите 2 уравнения реакций для каждого типа и объясните их сущность с точки зрения атомно-молекулярной теории. 6.Металла: кальций Са, алюминий! Если мы знаем, что сера соединений, содержащих металлы и водород, является двухвалентной, мы создаем уравнение для химической реакции этих металлов с кислородом, хлором, серой.
7.Вместо вопросительных знаков перепишите следующие формулы реакций, напишите формулы соответствующих веществ, организуйте коэффициенты и опишите типы, к которым относится каждая из этих реакций. ЗН +? ЗНО А1 (он) 3 ^ L12Oe +? Мг + гидрохлорид-раствор mgcl2 +? Охрана труда В кабинете химии Многие химические вещества являются corrosive.
It вызовет ожог. Другие токсичные вещества, некоторые из которых легко воспламеняются, могут даже вызвать взрыв. Поэтому при работе с химическими веществами необходимо строго соблюдать правила безопасности, которые имеются во всех химических камерах. Кратко опишем основные из них. Нельзя брать вещество в руки и проверять на вкус.
При измерении запаха вещества нельзя подносить контейнер ближе к лицу, так как вдыхание паров и газов может вызвать воспаление дыхательных путей organs. To чтобы привыкнуть к запаху, нужно двигаться от отверстия контейнера к носу ладонью. Не смешивайте неизвестные вещества без указания учителя. При проведении экспериментов используйте небольшое количество вещества.
Если описание лабораторных работ рекомендуется Фе +? — >Fecl3 Обеспечивает Au203 Ли +? Л1 + Cu12 — * КР +? Обратите внимание, что если вы принимаете небольшое количество этого вещества, вам понадобится 1 чайная ложка твердого вещества и 1-2 мл жидкости. Будьте особенно осторожны при работе с кислотами и щелочами.
Если вы случайно попадете кислотой или щелочью на руки или одежду, немедленно промойте большим количеством воды. При разбавлении кислоты водой всегда помните следующие правила: медленно вливайте кислоту в воду при перемешивании. Верно и обратное. Всегда используйте чистую лабораторную посуду. Не выливайте оставшееся вещество и не возвращайте его в контейнер с чистым веществом.
Если вы используете газовую горелку, следуйте следующим правилам: 1.To зажгите газовую горелку, зажгите горящую спичку сбоку от отверстия горелки и медленно откройте газовую конфорку. 2.Если во время работы происходит разрыв пламени, немедленно закройте газовый клапан. Когда горелка остынет, закройте регулятор подачи воздуха и снова зажгите горелку.
3.Если пламя газовой горелки желтоватое, это означает, что в камере недостаточно воздуха. burner. In в этом случае откройте регулятор воздуха, чтобы пламя не стало ярче. 4.Когда работа будет закончена, проверьте, закрыт ли газовый клапан. 5.Если в комнате пахнет газом, зажигать спички категорически запрещается. Немедленно сообщите учителю о запахе газа.
6.Вы не можете использовать спиртовую лампу, чтобы зажечь ее от другой спиртовой лампы, потому что алкоголь может пролиться и вызвать пожар. 7.To погасите пламя спиртовки, закройте ее колпачком. Лабораторные опыты Перед проведением клинического обследования ознакомьтесь с инструкцией по технике безопасности (см. выше). Примеры химических явлений. Эксперимент 1.
Нагрейте медь или медный провод с пламенем. Затем выньте его из пламени и очистите получившееся черное покрытие ножом на листе бумаги. Повторите эксперимент несколько раз. Задача. 1.Сравните свойства полученного черного порошка и металла меди. 2.Какие явления наблюдаются в этом эксперименте? 3.Что это за химическая реакция? Выравнивание этой реакции.
- Тест 2.Налейте в пробирку 1 мл перекиси водорода и налейте небольшое количество оксида марганца (IV).Опустите тлеющее отверстие в трубку. Происходит быстрое газообразование. Загорается тлеющая луковица. Задача. 1.Какие газы выделяются? 2.Каковы признаки, подтверждающие возникновение химического явления? Рис.15.Разложение основного карбоната меди (II). Разложение основного карбоната меди (II) 1.Опыт.
Поместите порошок на основе углеродистой меди (II) в трубку и закройте ее вентиляционной трубкой. Проверьте герметичность сборки appliance. To для этого поместите край вентиляционной трубки в чашку глубиной не более 1 см и держите трубку в руке. Если при этом в воду выпускаются пузырьки, устройство герметизируется и собирается (объясните, почему).
Если пузыри не заметны, то необходимо проверить стыки отдельных частей устройства. Людмила Фирмаль
Прикрепите трубку к стойке, как показано на рисунке 15 (нижняя часть трубки должна быть немного выше отверстия). Поместите кончик вентиляционной трубы в стакан с известковой водой. Сначала нагрейте всю трубку пламенем, а затем в том месте, где находится порошок. Цвет порошка из зеленого меняется на черный. На стенках трубки появляются капельки воды, известковая вода становится мутной.
Задача. 1.Проведено сравнение свойств полученного черного порошка с веществом, полученным при прокаливании медной пластины, и сделан вывод. 2.Какие газы выделялись в ходе эксперимента? 3.Почему при нагреве основного карбоната меди (II) необходимо удерживать трубку в наклонном положении? Реакция железа с соединениями серы. Опыт.
Тщательно перемешайте порошок железа и серы с массовым соотношением 7: 4.Полученная смесь будет действовать с помощью магнита. Железо притягивается к магниту, а сера не притягивается. Смесь порошка железа и порошка серы помещают в пробирку и нагревают в пламени(рис. II).После этого в пробирке смесь будет очень горячей в 1 место. Как только бурная реакция начинается, остановить отопление. Масса смеси будет продолжать сильно светиться, не нагреваясь.
Охладите трубку, затем сломайте трубку и измельчите содержимое в порошок. Магнит не действует на порошок в полдень. Задача. I. С точки зрения теории атомов и молекул, объясните суть реакции, происходящей между железом и серой. 2.Почему он нуждался в нагревании только для того, чтобы начать реакцию? 3.Почему магнит действует на порошковую смесь железа и серы только перед нагревом? 4.Какая реакция происходит при взаимодействии железа и серы? Мотивирует ответ.
1 Описание названия см. на стр. 86. Замена меди на железо. Опыт. Налейте раствор хлорида меди (II) в пробирку (емкость приблизительно ’ / ’ 00) и опустите чистый железный гвоздь. Поверхность ногтя покрыта медью. Выньте гвоздь из раствора, осмотрите его и положите кусочки железа в тот же раствор. Через некоторое время железный порошок покрывается медью, и цвет раствора меняется от голубого до зеленоватого.
Задача. I. каковы признаки того, что произошла химическая реакция? 2.Объясните суть этой реакции с точки зрения атомно-молекулярной теории. Создайте соответствующее уравнение. Практика 1 1.Как обращаться с экспериментальным tripod. An экспериментальный штатив показан на рисунке 16.Штатив помогает зафиксировать оборудование во время эксперимента.
При закреплении на штативе трубка должна быть закреплена на ножке так, чтобы ее можно было перемещать, не падая вниз. Плотно закрепленная трубка может лопнуть. Трубка закреплена не в центре, а рядом с отверстием, что позволяет нагревать большую часть surface. To снимите трубку со штатива, ослабьте винты крепления зажимных язычков. При прикреплении чашки к штативу, чашка помещается в специальную сетку, размещенную на штативном кольце. Поместите фарфоровую чашку на кольцо штатива без сетки.
2.Как обращаться с газовой горелкой или спиртовой лампой. Правила и процедуры обращения с газовыми горелками и спиртовыми лампами см. в тексте на стр. 35. 3.Исследование структуры пламени. Если внимательно изучить пламя, то можно выделить 3 зоны(рис. 17). внизу газ смешивается с воздухом. Если вы быстро вставите головку спички в эту часть пламени и подержите ее некоторое время, спичка не загорится сразу.
Поэтому температура в этой части пламени невысока. Вставьте стеклянную трубку в нижнюю часть пламени и поднесите огненную спичку ближе к ее отверстию, появится пламя. Это доказывает, что в нижней части пламени находится негорючий газ. Центральная часть пламени будет самой яркой. Это связано с тем, что. Здесь под воздействием относительно высоких температур происходит разложение углеродсодержащих продуктов, частицы угля становятся очень горячими и испускают свет.
Во внешней части пламени (рис. 17) полное сгорание газа происходит за счет образования монооксида углерода (IV) CO2 и воды H2O. As в результате пламя в этой части не люминесцентно. Рис.16.Экспериментальный штатив. ТВЦ Я! 17.Температура пламени газовой горелки.
Смотрите также:
| Закон сохранения массы веществ | Кислород, его общая характеристика и нахождение в природе |
| Химические уравнения | Получение кислорода |
Если вам потребуется заказать решение по химии вы всегда можете написать мне в whatsapp.
