Топоскопический закон Рауля
Одним из важнейших термодинамических свойств чистых жидкостей и растворов является давление насыщенного пара.
Рассмотрим процесс испарения чистой жидкости (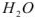 ) в закрытом сосуде. Молекулы жидкости перемещаются хаотически с различными скоростями и те из них, которые оказываются у поверхности и движутся вверх за счет своей кинетической энергии могут преодолеть силы межмолекулярного взаимодействия и перейти в газовую фазу. Постепенно накапливающиеся в пространстве над жидкостью молекулы, перемещаясь хаотически, ударяются о поверхность воды и могут поглощаться ею, т.е. происходит процесс конденсации пара.
) в закрытом сосуде. Молекулы жидкости перемещаются хаотически с различными скоростями и те из них, которые оказываются у поверхности и движутся вверх за счет своей кинетической энергии могут преодолеть силы межмолекулярного взаимодействия и перейти в газовую фазу. Постепенно накапливающиеся в пространстве над жидкостью молекулы, перемещаясь хаотически, ударяются о поверхность воды и могут поглощаться ею, т.е. происходит процесс конденсации пара.
По истечении некоторого времени наступает состояние равновесия между процессом испарения и конденсации воды. Пар находящийся в равновесии с жидкостью называется насыщенным и характеризуется давлением насыщенного пара. Эта величина не зависит от количества пара и жидкости, от наличия и количества газа, инертного по отношению к пару, а зависит только от температуры.
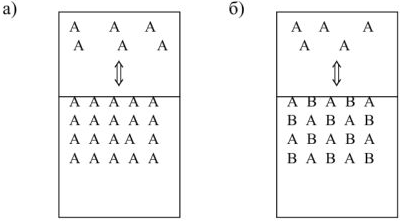
Рис. 3. Схема испарения чистого растворителя А ( ) (а) и растворителя (
) (а) и растворителя ( ) из раствора, содержащего нелетучего вещество В (б).
) из раствора, содержащего нелетучего вещество В (б).
Константа равновесия процесса испарения чистого растворителя (а) численно равна парциальному давлению насыщенного пара при данной температуре. Например, для воды
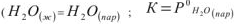
При растворении нелетучего вещества (В) в веществе (А) число молекул (А) в единице объема уменьшается, а значит, снижается и их число на единице поверхности испаряющейся жидкости (б).
Равновесие процесса испарения в такой системе можно описать посредством следующего уравнения:
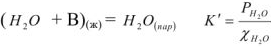
Поскольку выражения (11) и (12) относятся к одной температуре, то К = К и следовательно 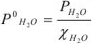 или в общем случае
или в общем случае 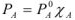
где 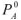 — давление насыщенного пара чистого растворителя, кПа;
— давление насыщенного пара чистого растворителя, кПа;
 — давление насыщенного пара растворителя над раствором, кПа;
— давление насыщенного пара растворителя над раствором, кПа;
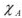 — молярная доля растворителя.
— молярная доля растворителя.
Уравнение (3) является математическим выражением тоноскопи-ческого закона Рауля: парциальное давление насыщенного пара растворителя над раствором прямо пропорционально его молярной доле.
Поскольку растворенное вещество ( В ) не летуче, то 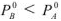 и
и
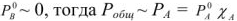
и с учетом 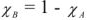 получаем
получаем
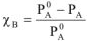 — или для воды
— или для воды 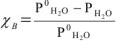
Полученное выражение (5) является другой формулировкой закона Рауля: относительное понижение давления насыщенного пара растворителя над идеальным раствором равно молярной доле растворенного вещества.
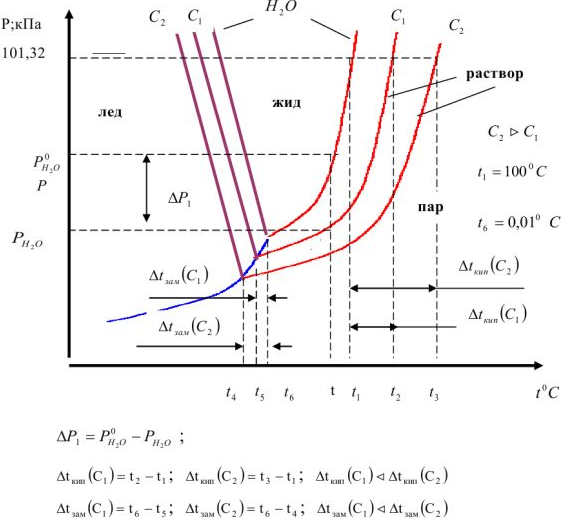
Рис. 4. Диаграмма состояния воды и водного раствора нелетучего вещества.
Рассмотрим пример:
Определить давление насыщенного пара над 1,0% раствором карбамида 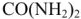 при 298К, если давление насыщенного пара над водой при той же температуре равно 2,34 кПа.
при 298К, если давление насыщенного пара над водой при той же температуре равно 2,34 кПа.
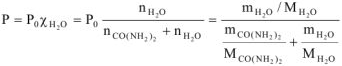
где:
Р — давление насыщенного пара растворения над раствором, кПа;
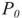 — давление пара чистого растворителя, кПа;
— давление пара чистого растворителя, кПа;
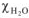 — молярная доля растворителя (
— молярная доля растворителя (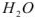 )-,
)-,
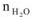 — количество воды, моль.
— количество воды, моль.
п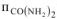 — количество карбамида, моль
— количество карбамида, моль
Возьмем 100 г раствора, тогда масса 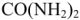 равна 1 г, а масса
равна 1 г, а масса 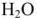 — 100 — I = 99 г, тогда
— 100 — I = 99 г, тогда
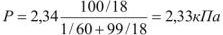
Давление насыщенного пара над 1% раствором 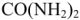 составляет 2,33 кПа.
составляет 2,33 кПа.
Эта теория взята со страницы помощи по химии:
Возможно эти страницы вам помогут:
| Методы умягчения воды в химии |
| Диаграмма состояния воды в химии |
| Эбуллиоскопический закон |
| Криоскопический закон |
