Оглавление:



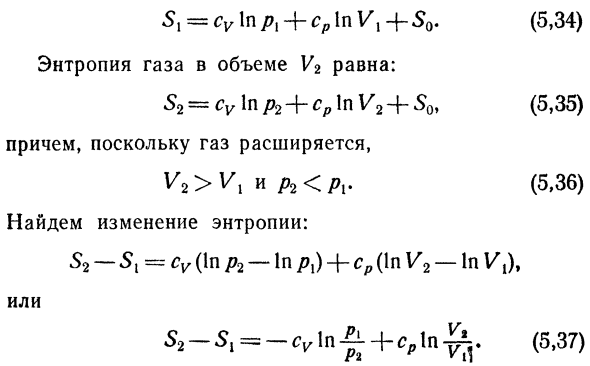


Энтропия адиабатических процессов.
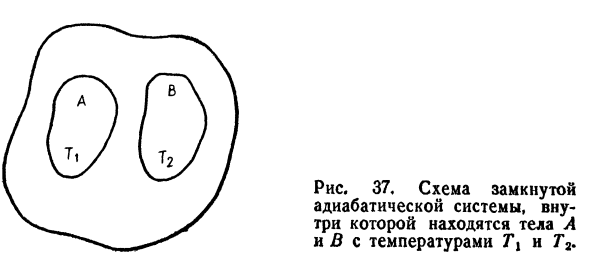
- Энтропия процесса изоляции Для процесса изоляции, проте * Изгиб без теплообмена с внешней средой, d’q = 0. Тогда из Формулы Е, 12) выглядит так: ДС> 0. Е, 29) Коэффициент Е, 29).Обратимый В процессе теплоизоляции энтропия не изменяется, но、 Необратимое всегда увеличивается (dS> 0). И мы посмотрели на результаты более подробно、 Найдите внутреннюю часть закрытой теплоизоляционной системы
Сформированы 2 тел: а имеет температуру T1,А Б есть- Температура T2-(рис. 37).Энтропия тела A представлена энтропией тела 5B Предположим, через S2, Ti> T2. Изучите изменение энтропии всей системы. От Формула E, 12) для каждого из тел A и B、 Не трогайте его пока: Для тела а летнее время= — Для Тела B Е, 30) Е, 31) Ti> T2, поэтому тепло от тела A
В этом случае вся система Термоизоляция, non-термоизоляция про Процесс. Людмила Фирмаль
проходит через Для тела B полное изменение энтропии равно: Е, 32) 32) знак минус перед первым членом суммы е、 Тело а-это тепло d’qi- В выражении E, 32) предполагается, что d’Qi> 0 и T > T2.Следующий Таким образом, изменение энтропии является положительным. ДС> 0. Э, 33) Полученное неравенство E, 33) доказывает возраст- Увеличение энтропии системы при необратимой теплоизоляции* Процесс. 37, замкнутый контур
Система теплоизоляции Среди них-тело л. B с температурой Tx и G2.Рис.38.Схема опыта по Идеальный газ. Пустота. Увеличение энтропии с расширением идеала Полный газ в пустоту. Представьте себе разделенный сосуд. Разбить на 2 части (рис. 38), и Часть сосуда (объем Vi) содержит идеальный газ. Затем удалите газ из другой части, чтобы завершить вакуум. Если После того, как перегородка проколота, большой газ
Погрузитесь в пустоты и равномерно заполните их Контейнер. Рассматриваемый процесс необратим. Каждое промежуточное газовое состояние не является состоянием От его скорости, тем ниже равновесие, и теплоизоляция Энергетический обмен с большим и экологическим Нет времени выходить на улицу. Для такого процесса dS> 0. Давайте покажем справедливость неравенства е по делу 33) Расход на полный газ чайном пространстве. Энтропия Зависит от характера процесса、
- Функция состояния системы. Запишите ее выражение лица Оба газовых состояния. Энтропия газа в объеме V \равна: ЗХ = ТИЦ в P {4-CP в Вт + КВ. Энтропия газа в объеме 1/2 равна: S2-Su В P2 + СР В V2 + So Кроме того, когда газ расширяется、 Версии v2 > VX и Р2 <РХ. Найти изменение энтропии: С2-с {- CV(в Р2-в/?!) + СР (в v2-В V {) Ф Или Е, 34) Е, 35) Е 36) E, 37) использовать отношение — = — rr-к идеалу m* P 1 Это происходит потому, что мы пишем уравнение E, 37) в виде: ^ ^ Е, 38)
Но если V2> Vi E, 36), то 52-5i> 0, то есть энтропия Энтропия растет. Все спонтанные процессы похожи на те Выше это сопровождается увеличением энтропии Энтропия. И в природе этот процесс обречен на провал Самопроизвольно, система изоляции всегда будет преследовать Состояние с максимумом энтропии. Равновесие с энтропией системы. Byrazh- Второй закон термодинамики теплоизоляции 29) процесс изоляции в виде е, энтропии
Это хорошая характеристика приближения Теплоизоляция системы до равновесного состояния. Чем выше последнее значение, тем ближе система Он находится в устойчивом равновесном состоянии. Когда менять Когда энтропия системы изменяется на ноль, система Он находится в состоянии равновесия.
Действие Фактически, приближение к состоянию системы Равновесие сопровождается увеличением энтропии. Людмила Фирмаль
Следовательно, энтропия может быть использована. Определение состояния равновесия и Определение состояния, близкого к равновесному. Если Энтропия известна как функция параметров системы. В каком направлении вы можете предсказать Процесс происходит.
Например, вы можете предсказать курс Химическая реакция в условиях теплоизоляции Известна энтропия исходных и конечных продуктов реакции. В неизолированных условиях, все вышеперечисленное Это бессмысленно, потому что рассуждения не выполняются. Соотношение ДС ^ — О. В этом случае, роль энтропии Другие термодинамические функции (см. Главу 7).
Смотрите также:
Решение задач по термодинамике
| Числа подобия тепло и массопереноса | Возрастание энтропии при расширении идеального газа в пустоту. |
| Внешний тепло и массолеренос | Энтропия и равновесие системы. |
