Оглавление:


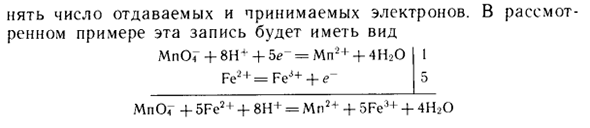

Уравнения окислительно-восстановительных реакций
- уравнение Окислительно-восстановительная реакция Особенностью окислительно-восстановительной реакции является переход электронов между реагирующими частицами. Частицы, которые принимают электроны, называются окислителями, а донорские электроны — восстановителями.
- Например, реакция Fe2 * + Ce4 + = Fe3 + + Ce3 + (6,1). Электроны из Fe2 ~ переходят в Ce4 +, что приводит к уменьшению степени окисления (и положительного заряда) ионов церия и увеличению ионов железа. Следовательно, этот тип реакции называется окислительно-восстановительной реакцией, поскольку было обнаружено, что процесс окисления одного вещества тесно связан с восстановлением другого вещества.
В этом случае ионы Ce4 + являются окислителями, а ионы Fe2f — восстановителями. Людмила Фирмаль
Каждая окислительно-восстановительная реакция Он существует как сумма двух полуреакций, одна из которых отражает конверсию окислителя, а другая является восстановителем. Например, в реакции (6.1) формула полуреакции с использованием окислителя имеет вид Ce4 ‘+ e «= Ce3f (6,2) Но с восстановителем Fe2 + = Fe3 ++ e «(6,3) Суммирование (6.2) и (6.3) дает формулу химической реакции (6.1).
Совершенно ясно, что при суммировании, согласно закону электрической нейтральности раствора, необходимо обеспечить, чтобы число электронов, испускаемых восстановителем, было точно равно числу электронов, полученных окислителем. , Это основано, в частности, на электронно-ионном методе, который выбирает наиболее очевидный и универсальный окислительно-восстановительный коэффициент.
Часть процесса выравнивания числа атомов, когда реакция приводит к перегруппировке сложных многоатомных частиц, содержащих, например, атомы кислорода (Mn04, Н2О2 и т. Д.), Ионы водорода, гидроксид-ионы или молекулы воды Может быть включен как Если реакция происходит в кислой среде, ионы H + могут быть включены в уравнение полуреакции для щелочи + OH к ионам. Найти стехиометрический коэффициент реакции окисления Fe2 + и перманганата в кислой среде: Fca + + MnOG-Fe3 + + Mn2 «*»
- Окислитель MnOG в результате реакции превращается в ионы Mn. Мног-Мн2 + Чтобы выровнять число атомов с обеих сторон уравнения, нужно ввести 8Н в левой части полуреакции и 4NgO в правой части. MnOG + 8H * = Mn2 + + 4HjO Для выравнивания количества зарядов необходимо ввести пять электронов с левой стороны. MnOG 4-8H + + 5 <T = Mn2 + + 4H20 (6,4)
Как видите, никакой информации о свойствах реагирующих частиц, таких как степень окисления и валентность, не требовалось для определения количества полученных электронов. Чтобы выровнять число переданных электронов, коэффициент полуреакции (6,3) необходимо умножить на 5.
Половинная реакция с Fe2 + в этом случае ничем не отличается от (6.3). Людмила Фирмаль
5Fe2 + = 5Fe3 + • + • 5е ~ (6,5) Суммирование (6.4) и (6.5) MnOG + 5Fc2 + + 8H + -Mn2 + + 5Fe3 + + 4H20 (6,6) Формула полуреакции обычно записывается непосредственно вверх и вниз, а поправочный коэффициент обозначается вертикальной чертой в правой части формулы.
Это требует выравнивания путем умножения на стехиометрический коэффициент полуреакции. 5 — количество отправленных и полученных электронов. В рассматриваемом примере эта запись выглядит следующим образом MnO <+ 8tr + 5 <? — = Mn2 + + 4H20 Fe2 + = FeJ + + е ~ MnO «+ 5Fc2 ♦ + 8Н + = Mn2 + + 5Fc3 + + 4Н20
Смотрите также:
Решение задач по аналитической химии
| Изоморфизм | Окислительно-восстановительные потенциалы |
| Коллоидные растворы | Влияние кислотно-основного взаимодействия, комплексообразования и образования малорастворимых соединений на редокс-потенциал |
