Оглавление:







Уравнения состояния реальных газов Уравнение Ван-дер-Ваальса.
- Уравнение состояния реальных газов Ван-дер-Ваальса.На самом деле Мы всегда имеем дело с веществами, имеющими свои свойства Более или менее отклоняются от характеристик идеального вектора Substance.It объясняется это тем, что такие вещества более сложны. уравнение состояния. * См.§ 3 в этой главе.
Рассмотрим уравнение ван-дер-Ваальса. Качественное описание жидкостей и газов Система status.It имеет для молекулы 1 грамма Смотреть: А) а, 9) p и y ^> b — это уравнение Введите уравнение состояния идеального газа PV = RT. Уравнение ван-дер-Ваальса、 Уравнение Клапейрона Менделеева по введению — p к значению давления, b к объему Объем.
Учитывая важность уравнения ван-дер-Ваальса* АРЗа объясняет реальное содержание 2 В. Ф. Ноздрев, 47 Его характеристики более подробно. Людмила Фирмаль
Поправки учитывают: Во-первых, объем, который занимает молекула, является действительным числом. Реальный газ (в идеальном газе молекулы являются Важные моменты, которые не занимают объема); Во-вторых, так называемое » мертвое пространство」、 Где реальные молекулы газа не могут проникнуть Движение, то есть объем зазора между молекулами Плотная упаковка. Следовательно, b = Кмоль + Узазор- Компенсация давления-с учетом сил между собой Взаимодействие между молекулами реального газа.Она играет Он представляет собой внутреннее давление, определяемое из Следующие простые соображения.2 смежных элемента Газовые элементы взаимодействуют пропорционально силе Пропорционально произведению количества содержащихся в нем веществ В этих основных томах.Поэтому внутренние Давление Пи、 Концентрация п: Л-У2-Р2 ~~ Где Р-плотность газа. Таким образом, общее давление составляет Внешнее и внутреннее давление P + а = /?Н-У2 ″»
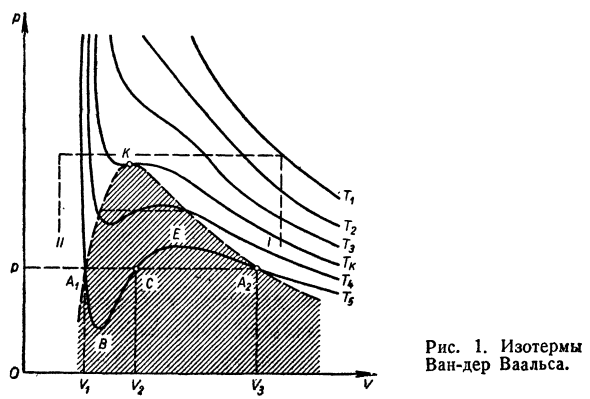
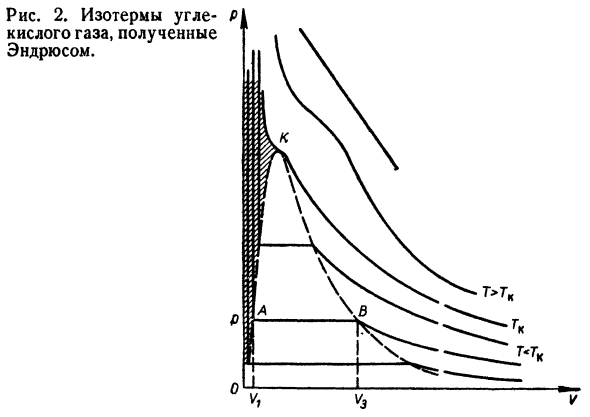
Рассмотрим график* Визуализация изотермы ван-дер-Ваальса фотоэлектрическая диаграмма (Рис. 1). Как показано на этом рисунке, изотермическая форма изменяется В зависимости от температуры Осуществляется изотермический процесс с газами.Об изотерме Го <ТК, 1 значение давления P соответствует 3 Значение громкости Vu V2, V3.Для изотермы Г=ГК (Кри» Статическая изотерма) характеризуется наличием точки отскока ba / C, где Vi = V2-Vzy и все изотермы* Значение давления однозначно соответствует определению* Значение разбиения объема.Изотермический формат TS> TK Плавные кривые, соответствующие идеальной изотерме Идеальный газ pV-константа при высокой температуре. Сравним изотермы, вычисленные по уравнению Уравнение ван-дер-Ваальса (Рис. 1) и полученный эксперимент В 1868 году Эндрюс экспериментировал с углем. Двуокись углерода(Рис. 2). Как показывает экспериментальная изотерма、
- Переход вещества из одной Фазы в другую Работать при постоянном давлении(АВ-прямая)、 Таким образом, фактически, объем V2 не может быть разделен. Более тщательный эксперимент、 1 секция изотермы АТБ и Рисунок 1.Изотермический Ван-дер-Ваальса. Восемнадцать Рисунок 2.Углеродные изотермы Полученный кислый газ Эндрюс. A2e. график экспериментально обнаруженной изотермы Неудачный. На графике A \ B показана перегретая жидкость. Опыт Экспериментально, изучено Жидкость предварительно удаляют воздухом и различными Шлаки.Такая»очищенная» жидкость при определенной температуре Отсутствие пара после кипеть на некоторое время Состояния, которые расширяются вдоль кривой ATB. График изотермы A2E соответствует перегреву па * Как использовать экспериментал, глаз* Пар из центра конденсации. Рассматриваемый участок изотермы соответствует Нестабильное состояние системы.Легкий гнев-* Непосредственно от A {B и A2E из-за сдвига системы Я иа2. Уравнение ван-дер-Ваальса для критической области Состояние жидкости полностью объяснено、 Качественные и количественные газы.
Однако Диапазон температур ниже критического, это дает Кости — это только качественное описание состояния системы. Например, для изотермической степени сжатия* = −7 \ — d / G / ’и эксперименты и расчеты Девятнадцать Мост Уравнение состояния ван-дер-Ваальса、 РТ увеличивается с повышением температуры.Однако、 Различия в числовых данных могут достигать до 100% Больше.
Близлежащие районы Близко к идеальным условиям, это дает хороший Количественное соответствие теории и опыта. Людмила Фирмаль
Ван-дер-Ваальсово уравнение состояния болезненно- Большая роль в развитии наших представлений о тепле Термодинамические свойства газов и жидкостей.Он вел за собой. К исследованию термодинамически неустойчивых состояний、 Учение о серьезном положении дел и тогда Послужил основой для теории соответствующего состояния.
К сожалению, отсутствие строго теоретического обоснования С обоснованием этого уравнения состояния, ясное Конкретные ограничения применения в теории и практике practice.In наука и техника, Ван дер Vaalsa обычно используется для высококачественного анализа. Анализ газообразного и жидкого состояний.
Технология во многих случаях Используется узкое уравнение состояния Область изменения параметров состояния хорошая Согласие между теорией и экспериментом. Вот краткое описание других уравнений Государство.
Смотрите также:
Решение задач по термодинамике
| Уравнения состояния | Уравнение состояния Клаузиуса. |
| Уравнение состояния идеального газа. | Уравнение состояния Бертло. |
