Оглавление:






Внутренняя энергия.
- Внутренняя энергия Внутренняя энергия газа означает всю энергию, которая содержится в теле или системе тела. Эта энергия может быть выражена как сумма энергий отдельных типов. Кинетическая энергия молекулы включает в себя энергию поступательного и вращательного движения молекулы, а также колебательное движение атома в самой молекуле. Энергия электрона;
внутриядерная энергия; энергия взаимодействия между ядром молекулы и электроном. Энергия электромагнитного излучения. Внутренняя энергия организма У * = хм + u0T-Ф Ц0} Где UM-внутренняя кинетическая энергия молекулы. Un0T-это внутренняя потенциальная энергия молекулы. ООН является
Энергия положения или энергия положения молекулы во внешнем силовом поле. Людмила Фирмаль
неотъемлемой константой. Внутреннюю кинетическую энергию можно разделить на следующие составляющие: ^ Хит = ^ кит. Должность{L <pr. пр » б ^ граф» Я не собираюсь этого говорить. пост-это кинетическая энергия поступательного движения молекулы. Ul {UH, bP-кинетическая энергия вращательного движения молекулы. 1 / count-энергия колебательного движения атомных ядер
взаимосвязанных молекул. Значение U0 представляет собой внутреннюю энергию при нулевом или абсолютном нуле temperature. As известно, что при T = 0 тепловое движение атомов, входящих в молекулу и молекулу, прекращается, но движение частиц внутри атома продолжается. Например, движение электронов в атоме не является тепловым движением, а происходит при любой температуре, в том числе и при T = 0.Поскольку абсолютное значение
- внутренней энергии не может быть определено термодинамическим методом, при термодинамическом анализе системы необходимо определить абсолютное значение внутренней энергии, а для решения большинства термодинамических задач, обусловленных изменениями в результате протекающего процесса, значение U0 не требуется и обычно рассматривается как ноль. В технической
термодинамике рассматриваются только процессы движения и скрытые компоненты внутренней энергии. молекул и энергию колебательного движения атомов в молекулах далее в идеальный газ, а реальный газ также добавляет потенциальную энергетическую составляющую в соответствии
Таким образом, понятие внутренней энергии включает кинетическую энергию движения Людмила Фирмаль
с расстоянием между молекулами, связанным с наличием сил взаимодействия между молекулами. Внутреннюю энергию можно посчитать из любого условного числа zero. So например, для идеального газа принято считать внутреннюю энергию при t0-0°C, которая равна нулю. Кинетическая составляющая внутренней энергии целины определяется температурой тела, ее потенциал при
определенной температуре также зависит от удельного объема (расстояния между молекулами), поэтому полная внутренняя энергия становится функцией 2-х параметров, и в этом состоянии состояние тела приобретает очень четкую величину. Такие величины, как было установлено ранее, называются параметрами состояния или функциями. Таким образом, внутренняя энергия, являющаяся параметром состояния, является как определенной непрерывной, так
и конечной функцией состояния системы. Его величина зависит от веса, поэтому внутренняя энергия является дополнительным или экстенсивным параметром. Внутренняя энергия сложной системы, называемая 1 кг, равна сумме внутренней энергии отдельных компонентов. н У = Уй + У2 -\ — — — — = * Согласно закону сохранения энергии, термодинамическая система каждого состояния может
иметь только 1 внутреннюю энергетическую ценность. Если предположить, что система в этом состоянии может иметь разные значения внутренней энергии, то мы можем использовать эту разницу, не изменяя состояния системы. Такая ситуация противоречит законам сохранения энергии. Таким образом, изменение внутренней энергии газа не зависит ни от природы
процесса, ни от p * n и полностью определяется заданным начальным и конечным состоянием. «2 — = /(Р2.Т2) — /(п | ф 7 ).(5-2)) В Это наглядно показано на схеме. 5-1.2 2 2 1 2 2 (3) 5du =(4) jjdu =(5) (jdu = — (6)^ du =(6)$ du Рисунок 5-1 в (5-3)) Изменение внутренней энергии-это то же самое. В процессе циркуляции изменение энергии нута равно нулю: «2-У1 = § дю-0. Приращение du, как и любой другой параметр, является полной разницей. Так как состояние газа
полностью определяется основными параметрами состояния、 Внутренняя энергия может быть представлена в виде функции любых 2 параметров состояния. u = f(7 \ v)\ u =(7 \ p)\ u = / 2 (p, y), или полная производная внутренней энергии: дю =(ду / ДТ) В. ДТ 4-(ду / ДВ) Т ДВ;. дю =(Ди / ДТ) Р ДТ +(Ди / Ди) Т ДП、 ду =.(Ди / др) с ДП-1 — (ДУ / ДВ) Р ДВ. Внутренняя энергия идеального газа без силы взаимодействия между
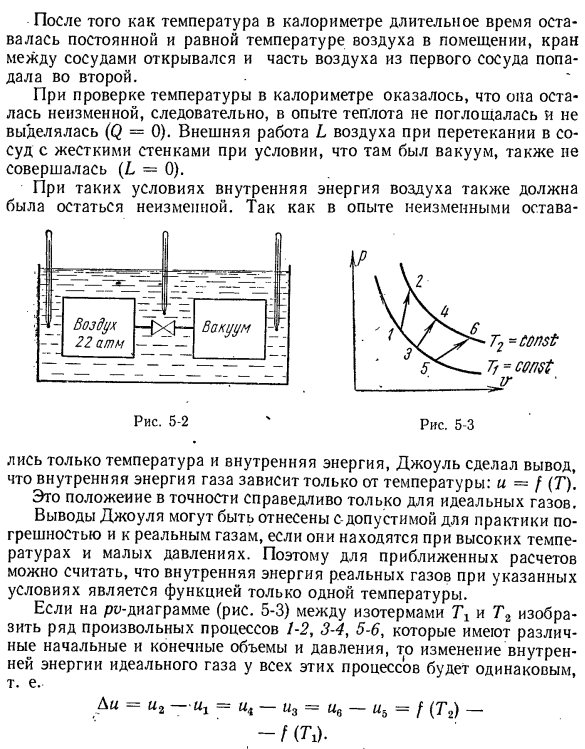
молекулами не зависит от объема или давления y (Du / dv) m = 0 и(di / dv) m = 0, но температура и-f (Т), а следовательно, внутренняя энергия идеального газа V, является полной производной. в = с _(Ди / ДТ)Р =дю(ду / ДТ) / ДТ В: это положение было доказано Жюлем, который провел следующий эксперимент в 1845^’. 2 емкости помещали в калориметр с водой и соединяли между собой трубкой
с краном(рис.5-2). Первый контейнер был заполнен сжатым воздухом. Мы удалили воздух из 2-го сосуда и измерили температуру всего оборудования несколькими термометрами. Это положение было доказано Жюлем, который провел следующий эксперимент в 1845 году:^’. 2 контейнера помещали в калориметр с краном и соединяли между собой трубкой с краном(рис.5-2).Первый контейнер был
заполнен сжатым воздухом. Мы удалили воздух из 2-го сосуда и измерили температуру всего оборудования несколькими термометрами. ■После того, как температура долговременного калориметра стала постоянной и стала такой же, как температура воздуха в помещении, клапан между контейнерами открылся, и часть воздуха из первого контейнера попала во второй контейнер.
Проверив температуру в калориметре, оказалось, что температура не меняется, поэтому в эксперименте тепло не поглощалось и не выделялось(Q = 0).При наличии вакуума внешняя работа воздуха при поступлении в емкость с жесткой стенкой L также не происходит (L = 0). При таких условиях внутренняя энергия воздуха также не должна изменяться. Опыт не изменился. 5-2-4-5-3 Поскольку
потреблялись только температура и внутренняя энергия, Джоуль пришел к выводу, что внутренняя энергия газа зависит только от температуры: u = /(T). Это положение верно только для идеального газа. Вывод джоуля может быть обусловлен диапазоном погрешности для реального газа, когда фактический газ имеет высокую температуру и низкое давление. Поэтому в приближенном расчете
можно предположить, что внутренняя энергия реального газа в этих условиях является функцией только 1 температуры. Если какие-либо серии процессов 1-2, 3-4, 5-6, начальный объем и конечный объем и давление которых различны, показаны на диаграмме pv между изотермами T1 и T2 (рис.5-3), то изменение внутренней энергии идеального газа этими процессами все равно. Ди = И2-Щ =-У3 = у〜УБ = Ф (Т2)-
Смотрите также:
Решение задач по термодинамике
| Уравнение состояния для реальных газов М. П. Вукаловича и И. И. Новикова. | Аналитическое выражение работы процесса. |
| Закон сохранения и превращения энергии. | Обратимые и необратимые процессы. |
