Оглавление:
















Водородные соединения
- Соединение водорода. Валентность химических элементов Водород не превышает 4 и изменяется естественным образом в пределах группы периодических систем.\ I II III IV v VI VII — Водородная валентность. 1 2 3 4 3 2 1 Сложный пример….. ИГИЛ ках, Лах, ч «НХС ОХ2 ФХ Однако взаимодействие с водородом (образование или растворение соединений) характерно не для всех элементов.
- Из общих свойств производные водорода(гидриды) условно делятся на 5 больших групп, и каждой группе соответствует определенная последовательность элементов периодической системы (стр. 4).Особенности Гидриды элементов Линии других элементов Аналог Я люблю соль. . 1-2 Ли, На II. переходный период. •. 3-5 лантаноидов, актиноидов III металлик. 6-10©) IV. полимер…. 11-13 Быть, Мг. B, AI. 14-17 C, Si, N. P, O. S, F, CI, B
Распределение этого гидрида кратко описано ниже. Людмила Фирмаль
Каждая группа гидридов характеризуется совершенно разными характеристиками, но границы между ними не всегда четкие. Например, медь может быть отнесена как к IV, так и к III группам, а бор-как к IV, так и к V гидридам. Гидриды Li-Cs и Ca-Ba в виде солей представляют собой бесцветные кристаллические вещества, состав которых соответствует формулам EN и EN2 соответственно, они образуются из элементов с довольно большим тепловыделением. L1H Неее х РБГ Сен Хаг, SrHj BaHj Теплота образования связи, ккал•. •♦•21.7 13.5 13.8 13.0 13.5 22.3 21.5 22.7
Они близки по размеру к Иону галогена, как видно из сравнения эффективного радиуса и относительной деформируемости, но содержат водород в виде отрицательного Иона Н〜, который значительно легче поляризуется(фтор считается единичным): Н-Р „С Г В Д“ Я » Раднус, А………. 1.54 1.33 1.81 1.96 2.20. Деформируемый р… 14.7 я 3.7 6.1 7.6 По физическим свойствам такие гидриды, как соли, сходны с соответствующими Галоидными солями.
Однако они очень активны химически, и это связано с относительно низким электронным сродством водорода (\9 ккал / моль).Наиболее важным для химических свойств гидридов, таких как соль, является их активное взаимодействие с водой, которое, согласно схеме, например, предполагает образование водорода LiH + H20 = Hit + LiOH и CaH2 + 2H20-2H2 | + Ca (OH) 2 Или ионы: H-(из гидрида) » + H +(из воды)= H * 13 Элементы, непосредственно примыкающие к щелочноземельному металлу (а также лантаноиды и Актиноиды) в 3-5 рядах аналогов поглощают значительное количество водорода.
Это обычно уменьшается, когда линия аналогов проходит слева направо (расчет на грамм атома) тип ограничения гидрида для большинства элементов 5-й и 4-й серий аналогов (и некоторых лантаноидов) является EN2.Свойства элементов 3-5 рядов аналогов, например, как видно из данных тантала, заключаются в том, что количество поглощенного водорода уменьшается с повышением температуры(число атомов H на атом 1 г металла).
Температура,°С•. 。 170263530730 1030 1330 содержание водорода 0,76 0,59 0,19 0,06 0,02 0,01 Состояние водорода в рассматриваемом переходном гидриде соответствует равновесию по схеме E + + H — > E + H. таким образом, в принципе возможен поэтапный переход между ними и солеподобными гидридами. Хорошим примером такого переходного типа соединения является гидрид лангания. Уже на холоде металлический фонарь поглощает водород с довольно большим тепловыделением (около 20 ккал / г-экв), и полученный продукт в конечном счете соответствует формуле LaH3.Обе эти ситуации приближают La к щелочноземельным металлам.
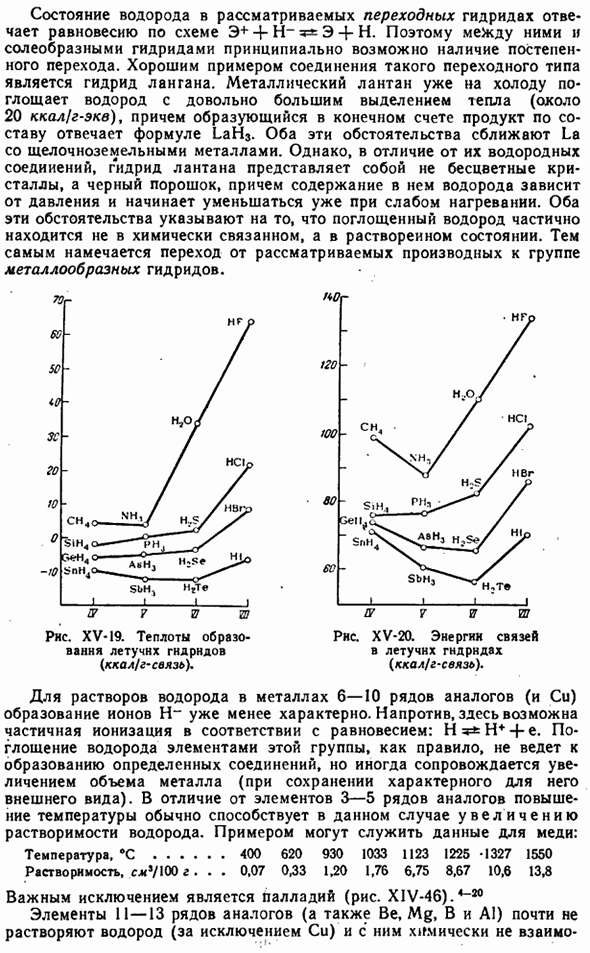
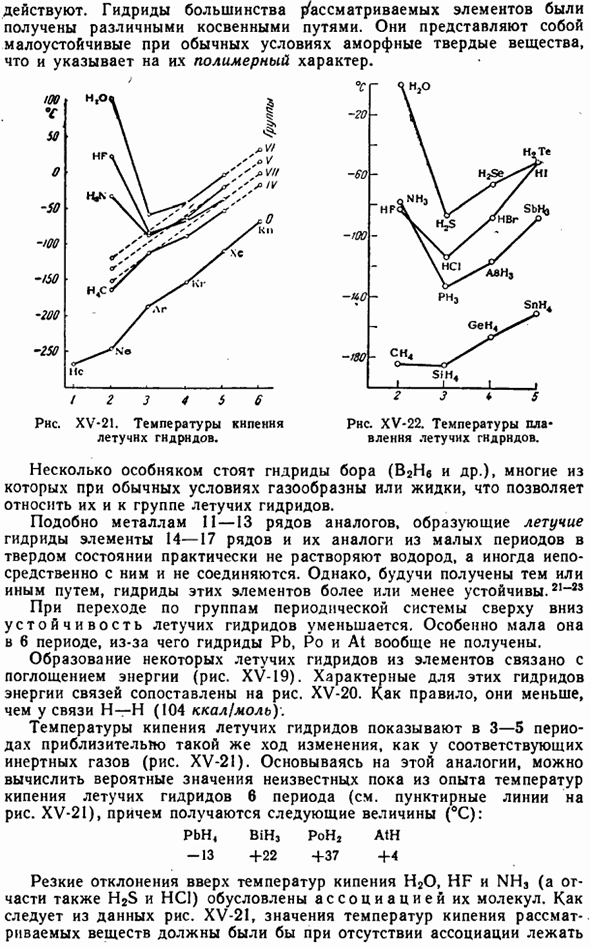
Однако, в отличие от водородного соединения, гидрид лантана представляет собой не бесцветный кристалл, а черный порошок, содержание водорода в котором зависит от давления и начинает уменьшаться даже при слабом нагревании. Обе эти ситуации указывают на то, что поглощенный водород частично находится в состоянии растворения, а не в состоянии химической связи. Поэтому планируется переход от рассматриваемого производного к группе гидридов металлов. 70 г по suhj НГТ » — J_I_I 12 7 и ТВ / U 7 71 7Р РНС. ХV-19.Теплота образования летучих гидридов (ккал / г ’ связи). РНС. XV-20.Энергия связи летучих гидридов (ккал / г связей).
Для водородных растворов в металлах 6-10 серий аналогов (и Cu) образование н-ионов уже нехарактерно. Напротив, частичная ионизация возможна в соответствии с равновесием: Н^Н+ -} — е. Поглощение водорода элементами этой группы, как правило, не приводит к образованию определенных соединений, но может сопровождаться увеличением объема металла (при сохранении характерного внешнего вида)), в отличие от элементов 3-5 рядов аналога, в этом случае повышение температуры обычно способствует увеличению содержания меди в образце.:
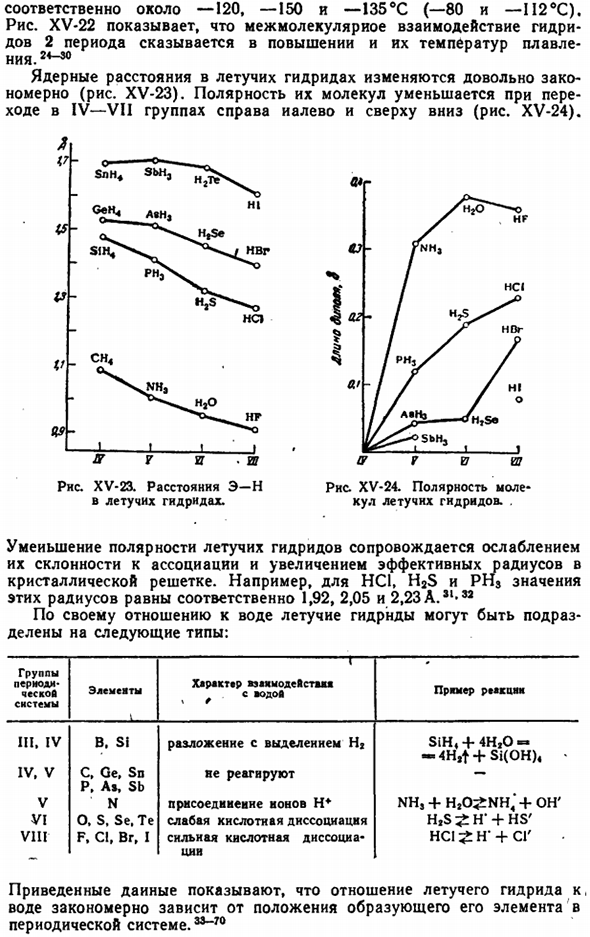
Температура,°С… 400620930 1033 1123 1225-1327 1550 Растворимость, см * / \ 00 г. 。 0.07 0.33 1.20 1.76 6.75 8.67 10.6 133 Важным исключением является палладий (рис. XIV-46). Элементы 11-13 серий аналогов (а также Be, Mg, B и A1) практически не растворяют водород(кроме Cu) и не взаимодействуют химически с водородом. Выступать на сцене. Гидриды большинства рассматриваемых элементов были получены различными косвенными путями. Они представляют собой аморфные твердые вещества, неустойчивые в нормальных условиях, что указывает на свойства их полимеров. 1 2 3 4 5 6 РНС. ХV-21.
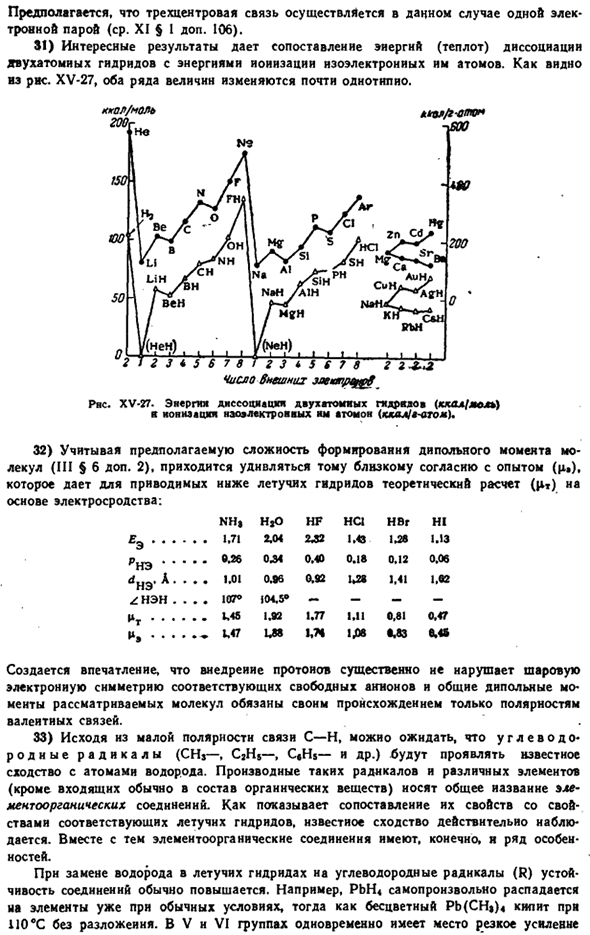
Изменчивая температура GNRnds. Я вру. — 1-Л-ЛИ 2 3 5 5 С(Н4 РНС. ХV-22.Температура пленки представляет собой Летучий гидрид. Гидриды Бора (такие как BrH®) несколько отличаются, но многие из них являются газообразными или жидкими в нормальных условиях, поэтому их можно классифицировать как группу летучих гидридов. Подобно аналоговым металлам серии I-13, летучие гидриды, образующие элементы серии 14-17 и их аналоги с малого периода в твердом состоянии практически не растворяют водород, а иногда и непосредственно связывают его с водородом. Но гидриды этих элементов, полученные тем или иным способом, более или менее стабильны.
Когда группа из 21 «25 периодических систем проходит сверху вниз, стабильность летучих гидридов равна reduced. It не принимается вообще. Образование некоторых летучих гидридов из элементов связано с поглощением энергии (рис. XV-19).Энергии связи, характерные для этих гидридов, сравниваются на рисунке. XV-20.As как правило, они меньше, чем bonds-bonds связей(104 ккал / моль\ Температура кипения Летучего гидрида в период 3-5 показывает приблизительно те же изменения, что и соответствующий инертный газ(рис. XV-21).
Исходя из этой аналогии, из опыта точки кипения летучих гидридов в 6-м периоде, мы можем вычислить ранее неизвестные значения вероятности (см. ломаную линию на рисунке XV-21), и получим следующее (°C):): PbH4 BiH, PoH, AtH −13 +22 +37 4.4 Резкое отклонение температуры кипения H20, HF и NH3(и частично H2S и HC1) вверх обусловлено связыванием их молекул. Исходя из данных, приведенных на рис. XV-21, температура кипения рассматриваемого вещества должна быть, если это не имеет значения, следующей: До и после—120, −150 и—135°С (-80 и—II2eC) соответственно. На рис. XV-22 показано, что межмолекулярное взаимодействие гидридов в периоде 2 влияет на повышение температуры плавления.
Ядерное расстояние летучих гидридов изменяется очень естественно(рис. XV-23).Полярность их молекул уменьшается при переходе группы от IV к VII справа налево и сверху вниз (рис. XV-24). Рисунок Xv-23.Расстояние E-H рисунок Xv-24.Полярность есть В летучих гидридах. Охлаждение летучих гидридов. Уменьшение полярности летучих гидридов сопровождается ослаблением их склонности к ассоциации и увеличением эффективного радиуса в кристаллической решетке. Например, для HCI, H2S и pH$ значения этих радиусов составляют 1,92, 2,05 и 2,23 а соответственно.
По отношению к воде летучие гидриды можно разделить на следующие типы: Группа элементов 1-1 периодической системы-характер реакции «F пример реакции» при подъеме с водой Раздел III. IV в. до н. Н2 разложения Си методом экструзии ЛПХ «+ 4Н, 0» — 4ч, Т + Си(Он) 4• IV, VC, Ge, не реагируют- Р,», СБ NHj + Н, О ^ NН4 + о ’ H +V N добавление ионов В. О. С. ЮВ. Эти слабые кислоты диссоциируют H, S H * + HS ’ VIII F, CI, Br, I кислотный диссоциатор-HCI Z n * + cr «» Приведенные штампы показывают, что отношение Летучего гидрида к воде естественным образом зависит от положения образующих его элементов в периодической системе. Добавь 1) рассмотрение соединений водорода, проводимое в настоящем разделе, носит общий характер и не касается индивидуальных характеристик отдельных газовых двигателей(описанных в соответствующих элементах).Существует специальная монография в ранге.
2) при определении эффективного радиуса H путем вычитания радиуса катиона из ядерного расстояния кристалла гидрида щелочного металла(XIII§ 1 add.96), вы получаете следующие результаты(а): Ках Рбх ч нах лих 3.19 3.02 2.85 2.44 2.04 1.85 1.49 1.33 0.98 0.78 •1.54 1.53 1.52 1.48 1.28 д Непрерывное уменьшение эффективного радиуса H с уменьшением радиуса E * происходит за счет увеличения деформации анионов. Исследования распределения электронной плотности в кристаллах LlH показали, что эффективный заряд lntn и водорода оценивается в+0.62 n −0.52, respectively.
In расчет молекулы ИГИЛ по электричеству, он составит±0,43. 3) при нагревании все солеподобные gndrnd (за исключением LiH, температура плавления 668°C, отсутствие разложения) начинают разлагаться на металл и водород еще до достижения температуры плавления. Для производных Na — > — Cs начало замечательного разложения находится при 300-350 ° С, для гидридов и щелочноземельных металлов-около 600°С. Термическая диссоциация последнего включает образование водородного раствора осажденного металла и приближается к переходному гидриду. 4) упомянутый в тексте относится к аналогам прямого взаимодействия водорода и металла 6 4-10 series.
At в то же время, используя различные косвенные методы, включение krnallallosolvate WH «(VIII $ 5 add.20) и комплекс элементов ra и соответствующих элементов, включая H. наиболее отличительным из них является annon ReHj.〜 ) 5) интерметаллические соединения («неметаллы»), обнаруженные в сплавах с помощью термического анализа (XI§ 3), очень близки к продуктам взаимодействия металла и водорода 10 аналогов. Например, как видно, в большинстве случаев состав энтропийных соединений существенно не связан с обычной валентностью элемента. Из следующего сравнения некоторых простейших выражений типа AB: SbSn,.Сиб!»PbPd * Лаал * ThMg * RbHg * Строймеханизация» AuZn * ХГ * CaZn10. KCd», NaZn, * MgBei9.
In в одной и той же паре элементов чаще всего наблюдается образование не только 1, но и нескольких интерметаллических соединений. Например, Ka предлагает следующие серии с использованием Sn и Hg. Насн»Насн, Насн, Насн, Насн Na4Sn, НС СН НС СН НС СН НС СН»NaHg4 NaHg, На NaHg Хге НС, НД, NafHg, НС, НД Из первого ряда только 2 соединения (Na * Sn и Na» Sn) соответствуют нормальной валентности элемента, а 2-е соединение имеет nothing.
In в этом отношении (и с точки зрения свойств) неметаллические соединения сходны с некоторыми металлами * Hurd D. введение ■ химия Министерства внутренних дел.-Я не уверен, что делаю, — сказал он. ред. А. Ф. Жягаяа. Москва, Издвт-Шн.1ИТ, 1965.238 С. Мееяж В. И. Гндрнды переходного металла. М.. Академии наук СССР. 19. 211 страниц М-К Е йк. Водородное соединение металла. С английского, Изд. В. И. Мнхеево А. М.. «Мир», 1968. 244р. Д. С., пр-Мибу-гидридные. М..«Химия», 1969, 876 секунд、 Ж ■ га Ч. А. Ф. С Производных углерода, кремния, Б., Как и другие элементы с характеристиками относительно слабым полуметаллов.
Имеется обзорная статья о соединениях металлов и специальная монография. в) многие неметаллические соединения образуются из элементов со значительным нагревом. K + 2 HG KHgj- + 20 ккал Au + 3 zn AnZn,+ 4 ккал Na + 2Hg-NaHg, + 18 ккал Au + Zn-AnZn + 11 ккал Na + 2Cd = NaCd,+ 31 ккал 2Au-f Zn-Au3Zn + 24 ккал Интересные наблюдения были сделаны в системе Ag-Sn (pr 975°С).Смешанная жара обоих металлов может быть до 65 на Sn. It было установлено, что% является отрицательным и чем выше концентрация олова, тем более положительным он является.
7) образование неметаллических соединений может быть результатом других химических реакций в растворе. Например, при взаимодействии Zn (CN) i с металлическим натрием NaZn4 осаждается в жидком аммиаке. Реакция протекает по уравнению: 4Zn (CN) 2 + 10Na = 2NaZn <+ 8NaCN. Аналогично действие Pb на раствор натрия в жидком аммиаке приводит к образованию белого осадка Na4Pb, который, вследствие перехода Na Na-Pb, растворяет Pb в избытке и снова (в жидком зеленом).
Структура группы Pb соответствует треугольной призме, содержащей атомы свинца относительно прямоугольной плоскости по углам. 8) кристаллические решетки отдельных неметаллических соединений бывают самых разнообразных типов. Поэтому SbSn может быть типа NaCI(rns. It кристаллизуется в соответствии с XII-12), InSb имеет тип NiAs(rns. Xsh-79), Mg, Pb кристаллизуют согласно типу CaF (диаграмме XI1-37) и так далее. Соединение растворяется без разрушения. То есть он очень стабилен не только в твердом, но и в жидком состоянии state.
In кроме того, температура плавления соединения может значительно превышать температуру плавления отдельных составляющих металлов. Например, Li плавится непосредственно при 180 ° С, Bi-Bi плавится непосредственно при 271 ° С, LiBi плавится при 415°С, а LisBi плавится только при 1145°С. 9) образование соединений металлов обычно сопровождается более резким снижением электропроводности системы.
Поэтому относительная (Hg = 1) электропроводность магния составляет всего лишь 22, олова 8, Mg2Sn 0,1.Этот сустав (mp. At 778 ° С), по-видимому, сосуществуют неметаллические и металлические связи. Более отчетливо выраженная не-буква — это очень хрупкое желтое соединение состава MgHg. 10) при приложении постоянного тока к жидкому сплаву из 2 металлов с высокой электропроводностью он, как правило, перемещается к катоду и не перемещается к катоду. anode.
In интерметаллические соединения, электролитическое разделение элементов часто осуществляется строго по закону электролиза, то есть обычными солями. Например. При электролизе Na4Pb, растворенного в жидком аммиаке, в катоде выделяется 4 атома натрия, а в аноде-9 атомов свинца. 11) интересные наблюдения были сделаны при прохождении некоторых факелов по некоторым амальгамам. Таким образом, в амальгама Ли и Би, мы всегда даем катода и висмута к аноду.
Для амальгамы Na, K I ситуация иная Ba. At при низких концентрациях растворенных металлов (2 и ниже соответственно 2,5 и 2,7%) они накапливаются на аноде, а при более высоких уровнях-на катоде. Судя по этим результатам, можно считать, что это не обычный электролиз, а электрофорез коллоидных частиц, образующихся в сплаве, причем изменение направления движения происходит за счет перезарядки.
12) отсутствует общая теория, объясняющая состав соединений металлов и указывающая границы образования. Заметим, что отношение суммы валентных электронов к числу атомов встречается очень часто * о ш и Р О Н И.. Вольф Б. К.. Успех чииии, 1 ″ 59. > ФК.10.1086. Я думаю, что это будет отличная игра. И. и успехи в химии. 1965,.В» Я, 103. * * Корнилов И. И. мета-аттракцион и взаимодействие между ними. М. «Наум», 1964.] 81 секунда、 21: 12 в 1.75(так называемая фаза. Например, CuZn, Cu3Sn, Ag5Als), 21: 13-1. 62 (для фазы g.
Например CusZn, КР «А14.FcsZn2i) nln 21: 14, 1.50 (так называемая фаза 0, например CuiAl. CujSn, CoAI), и 1 другие неметаллические металлы, которые характеризуются эквивалентно этими „электрическими электродами“, обычно кристаллизуются таким же образом. Однако следует отметить, что валентность, обусловленная металлами, не всегда совпадает с обычной валентностью(например, элементы триады большинства интерметаллических соединений считаются валентностями). 13) в большой период члены аналогов одного ряда(например, Zn, Cd n Hg) обычно не дают соединений друг другу.
Поэтому для образования азотнокислых металлов необходимо, чтобы между свойствами обоих элементов было большее расхождение, чем у them. It делается в аналогичной строке. Однако это расхождение не является существенным. Например. Mg уже дает соединение N кальция (CaMgj). n и цинк(MgrZn * MgZn, Mg2Zn $.Мгзн? это не. Интересно, что все щелочные металлы, которые вообще не соединяются с медью (а дают только серебро и NaAg2), образуют соединения с золотом. 、
14) С другой стороны, объемное соотношение, по-видимому, играет важную роль в образовании интерстольного соединения. Это особенно заметно в амальгамах щелочных металлов. При переходе по ряду Li-Cs n в Формуле 3Hgn имеет тенденцию к увеличению, и в то же время стабильность соединения смещается в том же направлении. 15) некоторые соединения стали NTSC будут введены в практическое использование в ближайшее время.
Например, кусок металлической зубной пломбы часто получают путем смешивания порошка AgsSn с ртутью. Последующее упрочнение уплотнения обусловлено реакцией по схеме AgjSn-f 4Hg = AgsIIgt + Sn. 16) изменения, которые иногда встречаются в магнитных свойствах сплавов, связаны с образованием неметаллических соединений. Например, немагнитный сплав 30% Mn Cu при введении элементов dax, таких как A1, Sn, As, Sb и Bi Bi.
Ни один из перечисленных выше металлов не является ферромагнитным, но они прочнее. До достаточно высокой температуры(178 ° С) интерметаллическое соединение Mn » Sn » сохраняет ферромагнетизм. 17) особый интерес представляет интерметаллическое соединение MnBi. Это связано с тем, что при введении его мелкодисперсного порошка в пластик (под воздействием направления внешнего магнитного поля) создается мощный постоянный магнит любой формы, который легко справляется с последующей механической обработкой и непроводящим током.
Для получения Мнби очень чистый исходный металл измельчают до мелкого порошка, затем выдерживают до температуры плавления висмута и снова измельчают(все эти манипуляции проводят в атмосфере гелия). 18) так как есть элементы, которые вообще не поглощают водород, то известны металлы, которые почти не растворяют друг друга в жидком состоянии.
- К ним относятся, например, следующие пары: АГ-Фе АГ-Со Компакт-Аль-Т1 Фе-ПБ К-А1 Н-Ал К-Мг CR-Фе Би-Би Часто расплавленный металл смешивается только partially. In в таких случаях тугоплавкий металл обычно более растворим и менее растворим, чем он. По-видимому, соотношение объемов также играет важную роль. Поэтому растворимость других металлов в железе обычно больше, поскольку разница между атомным радиусом Fe и растворенным металлом меньше.
Но в большинстве случаев металл в жидком состоянии полностью смешивается. 19) образование широкого спектра твердых растворов в системе из 2 металлов (XI§ 3 add.6) наблюдается только при определенных условиях: металл должен иметь одинаковую кристаллическую структуру с различным атомным радиусом менее 15% (XII§ 2 add.45) химически похожи друг на друга.
Даже частичное нарушение этих условий приводит к резкому сужению области существования твердых растворов. Людмила Фирмаль
20) для металлов, которые не образуют серии твердых растворов, были предложены следующие серии для взаимной растворимости в твердом состоянии: Na. Цинк. Компакт-диск. Га, Би, Ге. СБ, Ас. Рт. Ст., ЗП. Си, Mg. Li-Ба. В, Тл, ПБ, ООО, Центр Сертификации, Быть, МН, Или, Ре, Вт, Ср, КР, В, ТС, ИП, Ру НБ Совместно. Ти, ХФ, Ни. Ос. ЗР, ИК, Пт. О. У Резус. Се, ПД, АГ. Th. 1) Металл слева обычно более склонен к плавлению, чем металл справа, чем сзади,
2) Чем дальше находятся 2 металла, тем сильнее металл, образованный ими. 21) радикалы и молекулы Gndrnd, образующиеся при непрерывном добавлении водорода к легким элементам группы IV-VII РНС. XV-25-так называемый закон замещения гидридов. Этот рисунок ясно показывает, что при добавлении водорода исходный атом становится аналогом атома на правой стороне nx, как он есть.
Например, молекулы FH, OH2, NHs и CH являются аналогами » Ne, OH, NH*. Ча-галоген и так далее. Существует этническое сходство в некоторых отношениях (оно в основном связано с числовым значением валентности).Например, в структуре органических соединений радикалы OH, NHa и SNE соответствуют 1 атому галогена, а радикалы NH-связанному атому кислорода, а радикалы CH-1 атому азота.
Следующее сравнение соединений служит иллюстративным законом замещения гидридов. О ^ Нен ХН = Н-«Н ВАК = Н»Н Закись азота 22) особый интерес представляют комплексы, в которых неионы аммония (NHJ), оксония (OHJ) и фторония(FHJ) подобны катионам щелочных металлов. Стабильность этих ионов в вышеприведенном ряду быстро снижается: солнечного аммония очень много, но оксониевые соли уже мало известны, а производные фторония в отдельных состояниях вообще не выделяются, и жидкое фторирование(например, IX§ 6 add.45).
Когда HF растворяется в 100% серной кислоте, также показано, что частично образуется нефтор. 23) расчет распределения электроэнергии в не-NH *и OH *по величине электро-пролекарства (§ I дополнение.34) приводит к следующему results. bn■ » +0.29. «»«- 0,16 для аммония, 6H = » + 0,42, 6o-для oxones-0.26.So, несмотря на добавление протонов, центральный атом в обоих случаях сохраняет избыточный отрицательный заряд. 24) Ассоциация молекул, характерная для некоторых летучих гидридов, происходит главным образом за счет образования водородных связей(IV§ 3 add.7).
Эти связи становятся асимметричными из асимметричных(то есть положение центра водорода относительно обоих атомов регулируется ими).Если все остальные равны, то первый характеризуется гораздо меньшей общей длиной (то есть расстоянием между ядрами координирующих атомов) и гораздо большей энергией, чем последний. Для производных кислорода асимметричная водородная связь O_H * «0 (иногда называемая гндрокенилом) обычно имеет длину около 2,75 а, а симметричная 0-H ’» 0 составляет около 2,5 А.
25) нет особых трудностей в интерпретации асимметричных водородных связей. Когда атом закрыт, усы атомарно объединяются и координируются дальше. С появлением 2-й связи интенсивность первой связи несколько уменьшается, что влияет на волновые числа, характерные для O — H связи в частности. Например, по Рамановскому спектру индивидуумов IV V VI UP 0 I C / N / A / g|N \ \ \ ч CH NH OH TI ^ ^ Спать〜 ч ч ч ч ч ч ч * sn3 NH, OH3 Валентный 4 3 2 1 0 1 Рисунок Xv-25.Закон замещения гидридных дверей. Двойные молекулы H20 (пары) o-3652 slug; в жидкой воде волновое число уменьшается до 3448 scch, а во льду — до −3156 cmgh.
26) В случае симметричных водородных связей ситуация сложнее, и существует 2 основных подхода к проблеме их природы. По словам одного из них. Симметричные водородные связи по существу являются донорными акцепторами и в основном ковалентны. Например, ВЧ»Ион» с этой точки зрения изображен Схема [: Ф: Ч *. Ф.]: Однако для того, чтобы действовать в качестве акцептора, необходимо использовать водород с энергетическим уровнем 25, что выступает в качестве решающего возражения против решения проблемы.
Согласно другим взглядам Симметричные атомы водорода следует считать чисто ионными, и это не относится к ионным HF—♦- Дайте структуру (FHF) -. 27) Энергия образования HF » HF andnoi из F-оценивается в 37 ккал / моль, поэтому средняя энергия связи H-F составляет (135 + 37): 2 86 ккал / моль. Для частоты растягивающей вибрации эта связь задается. Значение 1450 см —% (для молекул HF-3960 см-1). Экспериментально определенное распределение электронной плотности Иона HFJ (на основе данных реконструкции) показано на рисунке. ХV-26.
28) синтез обеих вышеприведенных точек зрения, очевидно, является наиболее точным: подобно другим сложным связям, симметричный водород может рассматриваться как результат сочетания электростатических взаимодействий и общих взаимодействий(IX§ 2, 3).Использование уровня 25 в этом случае не требует энергии возбуждения. Это происходит потому, что протоны являются акцепторами чужеродного электрона pairs. In при наличии гибридизации с теми, что существовали раньше, вокруг протона создается новая молекулярная орбиталь, и ее больше нет. Соответствует квантовому уровню изолированного атома водорода. ^ /
То же самое относится и с точки зрения теории молекулярных орбиталей: симметричная водородная связь X — — — H — — — X-образование связи включает в себя 3 электронных орбитали, а также связи и связи, и 2 пары электронов связи, 1 из которых занимают орбитали связи, а другой 1 binds. In этот подход, обычная симметричная водородная связь(включая положительный водород) и характерная бридковская связь (XI§ 1 add.86) структурные различия формально сводятся к тому, заполнять или не заполнять несвязанные орбиты. Обзорные статьи * и специальные монографии* * доступны с водородными связями.
29) полярность не-HF связи рассчитывается как » значение электрического сродства (Jan■■0.50, Et = 2.32), мы получаем par ** 0.65.Это позволяет bg- «-0.65,’ bn +0.30.In аналогичный расчет с использованием молекулярно-орбитального метода, в 1 случае 6m −0.78 и ba +0.56 были рассчитаны с другими 6b −0.57 и 6n = +0.14. 30) рентгеноструктурные исследования последних лет выявили много интересных примеров, в которых водород функционирует как центральный атом.
Следовательно, комплекс типа 1EAaG/] NG-2HU(E-Cr, Co или Rh. In a-En или Dipy, G-Cl или Br), кристаллы заполнены ионами[Hjohhj] (X. см. § 2).Дополнительные 63). [As (C» H) 4lHCIj]и взаимодействием с кнкс жидкости SO, (A $(CeH$) 4) [H(NCS) aJ. Сложный анинон (N(CiH6) 4I(CO) 5CrHCr (COM) симметрично координирован 2 атомами металла[d (ClC) e 3.41 A]. Рисунок XV-26-распределение электронной плотности в нагрузке HFr. * Н Е и Р О Ж, уел » хммхямяи. Я Ж «М 5. 606. Д.. Ми-Кледдав о, водород » вспомни, Пер, из Аяга, Ри. Б, М, Culvnoyuyuso, М.£»Myar,» 1864, стр. В этом случае предполагается, что 3-проводная связь осуществляется в 1 электронной паре(см. XI§ 1 дополнительно 106).
31) интересные результаты получены путем сравнения энергии (теплоты) диссоциации двухатомного гидрида с энергией ионизации электронного атома и электрона. like. As как видно из рисунка XV-27, оба объема серии варьируются почти равномерно. KKOP / MQflb 200 2 3 b 5s 7 8 2 Внешний номер Ряса. ХV-27.
Энергия-это диссоциация двухатомного гидразида » (cl / mol) и ионизация самого атомарного атома (kAAl / m atom) для них. kkar / g-oyayu » — £00 32) учитывая сомнительную сложность образования дипольного момента молекулы (III§ 6, 2), мы удивляемся, что он близко совпадает с экспериментом (с.). NH / H, HBr 0 HF HI £ er …… 1.71 2.04 2JS2 1.43 1.26 1.13 п ^ —… 0.26 0.34 0.40 0.1 с 0.12 0.08 Жесткий диск МВБ. А. •. 1.01 0.96 0.82 л » 2Т 1.41 л. Два З НАН…. 107°104,5 «—- / низкотемпературный. ……….. Австралия 1.48, 1.92, 1.77, 1.11, 0.81, 0.47 С.,…… 1.47 C88 1, * 1.08 T. 83 8.4 *
Поглощение протонов существенно не нарушает сферическую электронную эквивалентность соответствующих свободных анионов, и полный дипольный момент рассматриваемой молекулы, по-видимому, обусловлен только полярностью валентной связи. 33) на основе низкой полярности связи C-H углеводородные радикалы (CH» -.C2H$ -, C»H$ — и др.) можно ожидать проявления определенного сходства с атомом водорода.
Такие радикалы и производные различных элементов(обычно, кроме тех, которые входят в состав органических веществ) в совокупности называются органическими магнитами compounds. As сравнение их свойств со свойствами соответствующих летучих гидридов показывает, что известное сходство на самом деле observed. At в то же время соединения органических элементов, безусловно, имеют ряд особенностей. Замена Летучего гидридного водорода углеводородными радикалами ® обычно улучшает стабильность соединения.
Например. PbH разлагается естественным образом даже при нормальных условиях, но бесцветный Pb (CH$) 4 кипит при 110°C без degradation. In в группах V и VI он резко возрастает одновременно. Дополнительная тенденция реакции. Например, AsH $не подключается к HI. С другой стороны, As (CH3h) легко связывает молекулу ch31 с образованием комплекса[As (CHj)<) L. иногда замещение водорода углеводородными радикалами приводит даже к увеличению максимальной валентности element. So, в случае фосфора gndrnd мы получили не RH$, а бесцветные кристаллы P (C » H$) 5 (mp.124°с) Известно.
34) Как правило, Органоэлементные соединения наиболее характерны для мелкопериодических elements. In длительный период, он гораздо более характерен для атомов с электронной структурой (3-10 рядов) во внешнем слое слоя 2 (II〜18 рядов аналогов), чем для атомов с незаконченной структурой (10 рядов).
Для энергии связи E-C соединений типа E (CH) приведены следующие значения (ккал / г связей): (!••••»•*1 и 2 Ух…….. Литий 2Н кд НД 57/41 33 28 Три В Г»В П Как СБ в! 8083 57 40 65 52 50 34 Четыре St Ge Sn Pb 73 62 64 37 Обычно энергия связи углерода и металла определяется E-C? Н И Ч Е — — — — Ч»<Е-С? Он изменяется последовательно, как H $ <E-CFj. In кроме соединений, в которых все валентности заняты углеводородными радикалами, для многих элементов характерно образование продуктов неполного замещения ими. 35) в щелочных металлах гидриды, как и их соли, более стабильны, чем соответствующие углеводородные соединения.
Последний обычно самопроизвольно воспламеняется в воздухе. А так как они очень бурно реагируют с водой, то часто наблюдаются взрывы. Много Ли — В КС повышается химическая активность углеводородных производных. Относительно стабильным является белый кристаллический литийэтилен (LiCtHj), который растворяет prn 95®С без деградации(в то время как NaC? H $ около 100°С, разложить на NaH nC, Н4).Этил лития легко растворяется в бензоле (около 70 г / л), LiC»H $слегка плавится, а LiCHj-нет. Все 3 соединения характеризуются полимеризацией, и значение n в Формуле (UK) зависит от природы и условий полимеризации. R. In в частности, пар LiCaHs (сублимированный в вакууме при 70°C) состоит из почти такого же количества гексамера и тетрамера.
Для аналогичного тетрамера (LiCH3) 4 атом лития образует обычный тетраэдр[4 (Lic) α= 2.56 AJ, а метильная группа расположена в его плоскости[rf(LiC)= 2.28 A). Известны также алкиллитиевые производные типа mjlira. Где M-Na, K, Rb, Cs, R-CHj, CeHs и др. Для кристаллов kch3 было подтверждено наличие ионной структуры с решеткой типа K *(CH3)〜NiAs(рис. X11I-79). интересным алкильным производным натрия является NaCH CO coma, который был получен сплавлением ацетата натрия и NaNHj (pr 200°C). 36) алкильные производные не обладают свойствами меди и серебра.
В желтом-Cu-3-только стабильном ниже 50°C, связь Cu-C характеризовалась значениями d 2.2 A и k = 3.0. CUC * немного устойчив, и при нормальной температуре он постепенно превращается в черную массу, а при нагревании до 80°C со взрывом разлагается на медь и DNF. Этот бензол нерастворимое вещество медленно гидролизуется в Куджо и бензола водой. Столь же нестабильны и аналогичные производные серебра. 37) щелочное соединение одновалентного золота было получено в виде бесцветного миомного комплекса с триэтилфосфиновым типом (CiH3) 3PAuR(температура плавления метиловых, этиловых и фенильных производных составляет 62. 57 и 68 V).О трехвалентном золоте гораздо разнообразнее.
Желтая маслянистая жидкость Au (CH3) 3 уже распалась при prn −35°C, но Белый растворимый эфирный Кристалл [[(CH3)$ AuljEn]в комплексе с этиленовым рендамином очень стабилен при нормальной температуре и быстро разлагается примерно при 95°C. Наиболее широко выраженными являются бесцветные dn-алкильные производные общего типа RjAuX(X-CI, Br, I. такие как CN). из nnh галогениды являются димерами (включая Галогенидный мостик), а n- * au донорно-акцепторная связь тетрамера представляет собой плоское кольцо, образованное при участии N — * Au донорно-акцепторной связи.
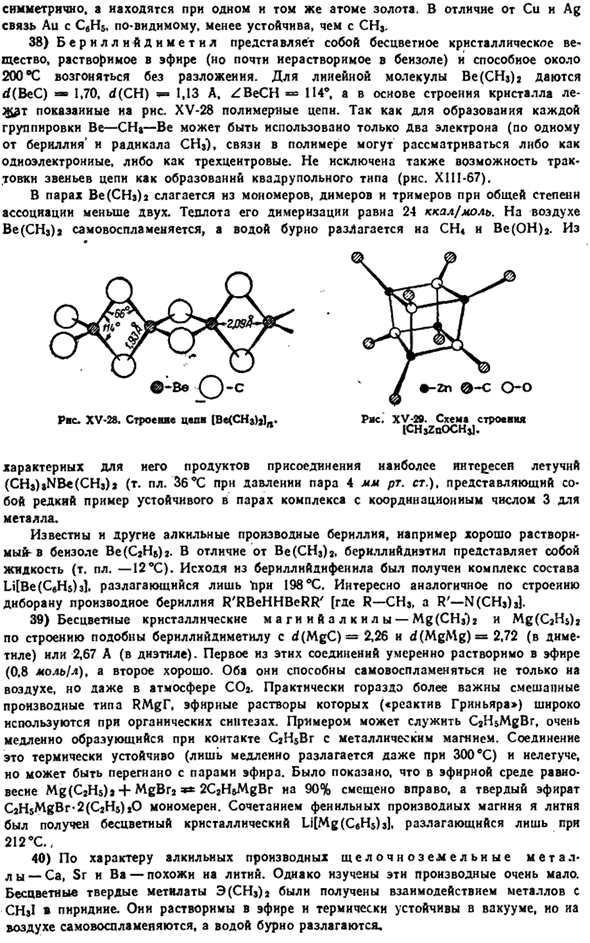
Йодид растворяет pr 79 С с и превращается в очень взрывоопасную жидкость красного цвета. интересно, что темно-красный димерный моноалкил фраутии также содержит Галоидный мостик, и оба R не расположены Он симметричен, но в тех же самых атомах золота. В отличие от Cu и Ag, связь между Au и CBH $явно более нестабильна, чем CHj. 38) берилл — диметил представляет собой бесцветное кристаллическое вещество, которое растворяется в эфире (но едва растворимо в бензоле) и может быть сублимировано без разложения при температуре около 200°C. На рисунке 2 показаны rf (BeC) −1.70, d (CH) −1.13 A и ZBeCH 114°.
Структура полимера, показанная на рисунке XV-28, является Be, поэтому она основана на структуре кристалла le-Ch & T. — CH» — то есть можно использовать только 2 электрона(из бериллия и радикала CH * 1 каждый).Связь внутри полимера можно рассматривать как один электрон или 3 процента (не исключена возможность интерпретации звена цепи как квадрупольной структуры (рис. XII1-67)). Пар (CH3b3 состоит из мономера, dnmers и trimer, полная степень соединения чем 2.Теплота димеризации составляет 24 ккал! Mol. In воздух, Be (CH9) самовоспламеняется и яростно распадается с CH » n Be (OH) 2.От Правая сторона. ХV-28.Структура мишени[Be (CH.).] a. Рже. ХV -«.
Схема строительства * iCHjZnOCHj]. Летучий (CHj) NBe (CH3) a (точка плавления Zb * C при давлении пара 4 мм рт. ст.) является наиболее интересным продуктом присоединения и представляет собой редкий пример пароустойчивого комплекса с координационным числом металла 3. Другие алкильные производные бериллия известны, например, бензол (с«НВ) 2 хорошо растворим. В отличие от Be(CHs) 2, берилниднатл является жидкостью (mp −12°С).Композиция LilBe(CeHsbl. Разложение «только 198 X» было получено из bernllidiphennl. Интересны производные бериллия R’behhberr ’[где комплекс R-CHj и R’ — N (CHj) s), интересна структура Деборы.
39) бесцветная кристаллическая формула-Mg (CH$) j и Mg (CjHs) a аналогична по структуре Бернскому диметилу С d (MgC)= 2,26 и d (MgMg)= 2,72. (Днм-Тил)или 2,67 в(ДНТ).Первое из этих соединений плохо растворимо в эфире(0,8 моль / л), но второе-хорошо. Оба могут самовоспламеняться как в воздухе, так и в атмосфере CO*.Что еще более важно, это смешанное производное типа RMgI, и его эфирный раствор (реагент Гриньяра) широко используется в органических synthesis. An примером является QHsMgBr, который образуется очень медленно, когда CjHjBr вступает в контакт с металлическим магнием. Это соединение термически устойчиво (оно только медленно разлагается даже при 300°C), нелетуче, но может быть дистиллировано эфиром vapor.
In эфирная среда, равновесная Mg (CjHs) » + MgBra 2cjhfrmgbrs сдвинута на 90% вправо, что указывает на то, что твердый эфир C2HsMgBr-2 (CjH$) является мономером. Бесцветный кристалл Li [Mg (C» H $3], разлагается только в том случае, если 212°с 40) благодаря свойствам алкильных производных щелочноземельные металлы (Ca, Sr и Ba) аналогичны литию. Однако эти производные практически не изучались.
Бесцветный твердый methyreate е(че), а был получен в результате взаимодействия металла с CH1I » пиридин. Они растворяются в эфире и термически устойчивы в вакууме, но самопроизвольно и бурно разлагаются на воздухе. 41) В отличие от аналогичных производных бериллия и магния, цинк-днметил (Мп 29,МП 44°С) представляет собой единую молекулу рения, а молекула Zn (СНТ) линейна.
Символы в Zn(CaH5) одинаковы (mp.-34, депутат.117 * С).Оба они самопроизвольно воспламеняются в воздухе и бурно реагируют с водой. Zn(C * H)) s несколько менее активен (mp 107, mp 283°С).Образование комплексов типа M (ZnRj) (M-щелочной металл) характерно для циклических соединений. Примером может служить бесцветный M [Zn(C, H$)].Где М-ли (Мп.-10), Na(27), K(70).РБ(73 * С).
Также был получен LiJZn (CHE)<).D (ZnC) в Кристалле −2.07 A, a ^ CZnC = 105-112°.Известно производное Рзнт, аналогичное производному магния (менее химически активному).Его структура-это интересно(CHjZnOCHs) 4.Как видно из рисунок XV-29, основой его структуры является искаженный куб с чередованием цинка и кислорода атомов в углах[д(ОУ) «1.44, д(выбрано исключительно для удобства визуального)* = 1.94,д(ЗНО) −2.09 А. ZZnOZn»96е, ZOZnO-83°). 42) Cdr3 Cd m и d-ДНК alknls сходны с аналогичными производными цинка, но обладают низкой летучестью, термостабильностью и химически active.
So Cd (CHj) 2(mp −2, mp.106°C) и Cd (CjHe) j (mp.-21°С) не воспламеняется самопроизвольно в воздухе, но и не воспламеняется 2-й. При хранении, он будет постепенно разлагаться. Кристалл компакт-диск (с Ч ч$) дж(МР 174°С) является более стабильной и может сформировать литий [кд (ЧЬХ $ л]комплекса. Некоторые производные RCdX также известны. 43)большое количество ртути d-щелочи HgR2 известно давно и часто используется в синтезе алкильных производных других металлов(например, схема Mg-f-4-Hg(CHj) a = Mg (CH) j + Hg).
Они устойчивы к действию спирта, эфира, растворимых в воздухе, воде, щелочи и слабых кислотах, а также НД(СН$) J и НД (CjH5) J являются нормальной жидкости при нормальных условиях(Мп.92 n 159 * C), Hg (C»Hs) h-твердое вещество (mp 125°C).Наиболее важный, особенно практический, диметилртуть получают, воздействуя амальгамой натрия на метиладд: Hg + 2CHjI + 2Na = 2Nal-f-4-Hg (CH$) J. его молекулы линейны(d (HgC) 2.23 A]и имеют схему CH, HgCH,-*-Ch«Hg +СН, и ch5hghg +СН, GC диссоциации на 51,3 и 5,5 ккал / моль (300°с).Пары щелочных производных ртути очень токсичны.
44) производные Алклов типа RHgX с очень разными X очень характерны для ртути, и их энергия связи Hg-C обычно выше, чем соответствующие d-арквонолы. Например, для CH * HgX существуют следующие значения (ккал / г-связь): 64 (C1), 61(Br), 58(I). Молекула ch3hgt характеризуется линейной структурой с параметрами d (HgC) и d (HgO, соответственно 2.06 и 2.28 (C1), 2.07 и 2.41 (Vg), 2.09 n, 2.53 A (I).Учитывая c = 1.30. В зависимости от природы х рассматриваемые соединения являются ковалентными связями (такими как CI) и солеподобными (такими как NO).Как правило, оба являются достаточно кристаллизованными твердыми телами.
Например, производное метилртути-CHjHgX-имеет следующую температуру плавления (®С): F A Br I CN NO, he 20E 167161153 S3 also 137 Фторид и нитрат (и перхлораты) очень растворимы в воде, а остальные галогениды(и цинк) незначительны. Водорастворимый гидроксид CH3HgOH является слабым основанием (K * «3-I0′ 10). 45) несколько более сложным производным мойоалкилртути является, например, (CH, Hg), 0 и [(Ch» Hg)» 0] BF(XII§ 4 add.79).Представляет интерес наличие прямой валентной связи тантала и ртути(в последнем CN 7) (CjHjHgTafCO)*.
Взаимодействие ртути с йодоформом было получено в HC (Hgl).Это вещество, нерастворимое в обычных растворителях, интересно тем, что содержит, по-видимому, меньше углерода (1,2% по массе), чем другие органические соединения. 46) в отличие от Hg Hg, образование органических производных^не происходит characteristic. It описывается только серо-фиолетовое циклическое соединение 0 (CH2CHa) 2Hgj, которое является стабильным до 140 ° С. 47) химия органических соединений бора в настоящее время развивается быстрыми темпами.
Простейший-B (CH3) s-представляет собой бесцветный газ(Мп.- 153, Мп.-22 * 0, определение плотности его пара, который устойчив к воде и скудным соединениям, но активно окисляется на воздухе (вплоть до самовоспламенения), показывает простую формулу(в отличие от Банв).Молекула B (CH3) j имеет структуру плоского треугольника(ZCBC = 119,4°) с параметрами d(BC)= 1,58,d(CH)=1,11 A и ZBCH = 112 E. подобно B: H и BFj, метил Бора легко связывается с аммиаком и образованием бесцветных кристаллов(CH3) sBMH3 (mp 56°C).Литий литий представляет собой комплекс состава Li [B (CHs) Alpha].
Другой простой Борал убивать-это жидкость Б (ВГН) е (МП) при нормальных условиях.-93.ВР.95°C) и твердое тело B (SbH), (mp 142 M).Мы используем водорастворимый комплекс Na [B (C «H5)»] для осаждения K, Rb и Cs *(растворимость тетрафенбората при 20 составляет 53 (K).18 (Rb) или 13 (Cs) мг / л аниона lB(C» He) J-содержит атом бора в центре тетраэдра атома углерода[d (CC)= 2.46,d( BC)-1.51 A], структура бензольного кольца равна * dio: d(CiCa)= 1.43,d (CjCj) −1.38. < F (CjC») −1.40 A.
В связи с наличием прямых B — B связей представляет интерес желтая соль Ng [CeHv] 3BB (C»НbЫ, которая легко растворяется в Тетрагидрофуране). 48) В отличие от бора (а также Ga и In), оксид алюминия образует простейшие алкильные производные, соответствующие уравнению димера A12r. In в частности, это относится А1(СН3)»(15 Мп, Мп.126°с), 70 ° с молекулы существуют в виде полностью димеров, а при 156°С они диссоциируют на 35%.
Энергия диссоциации димера составляет 20 ккал / моль, т.? e. только немного меньше, чем у Галогенида алюминия(XI§ 2 дополнительные 52). Параметры молекулы A1 (CHa) составляют d(AIC)= 1,96,d(CH)= 1,11 A, ZCA1C = 120e. ZAICH = 112e. пространственная структура молекулы димера A1 *(CHe) показано показана на рисунке. XV-30 [d (AIA1) 2.62 A].для интерпретации такой структуры мы обычно используем понятие 3-центрового соединения A1CH * A1.
Однако не исключена интерпретация этих связей как структуры квадрупольного типа в виде отдельного электрона или комплекса в целом(см. рис. XIII-67). Auchihs») «(Мп.52, Мп. На 207°с), dnmerizacin тенденция А1 (CHJ успешно) J и А1 (СБХ$), (mp230® С)-по-прежнему слаб. Весь алкил алюминия быстро окисляется (вплоть до самовозгорания) в воздухе и быстро разлагается (взрывается) на Al (OH) j и соответствующий углеводород. Акцепторы: есть также несколько известных двойных соединений с алкилом щелочного металла, таких как LiAU, который производит сильные комплексы с молекулами донорного типа (Амины, zfirs и др.). CiHsh(Мп 160°г).
Структура этого вещества, по-видимому, состоит из типичного Li [AI (CtH5) 4] n-цепного полимера d (LiAl)= «2.30 A]и моста из n-алкильных групп (d (LiC)= 2.02), чередующихся атомов Li и A1.РФ (ОДО)= 2.32 а].Алкилалюминиевые производные в основном используются в качестве катализаторов полимеризации этилена и аналогичных ненасыщенных углеводородов. 49) алкильные производные галлия, индия и таллия обычно являются мономерами. Это, в частности, Га (ч), (16 Мп, Мп 56°С), га (CjH$), (Мп-82, Мп 143 * С) и GA (CeH8) 3 (Мп 166 * 0). структура равностороннего треугольника d (InC)= 2.16 A равна 1p (CH.), попарно (mp 89, mp. It был установлен при 136°C) в pairs.
In бензольный раствор, он тетрамерный, и его кристаллы аномальны. Структура полимерной сети представляет собой искаженную треугольную пирамиду. Его аналоги-в (CjH5)$(mp.-32, Мп.144°С)Н! Н (SbH3) с (МП.208 * 0), очевидно, является мономером. Это, вероятно, также верно для нестабильного таллия-триалкил-T1 (CH3) s(mp., 38°С), Т1 (C2H5)с(МП.-63°C) и T1 (C, HB), (т. дл.170°С). Рисунок XV-EO. Структура судья по административным делам (CHJ успешно) е молекулы.
50) в серии Al — Ga — In — T1 химическая (особенно акцепторная) активность триалкила непрерывно снижается. Но это все равно здорово, и представители всех 4-х стихий могут самопроизвольно воспламеняться в воздухе. air. In холодная вода, их триалкилтолы не являются полыми и гидролизуются до гидроксидов типа R3 (OH) j или Ri30H[например, триметил иидий дает CH3l (OH) 2.И еще — (c2h3b1hoh). Особенно характерны для таллия производные гидроксида (CH3) aTUN и (CjH5) iT10H. оба очень растворимы в воде и являются сильным основанием.
Из солей, соответствующих им, часть (например, фторид, нитрат, сульфат) хорошо растворима, а другие соли (например, хлорид, бромид, йодид) незначительны. (CH3TICH3)*линейные ионы, содержащие диметилтарийфторид, образуют кристаллогидраты состава (CHj) jTIF’12hjo. No для элементов подгрупп скандия, лантанида и актинида были получены метильные, этильные или фильные производные. 51) химия алкильных производных Si, Ge, Sn, Pb очень широка.
Самый простой представитель, метилид е (СН3) 4 представляет собой бесцветную летучую жидкость, которая устойчива к воздуху и воде. Некоторые характеристики Для сравнения 1, C (CH3) 4]также сравниваются ниже. QCH3)4 такое J) 4 программы QE (ч) 4 СН(СН3) 4 ПБ (ЧС) 4 Температура плавления, куб. см −17 −90-88 −55 −27 Температура, температура. 。 10 27 43 78110 д ОС).От……….. 1.54 1.89 (1.98) (2.18) 2.24 & (Эс) 5.3 3.4 2.7 2.4 1.9 Энергетический барьер для свободного вращения СН3-групп, ккал / моль….. 4.8 1л 0.4 0 0
Как видно из представленных данных, увеличение атомного размера ряда C-Pb (см. X§b дополнительно 102) явно влияет как на силовые константы связей, так и на энергетический барьер свободного вращения метильных групп. Тетраметилсилам служит источником свободного метильного радикала (X§ 2 add.12). 52) наиболее важным из алкильных производных рассматриваемого элемента является тетраэтилен-бесцветная, нерастворимая в воде жидкость (т. е. кипящая в воде при температуре разложения 195 ° с).
Его пары являются высокотоксичными (предельно допустимая концентрация в воздухе составляет 510 «®мг / л), полученными из свинцовых сплавов этилхлорида и натрия (-10% Na) в атмосфере азота по схеме: 4CjHsCl-f-4NaPb = «4NaCl +рь» (с2н5) 4.Это вещество широко используется в качестве добавки к бензину. (Порядка 0,5 мг / л) увеличивает октановое число (добавить x§ 3.27).Бензин, как правило, C * H $Br (M. завеса.38vS) добавлено для того чтобы обеспечить выход мотора руководства(как RVg2). 53) с возможностью вращательной изомерии, Pb (C2H*) 4 может существовать в некотором сообразовании(IX§ 1 дополнительные
85). он соответствует различным кристаллическим формам. Эта функция называется Sn (C2Hs) 4 (bp.175 * С) лучше изучен. Есть 10 таких форм, и плавление находится в диапазоне от-136 до-125°С. Гэ (CjHs)〜(Мп.-90, mp. At 164°C), такого поведения не обнаружено. ^ 54) наличие многих производных типа 3R3X с различными R и X характерно для всех рассматриваемых элементов, например, соединений триметилолова — (CH) sSnH (mp). 37. Т. Кипятить.153°с). (CHsbSnNOs (Мп 128bC), (ч$) С5 ПМН(со)$(Мп 30°С).Многие соединения, содержащие 2, 3 или 4 радикала E (CH3) 3, также были получены в молекуле. —
Примером последнего типа является Si (Si (CHe) z1″(mp 262°C).Эстер 1 (CH.) zEO (здесь — Ge. В случае (Sn) приведены следующие параметры структуры. д(ГЭК) » =-1.98.Д(СНС)-2.17,<Ф (Гео) = 1.77,д(СНО)= 1.94 а Z303 = 141°,Z03C «» = » 109°、 Гидроксид (СН3) » SnOH растворим в воде и обладает основными свойствами (/C = 210″ S).Его кристаллы образованы бесконечной цепью планарных радикалов (CHj) jSn, перемежающихся гидроксильными группами. Гидроксильный мостик: некоторые металлические производные триметилолова, например желтые кристаллы (CHshSnNa.
Существует * обзорная статья*о подобном металлическом производном кремния общего типа M (SiR). 55) специфической формой соединения, образованного радикалами 3R3, является их dnmer R33-3R3. E. Примеры с Этан-подобной структурой с прямыми валентными связями между атомами: метильные производные: (CH3), SiSi (CHj) j(MP12, bp 112°C), (CHj), GeGe (CH), (mp −40,bp 138°С), (CH), SnSn (CHj) s(mp 23,bp 182°) и (CH3) 3PP( CH3), (mp 38 *0).в конце этих соединений d(PbC) −2.25 и d(PbPb)■■2.88 A. Для энергии связи SN-SN она равна 38 ккал / моль(по другим данным, 50 ккал / моль), а ее постоянная enl равна 1,3.
Производные фенхеля того же типа-(C4H$) 3SnSn(CeH5l $(mp.232®С) добавлено Sn2 (CH3COO) e (x§ 6.91). 3SnJjP — — P [tin(CeH5) 3] |Evan Sn (CEH$) 4(..Температура плавления 225°С), получены производные белого фосфора и дифосфния [(IX§ 18 5 дополнительный) состав (CEH). 56) примерами соединений с 2 щелочами (N радикалами) являются (CHs) jSnCla (mp 106, bp.190°С).Это вещество в водном растворе гидролизуется примерно на 10%, и полученные октаэдр и ионы ((СН3), Sn(OHa)»] » (трансовое расположение метильных групп) имеют значение / C,= 6-10L K7 = 6-10 — * Kr = 3-10 -«*, /С4-2-U » 13.
Восстановление (CH3) 2SnCl2 металлическим натрием (в жидком аммиаке) приводит к одновременному образованию желтых нелетучих полимеров. Линейный[Sn (CH3)a] *(где n 124-20) и циклический [Sn (CH3) a) e. для аналогичного желтого гекзаметра [Sn(CaHsh]) была установлена структура стулообразного 6-членного кольца атома тетраэдра с d (SnSn)= 2.78 A.
Удивительно сложные полимеры-naprnm / p, устойчивые к щелочному действию[St (CH’) a], известные в ss-кремнии. Среди производных мономера (C * Hs) aSnIMn (CO) » b. d (SnMn)= 2.70 A, ZMnSnMn = 177°n ^ CSnC = / 57) простейшим моноалкильным производным рассматриваемого элемента является газ, а в нормальных условиях-метилгидрид: H3CSiH3 [d(CSi)= 1.86 A, » = 0.73. t. −57 eC], H3CGcH3 [d(CGe)= 1,95 A, u = 0,64, bp −23°C]и H, CSnH, (d (CSn)= » 2,14 A. bp. GS]. для потенциальных вращательных барьеров связи C-3 приведены значения 1.24 (Ge) и 0.65 (Sn). ккал / моль. Благодаря своей симметричной кубической структуре, монометилсилициевое производное, показанное на рисунке XV-3I, представляет интерес.
58)из простейших алкильных производных титана и его аналогов известно лишь несколько представителей. Все они более или менее устойчивы только при низких температурах, окисляются на воздухе и разлагаются водой. Желтый Ti (CH3) 4 и красный Zr (CH) 4 были получены при температурах около −80°C за счет взаимодействия соответствующего хлорида ES1 и Лича. Первые из этих кристаллических веществ разлагаются при 0 ° С и выше, а вторые-уже около-15°С.
Их комплексные производные-Ti (CHj) 4-Dipy и U2 [Zr(CH3) e], являются несколько стабильными. Его циклопентадиенильные соединения гораздо более характерны для Титана, некоторые из которых, как было доказано, служат основой системы химических связей свободного азота(см. X§ 7 дополнительно 62). Рисунок Xv-3i. структурная схема<CH » SlO). * — С1 о-о @ — sn3 * Я E. It это не первый раз, когда пара была связана. 19 ″. М. 4703. 59) органическая химия элементов мышьяковой подгруппы (не говоря уже о головных элементах V группы, азоте и фосфоре) весьма обширна.
Некоторые характеристики простейшего алкила E (CH9) сравниваются ниже. Н (ч, б, п(ч), а(CHJ успешно) Джей СБ (ч) с бл(ч、)、 д ОС). Один….. 1.47 1.84 1.96 2.17 2 ^ 0 нс… 108e 99 ° 96 ° 94 ° 93° Мео…… 4.7 3.0 2.6 2.2 1.8 Температура Ала-8,1 мл, С с. 。 •-117 −86 −87 −88 −108 Температура км-пенка, » с•••+3 38 30 79 по Для N (CHj) j и P (CH») j значения моментов поля равны 0,61 и 1,19 соответственно. Донорами могут служить все рассмотренные попурри, причем особенности этой функции у них варьируются, как правило, в ряду N> P> As> Sb> Bi. 60) замещение метильных и фторметильных радикалов резко ослабляет донорскую функцию.
Поэтому Sb (CFj) » (т. Кип.72°с)не только не столь типичен. Он связывается с акцептором, таким как AlClj, но также и с типичным донором, таким как пиридин, образуя C $ H5NSb (CF9) (mp 39 ^ C). Напротив, замена метильного радикала ферриарным радикалом, как правило, усиливает донорную функцию центрального атома е (CbH3)*сравнивает температуру плавления фенланда, которая считается частью молекулярного момента, со следующей: Н(С «H8H П(CeHsb с» (с «ВБ СНС» Н5), В1 (СВН»), Д 0.96 1.45 1.07 0.57 О.
Температура плавления,°С……….. 127 7 ″ 59 4 * 78 61) активность Донриа особенно характерна для молекулы Р (SbH$).Со структурой пирамиды [<*(RS) » 1.82 A].Большое разнообразие сложных производных, трифенилфосфин известно как добавка. Эти примеры представляют собой комплексы трехвалентного рения, содержащие электроотрицательный водород. Красный H, Re (P (C» H5) J, (mp 178c) и желтый H9Re {P(C» Hs) «] 4 (mp 144 *
C).напротив, (в CiHs ^ jgbhj водород в атомах Бора положителен(обычно электроотрицателен).интересным примером акцепторной функции некоторых рассматриваемых фенолидов, по-видимому, является адъюнкт с гексаметилбензолом (mp 164, bp 264 * C) состава (C * H5)»3C«(CHi).P(MP. I45ec).as (MP.144°C) и Sb (mp. .137 С), причем N и Bi не образуются. 62) по схеме антимонахинирования интересна реакция: 3Sb (CH) j-f 2SbCU-e 3 (CH3), SbClj4-2Sb. In кроме того, Sb (C2H$) «(mp 98, mp 161 *
C) взаимодействует с концентрированным HC1, схема (CaHshSb-f 2HCI — (CjH$) » SbCla 4-on: поэтому, когда к сурьме добавляются 3 этнических группы, Связь оставшихся 2 внешних электронов ослабевает, и сурьма 3 начинает реагировать как типичный атом металла. 7°C) самовоспламеняется в воздухе. 63) алкильные производные 5-валентного элемента группы V представлены небольшим числом и мало изучены. Они наиболее характерны для фосфора. Уже упомянутый (дополнительный 33) P (C * H$) 5 аналогичен по структуре ПК!»(Рис. IX-46) 3 расстояния d (PC)■ ■ 1.85 и 2 1.99 A, Sb (C H Hs) s представляют собой четырехугольные пирамиды (внутри находятся атомы Sb).
Структура OR (CH») 9 соответствует искаженному тетраэдру с фосфором около центра (rf (OP)= 1.47,d (PC)■ » 1.81 A, ZPOC = > = 112, ^СРС = 106Е].Желтая смесь (С»Н5)ЗСР(С «Н0,(Мп 210°С).Это 2-щелочной раствор в водном растворе, и ((C # УГ) jPCHjP (ЦВЗ) й〜(гидролитически разлагается очень медленно). 64) для ванадия и его аналогов простейшие производные алкила не характерны. 2es1 $ + 3Zn (CH3) a-3ZnCl2 + 2 (СН.) взаимодействие со схемой ees1a (пентан при −78°с) привело к образованию золотисто-желтых кристаллов соединений ниобия и тантала-метила.
Они есть monomers. It является изменчивым и нестабильным в норме temperature. In в случае ванадия был получен комплекс li {V (CeH5) e], который очень чувствителен к воздуху и влаге. Аттенуированные черные кристаллы при 80°C и более (C5Hs), VCeHs(mp.92°C) также известен. 65) как и кислород, сера является неотъемлемой частью многих органических соединений. Не так много, но это относится к Se n Te. Диметиловый эфир (x§ 2 ext. Из производных, подобных
64), хорошо изучены только S(CH3) 2 [d (SC) 1.81 A, и Z CSC =99е. И » 1.50. t. pl. −83, т. 38 ° С]и Se (CH3), (d(SeC) −1.94 A. ZCSeC =96е, q = 1.41, mp 87, mp 58°С]для энергетического барьера вращение вдоль свободной связи дает значения 2.1(S) и 1.5 (Se) ккал / моль. Температура кипения Te (CH3) a составляет 82°C. донорная функция рассматриваемых соединений обычно зависит от rad: O> S> Se>them. 66)для хрома и его аналогов-прямая валентная связь Е-С с циклопентадиенилом (X§ 2).34) очень характерен, но есть и простой Аркур (CH3, CjH5 и др.).
Но представители соединений с такими связями известны. Наиболее интересными из них являются красные W (CH3) e (mp.30°С) полученный путем interaction. It сублимируется в вакууме даже при комнатной температуре и быстро разлагается на воздухе. Из производных хрома самым простым является зеленый кристалл CH3CgC1a•3Thf. It очень чувствителен к действию воздуха и влаги. Приобретаются более сложные комплексы, например, типа CH3E (CO) 3CbH$.Желтые (Cr, Mo) или красные желтые (W) кристаллы.
Среди фенольных производных хрома следует отметить Красный (C»Hs) 3Cr-3Thf и оранжево-желтый Li3ICr (CeH5).А) −4 (CaH5) 30.Lia {W (CeHs) E] — 3 (CaHs) АО, близкое к составу, самопроизвольно воспламенится в воздухе. 67) простейшие алкильные производные марганца были получены в эфирной среде по схеме Mnl2 + 2LiR-2Lil + MnR}.Они представляют собой порошок желтого (CH3) или зеленого (C «H$) цвета, практически нерастворимый в эфире. Первое из этих соединений самопроизвольно воспламеняется в воздухе, а второе является несколько стабильным.
Когда LiCHj становится избыточным, он становится растворимым в эфире Li [Mn (CH3) 3]. Под действием водорода (в Тетрагидрофуране) восстановление происходит по схеме MnRi-F Na = 2HR Mn. As для простейших производных алкил-рения имеются только неподтвержденные данные о том, что Re(CH3) 3 образовался при взаимодействии ReCl3 с CH3MgI. Введите R3 (C0)$(x§ 1 add.85) алкильные производные, свойства обоих элементов значительно выше.
68) производное трехвалентного йода из галогеналкила (SbH5) a! C1 (mp 230 eC с разложением), структура которого аналогична CIF3 (рисунок VII-6), параметры ZCIC1-87е, rf (CI)= 2.08 n </(1C1) «3.08 A. под влиянием AgOH мигрируют в (C» H$) | UN. Интересно, что этот гидроксид является сильным основанием, из которого известно много солей. 69) для элементов триадной группы Связь Е — С с простейшим алкилом, как правило, осуществляется только в составе комплексного производного, которое одновременно содержит другие лиганды (eye, CO, PR3).Исключение составляет платина, известно, что при нагревании вспыхивает светло-желтый цвет(CH3) 3PtPt(CH3).Также описано соединение типа (CH3) nPtr *-«включая Pt (CH3)».
Это бесцветный кристаллический материал, который не имеет определенной температуры плавления или разложения、 @ — CH3# — PtOC * — Н Рисунок Xv-32. схема сомнительных структур ЛПТ(СН3) 4л. Рисунок XV-32 тетрамерная структура по rf(PtPt) 3.44 A. При исследовании рентгеновских лучей положение атома углерода (и водорода) непосредственно установлено не было, и было отмечено, что метильная группа была помещена в угол Куба, исходя из сходства с однотипным атомом хлора. кристаллизационный тетрамер{Pt (CHj) 8Clj4, где J (PtCI)= 2.473 и d(PT PT) −3 A. Если модель такой структуры верна, (PtfCHibb-это электро-ковалентное соединение.
Устанавливаются наиболее близкие 3 атома платины (4-центральные связи), образованные между атомами углерода 1 электронной парой и метильной группой с углом, но наличие самого этого соединения весьма подозрительно(его удалось повторно синтезировать). 7c) из приведенного выше примера мы уже знаем, насколько интересна химия элементоорганических соединений. Есть монографии и есть много обзорных статей по отдельным вопросам
Смотрите также:
| Периодический закон как основа химической систематики | Галоидные соединения |
| Элементы в химии | Окислы и их гидранты |
