Оглавление:











Задачи по окислительно-восстановительному титрованию
- Задание 1. Уран восстанавливали до U34 и окисляли до U4 +, продувая воздух в раствор. Титрование 25,00 мл раствора урана потребляло 18,35 мл 0,08520 N раствора KMp04 (/ «* ■ = L) (г / л). Масса урана, содержащегося в 25,00 мл испытуемого раствора, рассчитывается по следующей формуле: м (U) = -1000- • Концентрация урана в растворе (г / л) может быть выражена как: SS / 5KMPO4) V (KMri04) M (/> „(U) U) • 1000 1000-25.00 При титровании раствором KMPnOch уран имеет схему U4 ++ 2HjO = UO? + + 4H + + 2e окисляется в соответствии.
- Следовательно, урановый эквивалентный коэффициент (U) = * / г и M (/ 2U) — = ‘/ г’ 238,029 = 119,015. Следовательно, концентрация урана в растворе составляет: / т 0,08520-18,35 * 119,015 * 1000 f (U) = -1000-25,00— 7’4428 = 7’443 г / л- 2. Образец руды 0,40 г, содержащий MnOg, обрабатывали 50,00 мл 0,12 раствора НН2С2О4 (/, „■ = ‘/ г) в присутствии H2SO4. Является ли раствор перманганата 21,42 мл (KMn04 / Fe) = 0,005836.
Рассчитайте массовую долю (%) марганца в руде. Людмила Фирмаль
Поскольку решение было принято методом обратного титрования, m ‘НгООООООПН —- cC / ШCnO, 100 Прохлада ((мн) мн) — г ^. В состоянии проблемы нет значения cSQMpOD, но задана величина f (KMnO q (Mn) = ‘/ g, следовательно, M (‘ / gMn) = ‘D-54,938-27,469. Подставьте числовое значение исходного уравнения, чтобы найти содержание марганца в руде. / 0,1000 50,00 0,005836-1000-21,42 Н 27 ^ 69 = 18,7305 = 18,73%. V 1000 1000-55,847 / 0,4050 3.
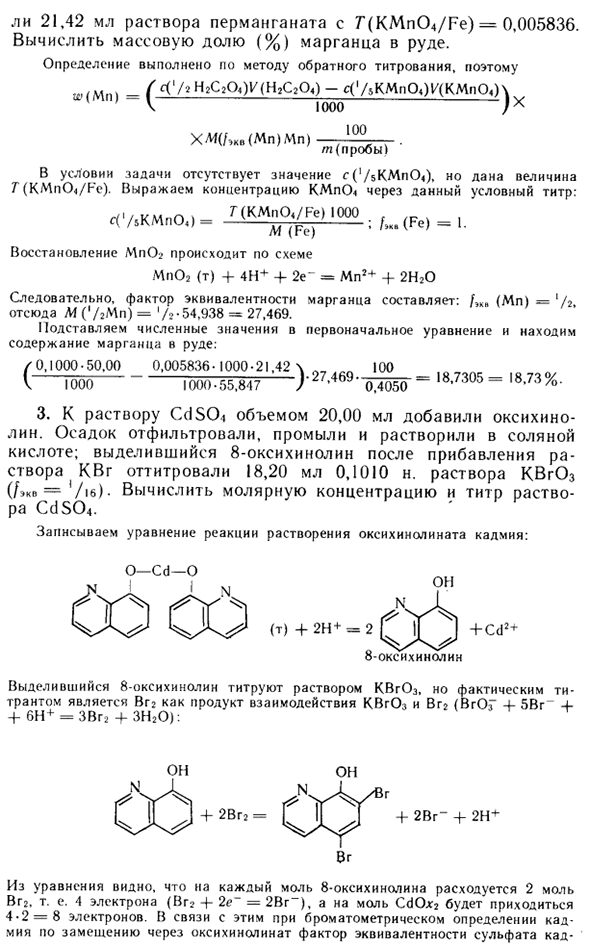
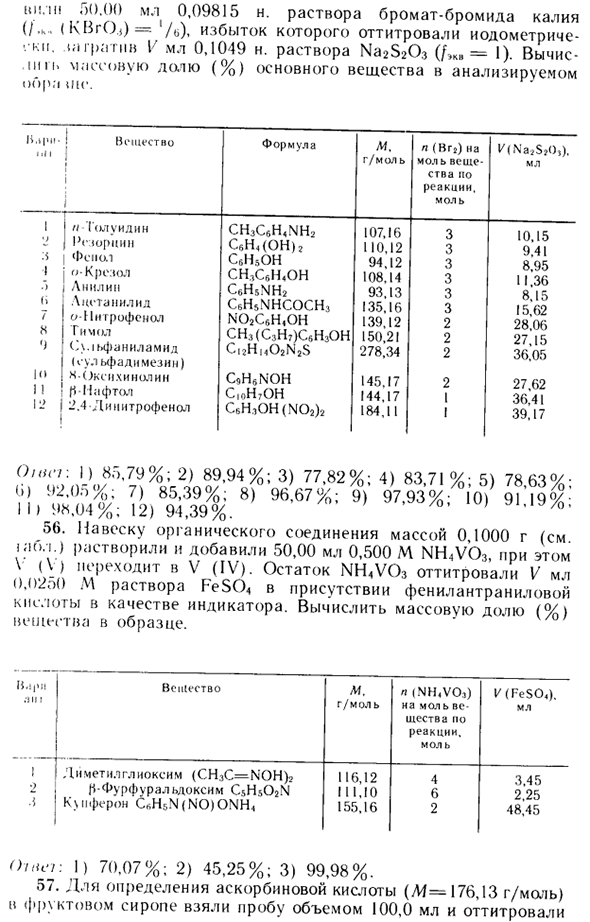
Окснхинолин добавляли к 20,00 мл раствора CdSO-1. Осадок отфильтровывают, промывают и растворяют в соляной кислоте. После добавления 8-гидроксихинолина, после добавления раствора KBg, титровали 18,20 мл 0,1010 н. Рассчитайте молярность и титр раствора KBrO3 (/ eq = Vie) -CdS04.
Напишите уравнение растворения для оксихинофосфата кадмия: (T) + 2H + = 2 G II A + Cd2 + 8-гидроксихинолин Высвобожденный 8-гидроксихинолин титруют раствором KBr03, но фактическим титрантом является HBr, продукт взаимодействия KBrO3 и Br2 (BrH + 5Br + + 6H + = 3Br2 4-ZN20): Формула показывает, что на каждый моль 8-гидроксихинолина расходуется 2 моля Vgr. То есть четыре электрона (Br2 + 2e ~ = 2Br ~) и 4-2 = 8 электронов, моль C <10 * 2.
В связи с этим при колориметрическом определении кадмия путем замещения оксихинолинатом эквивалентный коэффициент кадмия Миссия будет ‘D. Масса CdSO выражается в 20,00 мл раствора через молярную концентрацию эквивалента KBrO3 / (KBrOj) = ‘D. BrO.i ++ 6H ~ + 6 <> = Br ~ -fЗН20: m = s (7bKVr0z) 1 / (KBr0,). M <yeCdSO <) • ‘/ МОО-CdSO молярная концентрация <Исходное значение раствора: (SNcSpch_c (VeKBrO3) 1 / (KBrO3) AI (7, CdSO0-.000_ Да | 000Af (CdSo4) .20,00 0,1010-18,20 AL1 | .L = 0,01149 моль / л 8-20.00
Рассчитайте титр этого раствора на основе молярности: 7 «(CdSCM- = c (CdS04) -M (CdS04) -1/1000 = 0,01149-208,47,10» * = 2,395-10 г / мл. , 4. Рассчитать ошибку индикации для титрования 20,00 мл 0,1 н. Ванадилсульфат VOSO4 (/ экв. = 1) 0,1 н. [I4 «] = 1 мать / л, используя раствор KMpOd (/« • = 7 с) и используя V-fsnlanthranilic acid в качестве индикатора (интервал перехода £ ind ± 0,03 = 1,08 ± 0,03 В).
В расчете используются следующие значения полуреакции £ °: MnO; + 8H + + 5 <T = Mn2 «4» + 4H? 0, E \ = 1,51 В. и 5 VO2 * + H20 = VOt + 2H * + e ~. = 0,9996 В. b = I Где a и b — количество электронов, полученных и заданных в соответствующих полуреакциях. Найти значение окислительно-восстановительного потенциала системы в эквивалентной точке. Ah + bF $ 5-1,51 -4-1-0,99% | 2R а + б 6
В этом уравнении /? And- [N «*») = стандартное значение окислительно-восстановительного потенциала пары при 1 моль / л Используемый интервал перехода индикатора составляет 1,05-fl.il V (см. Примерные условия). Поскольку значение £ в точке эквивалентности (1,42 В) значительно выше, чем верхняя граница интервала перехода индикатора, используя V-фенилантраниловую кислоту в качестве индикатора, раствор VOSO «не титруется и потенциально находится в конце титрования.
Правильное значение составляет 1,11 (в этом случае берется верхний предел интервала перехода.) Подстановка этого значения в уравнение Нернста для пары ванадия находит ошибку. 1,11 = 0,9996-н 0,059 IgJ ^ L; [OOG] _ 1.1! -0,9996 _ 0,1106 г (W ‘J 0,059 0,059 •: = 10’87 = 74, т.е. [VOf] = 74- [V02 +]. Ошибка CVQ24I0Q. _ [UOG +] — Южная Осетия [UO ^ Z _. 33o / ishi0ka- [VO’4 + [VCV] ~ [VOv +] + 74 [VO»r] -75 [VO <~) ~ / o Поскольку раствор не титруется, ошибка титрования требует знака минус, то есть 1,33%.
Этот показатель не рекомендуется из-за большой погрешности в точном титровании ионов V02t с использованием раствора KMnO. 5. Масса KMp04, используемая для приготовления: а) 0,050,0 мл, 500,0 мл. Раствор (/ «» = 7 с); б) 500 мл раствора T (KMnO q-7 секунд)? Ответ: 0,27 г. 13. Рассчитайте массу вещества, содержащего 0,3% серы, и убедитесь, что в результате титрования H2S требуется 10,00 мл 0,0500 N раствора 12 (/, q (12) = 1/2) ответа это.
2,6717 г 14. 20,00 мл 0,1133 N добавляли к кислому раствору KI. KMn04 (/ eq * = $ 7) и выделенный йод титровали 25,90 мл раствора Na2S> 03. Рассчитайте молярный эквивалент раствора Na2S2O3. Ответ: 0,08749 моль / л 15. Если раствор дихромата, содержащий Т (K2Cg207 / Ge), составляет 20,00 мл = 0,005584 г / мл, рассчитайте концентрацию (моль / л) раствора Na2S203 и добавьте 12 после добавления KI. Ответ: 0,06161 моль / л 16.
HO добавляли к K2Cg207 весом 0,1500 г и избытком K1, и отделенный йод титровали 21,65 мл раствора тиосульфата. Рассчитайте молярную концентрацию эквивалента раствора Na2S203 и Т (Na2S203 / I2). Ответ: 0,1413 моль / л; 0,01793 г / мл. 17. 200,0 мл раствора готовили из промышленного сульфита натрия весом 0,5600 г. Для титрования 20,00 мл раствора Потреблено 16,20 мл раствора йода с Т (I2 / AS2O3) = 0,002473. Определите массовую долю (%) 2BOZ в образце.
Ответ: 91,15%. 18. В 20,00 мл раствора FeCl3 железо восстанавливали до Fe2 «1», используя SnCl * (удаление избытка железа под действием HgCU) и титруя 19,20 мл 0,1045 н. KMn04 (f> ** = x / b). Какова масса Fe в маточном растворе 100,00 мл? Ответ: 0,5603 г. 19. Порцию 2,5000 г пергидрола переносили в мерную колбу на 500,0 мл. На титрование 25,00 мл раствора расходуется 18,72 мл 0,1 N KMn04 (/, q = /)) (/ (= 1,124). Рассчитайте массовую долю (%) Н2О2 в пергидроле.
Это 28,63%. 20. Образец только 0,2250 г Fe и FeiCb растворяли, железо восстанавливали до Fe2 и титровали 37,50 мл 0,0991 N раствора KMn04 (/ eq = ‘/ 5). Массовая доля (%) Fe и Ge203 отвечает в выборке: 74,18% Fe и 25,82% Fe203. 21. После растворения цемента массой 0,5020 г и отделения кремниевой кислоты железо восстанавливали до Fe2 + и титровали в 15,41 мл раствора бихромата калия (7 «(К2СГ2О7) = 0,000500). Рассчитайте массовую долю (%) Ge20.h
Ответ: 2,50%. 22. После растворения 0,1000 г оксида железа и восстановления железа до Fe для титрования использовали 12,61 мл 0,09931 н. Решение K2Sg20? (/ — »* • = — ‘/ b). Определите формулу, которую имел анализируемый оксид: FeO, Fe2Oi или Fe304? Ответ: Fe203. 23. Часть технического CuCl весом 0,2600 г растворяли в избытке солянокислого раствора NH4Fe (S04).
Для титрования образующихся ионов Fe2 + использовали 20,18 мл 0,1200 н. Раствор K2SG2O7 = ‘L). Найти массовую долю (%) образца. Ответ: 92,21%. Если для титрования раствора, полученного из 0,9352 г бронзы, используют 15,73 мл 0,03523 N, определите массовую долю Sn в бронзе. 12 (б) = 7r). Ответ: 3,61%. 25. Серу из образца угля весом 0,1906 г переносили в S02, абсорбировали в разбавленном растворе крахмала и титровали 20,45 мл 0,02088 н.
Раствор 12 (/, * „(12) = ‘/ г). Рассчитайте массовую долю (%) серы в угле. Ответ: 3,59%. 26. Ионы Ca2 ** осаждались в виде CaC204-H20 из образца известняка, растворенного в 0,1862 г HCl. Промытый осадок растворяли в разбавленной H2SO4 и H2C2O.1 титровали 22,15 мл раствора перманганата калия Т (KMp04 / CaC0z) = 0,005820). Рассчитайте массовую долю (%) CaCO3 в известняке.
Ответ: 69,23%. 27. Кальций из раствора осаждали в виде CaCrO2 ^ NgO и осадок отфильтровывали, промывали и растворяли в разбавленной H2SO4. Полученную кислоту Н2С2О4 титровали 20,15 мл раствора. T (KMn04 / Ca0) = 0,01752 KMnOt. Какая масса k; | .ЫЫШ1 содержится в растворе? Ответ: 0,2523 28. Уран в 50,00 мл раствора восстанавливали до U ‘* 4 «через редуктор Джонса.
Когда в раствор вдували воздух, уран окисляли до U4 * и титровали 21,30 мл при 0,09940 н. Использовано: раствор K.l’gD). (/, Cn = ‘/ *) • Рассчитайте концентрацию урана в растворе ft / 11. Ответ: 5,04 г / л. 29. Вольфрам в 25,00 мл раствора восстанавливали до W (III) с использованием гранулированного свинца. Затем к раствору добавляли избыток железоаммонийных квасцов (W (111) -f 31ten W (VI) -f-3Fe2 +) и полученный ион IV’1 титровали с 21,20 мл до 0,05025 н. Раствор K2SG2O7 (/, K * = ‘/.,)
В присутствии d-фениламиносульфоновой кислоты в качестве индикатора. Определить концентрацию вольфрама (мг / мл) в растворе. Ответ: 2,61 мг / мл. 30. 10985 мл 0,09852 Н поступало в раствор, содержащий 0,1510 г технического КССУз. NaHCrOc (/ • = =)), избыток титровали 22,146 мл, 0,1146 н. KMn04 (/, k «= 1/5). Рассчитайте массовую долю (%) CSJ в образце.
Ответ: 98,23%. 31. Рассчитайте массовую долю (%) MnOg в природных пирозитах. Когда 0,4000 г образца обрабатывали разбавителем II, S04 содержал 0,6000 г H2C2CV2H2O, а избыток щавелевой кислоты титровали 23,26 мл, 0,1129 н. KMn04 (/, kn = 1/5) — отклонено. 74,91%. 32. Рассчитайте массу образца, содержащего около 65% M & O. После взаимодействия с «50,0 мл 0,1 нН2С2О4 (/> q = — ‘/») избыток титровали 25,0 мл раствора KMp04 (I, 00 мл раствора KMn04, составлял 1,05 мл раствора.
И <:, (),). Ответ: 0,1588 г. 33. 50,00 мл 0,1048 М раствора f cS () | добавляли к раствору KSS. Избыток титровали 0,09450 N, 20,00 мл. KMnO, (/, ki = 1 / г «). Какова масса KSS в растворе? Ответ: 0,0684 г. 34. Какова масса кальция в 250,0 мл раствора Cad? В случае 40,00 мл 0,1000 н после добавления по 25,00 мл. | \ P,) _. <:> <> 4 (/, ki = 1/2) и отделение образовавшегося осадка <.нС • (), • I IvO, избыточное титрование (МН4) 2Ср04, потрачено | Г)% (И) мл 0,02000 Н. KM11O4 (/.kv = Uz)? Ответ: 0,7415 г. 35.
После плавления было взвешено 1,2430 г стали, и хром был окислен до CgO. ‘. 35,00 мл солевого раствора Мохла добавили к раствору, и избыток Fe2 ~ титровали 16,12 мл раствора CMP () |. Рассчитать массовую долю Cr (%) для стали /’ (KMnOi) = 0,001510, 25,00 мл раствора молей соли эквивалентно 24,10 мл раствора KMn04, ответ: 1,17%. Pawssk nitrosa (оксид азота, содержащий H2S04) г 3 фута весом 1,02 дюйма взвешивали в стеклянной ампуле и разрушали с 25,00 мл O.1000 и KMp04 (/, kk = ‘A) -20,00 после завершения реакции
Добавить 0,1000 М FeS04 мл и титровать избыток железа (II) 17,50 мл 0,1000 н KMn04. Рассчитайте массовую долю (%) N2O3 в нитрозе. Ответ: 4,17%. 37. Порцию 0,4680 г технического Na2SO3 добавляли к 10 000 мл 0,1000 н. Избыток йода титровали в 42,40 мл раствора Na2S203 в растворе I2 (/, R, (U) = xh) -7 * (Na2S20:} / Cu) = 0,006215. Рассчитайте массовую долю (%) Na2S03 в образце. Ответ: 80,53%. 38. 50,00 мл 0,01960 добавляли к 25,00 мл раствора H2S.
Раствор 12 (/ EcB (b) = 1 л) и избыток йода титровали до 11,00 мл 0,02040 н. Na2S203 = I). Рассчитайте концентрацию H2S в растворе (г / л). Ответ: 0,5150 г / л. 39. Для определения содержания формальдегида НСОН взвешенную порцию технического препарата весом 0,2879 г растворяли в воде, NaOH и 0,1004 н. В 50,00 мл.
- Решение 12 (/, К. (S = ‘L): После подкисления раствора титрование избытка йода дает 15,20 мл раствора тиосульфата с Т (Na2S203) = 0,01600 г / мл. Рассчитайте массовую долю (%) формальдегида в рецептуре. Ответ: 18,16%. 40. К 25,00 мл раствора гидрохлорида гидроксиламина добавляют 25,00 мл 0,1 н. Раствор KBrO3 (/ „, = ‘/ b) (K = 0,9876): NHjOH • H + + BrO * N03 ~ + Br «+ 2H + + H20
Избыток бромата титровали иодометрически и использовали 15,00 мл раствора тиосульфата с Т (Na2B20z) = 0,01634. Определить концентрацию (г / л) раствора гидроксиламина NH2OH. Ответ: 0,2023 г / л. 41. СУ * ~ Для измерения содержания хрома (III) в присутствии ионов к 20,00 мл раствора добавляли 50,00 мл 0,1032 N. Раствор NaBrO (/, q-1/2) и определенное количество концентрированного раствора NaOH и избытка гипобромита титровали с 21,45 мл 0,1014 н.
Раствор Н2О2 (/ экв, = ‘/ 2). Людмила Фирмаль
Какова была концентрация Cr3f (г / л) в анализируемом растворе? Ответ: 2,5868 г / л. 42. Когда медь была перенесена из 0,6215 г руды в раствор в форме Cu2 * для расчета массовой доли (%) меди в руде, KI был добавлен в этот раствор и осажден12. (Na2S203 / Cu) = 0,006208. Ответ: 18,21%. 43. Избыток KI и несколько капель раствора соли молибдена в качестве катализатора добавляли к подкисленному раствору H2O2.
Выдающийся 12 титровали до 22,10 мл 0,1010 н. Na2 $ 203 (/ x * = 1). Какая масса I202 включена в раствор? Ответ: 0,03848 г. 44. Раствор H2O2 готовили разбавлением 25,00 мл 3% перекиси водорода до 250,0 мл. Сколько миллилитров мне нужно взять, чтобы титровать 25,00 мл 0,1500 М Na2S203 после обработки HCI и K1? Ответ: 21,26 мл. 45. Чтобы использовать около 20,00 мл раствора тиосульфата натрия Т (Na2S20v • 5H20) = 0,02453) для титрования йода, сколько хлористой воды должно содержать около 2% хлора?
Ответ: 3,50 мл. 46. Образец беленой извести весом 3,359 г помещали в мерную колбу объемом 250,0 мл и добавляли воду до метки. Титрование 25,00 мл полученного раствора требует 18,29 мл раствора тиосульфата с Т (Na2S203 * 5Н20) = 0,2453. Рассчитайте массовую долю (%) активного хлора в беленой извести. Ответ: 19,08%. 47. Образец отбеливателя объемом 20,00 мл разводили до 250,0 мл в мерной колбе, и 50,00 мл этого раствора титровали иодометрически с использованием 21,16 мл и 0,1241 н. Na2S203 (/ «„ ■ = = 1).
Рассчитайте концентрацию активного хлора в исходном растворе (г / л). Ответ: 23,2745 г / л 48. Часть 4,208 г технического FeCl3 растворяли в мерной колбе объемом 250,0 мл. К1 и кислоту добавляли к 20,00 мл полученного раствора, и свободный йод титровали до 22,10 мл с 0,09230 н. Na2S203 = I). Рассчитайте массовую долю (%) FeCl3 в образце. Ответ: 98,28%. 49. Образец руды, содержащий 0,1000 г MnO2, обрабатывали концентрированной соляной кислотой.
Полученный хлор отгоняли и абсорбировали раствором К1. Высвободившийся йод титруется 21,25 мл 0,05200 н. Na2S203 (/, KB = I). Рассчитайте массовую долю (%) MnCb в руде. Ответ: 48,03%. 50. Из 25,00 мл раствора, осажденного свинцом в виде PbCO4, осадок отфильтровали, промыли, растворили в кислоте и добавили избыток KI. В 12 выпущенных титрованиях потреблялось 21,50 мл 0,1010 н. Na2S203 (f, Ke = 1). Рассчитайте концентрацию свинца (моль / л) в растворе. Ответ: 0,0290 моль / л 51.
При измерении Na2S04 в растворе иодометрией ион S04 был заменен серией превращений с таким же количеством иона Cr04. Раствор подкисляли, добавляли K1, и высвобожденный 12 титровали 20,40 мл 0,01980 н. Na2S203 = = 1). Какова масса Na2S04 в тестируемом растворе? Ответ: 0,0191 г. 52. Для титрования 12 его выделяли из 20,00 мл раствора HCl, содержащего избыток смеси KY3 и K1, и потребляли 18,25 мл 0,02 н. Na2S203 (/ -, q = 1) (K = 0,9825).
Запишите формулу реакции с HCl и йодидным раствором йода и рассчитайте количество HCl, содержащегося в 200,0 мл анализируемого раствора. Ответ: 0.1308 53. Раствор, содержащий смесь FeCl3 и KrSgrOt, доводили до объема 100,0 мл и иодометрически титровали в двух отдельных образцах (аликвоты по 20,00 мл). Соответствует Na2S203 (f> *> = I), сумма Fe и Cr для титрования первого образца, потраченного 0,02000 Н V \ мл.
Пирофосфат натрия был добавлен ко второму образцу. Fe3 + был связан с комплексом, и та же концентрация Na-iSjO ^ V’2 мл была потрачена на титрование. Рассчитаем массу железа и хрома в растворе (см. Таблицу): Вариант V1. мл Vi, мл вариант V. мл 1 ‘/. мл 1 19,45 12,20 4 18,67 9,23 2 20.50 11.40 5 22.05 15.80 3 21,72 10,35 6 20,12 6,60 Огвет: I) Fe 0,0405 г и Cr 0,0212 г. 2) Fe 0,0508 г и Cg 0,0198 г; 3) 0,0635 г Fe и 0,0179 г Cg; 4) 0,0527 г железа и 0,0160 г Cg. 5) Fe составляет 0,0349 г, Cg составляет 0,0274 г. 6) 0,0755 г железа и 0,0114 г хрома.
54. Металл из солевого раствора (см. Таблицу для вариантов) осаждается в виде оксихинолината, осадок отфильтровывается, промывается и растворяется в HCl. После добавления KBr высвобожденный 8-гидроксихинолин титровали раствором KBrOd, содержащим индикатор метиловый красный (фактическим титрантом является HBr в качестве продукта взаимодействия KBrO3 и KBr).
Если на титрование 25,00 мл анализируемого раствора было затрачено 0,1085 Н V мл, рассчитайте концентрацию (моль / л и мг / мл) раствора соли металла. Решения Куус (/ „к- = 7б). Вари-выражение l (Br,) V (синица-вари-выражение L (Br,) V (синица) муравьиный золь и атом ранта). Муравьиная соль на атом ранта), Металл мл Металл мл Соль с солью Реакция. Реакция.
Крот крот 1 AI (SO) 4 6 23,00 7 Mg2SiO 4 4 19,95 2 Al (NO) 6 20,75 8 MnCl2 4 19,06 3 HCCHF 6 18,41 9 Pb (SNzCOO) 2 4 21,91 4 Cd2P207 4 21,20 10 SbClj 6 23,14 5 CuSO 4 21,84 11 ZnCl * ч 20,82 6 Cu2 (OH) 2COj 4 20,90 12 ZMPOO * 4 22,65 Ответ: 1) 0,004156 моль / л и 1,423 мг / мл; 2) 0,007505 моль / л и 1,598 мг / мл; 3) 0,006658 моль / л и 2,630 мг / мл; 4) 0,005750 моль / л и 2,293 мг / мл; 5) 0,01185 моль / л и 1,8891 мг / мл; 6) 0,005669 моль / л и 1,254 мг / мл; 7) 0,005411 моль / л и 0,761 мг / мл; 8) 0,01034 моль / л и 1,309 мг / мл; 9) 0,01189 моль / л и 3,867 мг / мл; 10) 0,008369 моль / л и 1,909 мг / мл; 11) 0,01130 моль / л и 1,539 мг / мл; 12) 0,004096 моль / л и 1,5181 мг / мл.
55. Часть органического соединения весом 1000 г (см. Таблицу) растворяли в мерной колбе объемом 250,0 мл и объем доводили до метки. До 20,00 мл полученного раствора, ui3.il! 50,00 мл 0,09815 н. Раствор бромистого калия бромида (/ KK (KBrO.,) = 1D). Избыток титровали йодометрией. Директива V мл 0,1049 N раствора NaBbO3 (/> „-I). Рассчитать .in и“ массовую долю (%) основных веществ в анализируемой пробе.
B.ph-Substance Formula mp (Vgg) on нн г / моль вещества реагирует. Мол мл А | толуидин CH3C6H4NH2 107,16 3 10,15 h Rgshrkin SBN, (OH) g 110,12 3 9,41 Фенол C ^ HsOH 94,12 3 8,95 ] o-Cresol CH, C6H4OH 108,14 3 11,36 •> анилин SBN5MN2 93,13 3 8,15 C «кетанилид CbHsNHCOCH3 135,16 3 15,62 7 o-Интрофенол N02QH «0H 139,12 2 28,06 8 GNMol SN (С3Н7) SBN3ON 150,21 2 27,15 H сульфаниламид (сульфадимезин)
C, 2H, 02N2S 278,34 2 36,05 А « x-Okeiquinoline CoH6NOH 145,17 2 27,62 11 футов нафтола 2,4-динитрофенол C, oH7OH C6H. 0H (N02) 2 144,17 36,41 11? 184.11 1 39.17 Ah I) 85,79%; 2) 89,94%; 3) 77,82%; 4) 83,71%; 5) 78,63%; 6) 92,05%; 7) 85,39%; 8) 96,67%; 9) 97,93%; М) 98,04%; 12) 94,39%. 56. Взвешивали 0,1000 г органического соединения (см. JacVi), растворяли, добавляли 50,00 мл 0,500 М NH4VO3 и переносили в V (IV).
Остальную часть NH4VO3 титровали V мл 0,0250 М раствора FeSO4 в присутствии фенилантраниловой кислоты в качестве индикатора. Рассчитайте массовую долю (%) вещества в образце. Вещество M, n (NH V VOa) V (FeSO «). г / моль на одну мать в мл Общество Ио Реакция. мол L, мет, L глиокс и м (СН3С = NОН) •> 116,12 4,45 Фурфуральдоксим CsHs02Sl IIU0 6 2,25 ! k \ iferon aH5N (НЕТ) ONH4 155,16 2 48,45 Okich: 1) 70,07%; 2) 45,25%; 3) 99,98%. 57.
Образец объемом 100 мл отбирали и титровали для измерения аскорбиновой кислоты (М = 176,13 г / моль) в фруктовом сиропе. 15,25 мл 0,0100 н. Раствор хлорамина Т (CHaQbbSCbNCINa •• ЗН2О) в присутствии крахмала и йодид-ионов. Рассчитайте концентрацию аскорбиновой кислоты (мг / мл). При окислении по схеме при титровании:
Но он ах ах -CHOH-CH2OH + 2H ++ 2 <? ■ C ■ SNON — от CHAOH SI N Ответ: 0,1343 мг / мл. 58. 25,00 мл 0,0200 N добавляли к 20,00 мл раствора аминокислоты (серия, M-105,09 г / моль). Раствор NaI04 (/ «в = 1/2) — реакция в щелочной среде CH2OH — CH1NH2 — COOH + 2UH + 20H ^ nso + nsoo + nsoh + + 2I03 ^ + NH3 + H20 Раствор подкисляли CH3COOH и добавляли HCO3 и KI.
Йод, выделившийся в результате окисления йодида вследствие чрезмерного периода, титровали в присутствии 9,25 мл 0,0212 N крахмала. NaAsCb (fyM = ‘/ 2). Рассчитайте концентрацию серина (г / л) в маточном растворе. Ответ: 0,3992 г / л 59. Для определения содержания этилового спирта в крови образец 1,00 г подкисляли азотной кислотой и добавляли 25,00 мл 0,0200 н. Раствор K2SG2O7 (/ zhv = ‘/ b) (в этом случае этанол был окислен до уксусной кислоты).
Избыток дихромата титровали иодометрически и расходовали 22,25 мл 0,0200 н. NaoBrO3 (/ то же самое = I). Рассчитайте концентрацию (мг / л) C2H5OH в крови. Ответ: 0,6335 мг / л. 60. Часть йодоформа CHI3 сплавлялась с твердым КОН для растворения расплава. К полученному раствору KI добавляют кислоту, ионы I-окисляются под действием хлористой воды, избыток хлора удаляется кипячением, KI вводится в раствор, а свободным L является Т (Na2S203 / I2) = 0,02560.
Титровали 23,22 мл раствора тиосульфата натрия. Какую массу йодоформа использовали в анализе? Ответ: 0.1025 61. Чтобы измерить влажность в удобрении, мы измерили раствор йодпиридина (S02, 12, реагент C5H5N-Fischer) весом 1,500 г и весом 9,82 мл. Титр устанавливали с использованием стандартного раствора метанола с Т (H2O) = 0,0100.
Для титрования 2,00 мл стандартного водного раствора расходовали 5,85 мл реагента Фишера. Рассчитайте массовую долю (%) воды в удобрении. Ответ: 2,24%. 62. Рассчитайте показатель погрешности титрования с помощью раствора растворителя серной кислоты с ванадием (III) и K2SG2O7, pH 0. б) о-дианизидин (интервал перехода равен E ° ± ± 0,06 В) в) используется дифениламин (интервал перехода E ° ± 0,03 В).
Ответ: 1) <0,01%; 2) <0,01%; 3) -0,01%. 63. Рассчитайте погрешность индекса титрования раствора (V) молибдена раствором (NH4) 3V04 в сильнокислой среде. а) с использованием дифениламина (интервал перехода E ° ± 0,03 В); б) использует дифениламинсульфонат натрия (интервал перехода E ° ± 0,03 В);
в) использует N-фенилантраниловую кислоту (интервал перехода E ± 0,03 В). Ответ: а) <0,01%; б) <0,01%; в) <0,01%. 64.2. Рассчитать погрешность индекса титрования раствора FeS04 с использованием раствора KMp04 в 2 М среде H2S04. б) Используется дифениламин (интервал перехода £ ° = ± 0,03 В). Ответ: а) <0,01%; б) -32,4%.
Смотрите также:
Решение задач по аналитической химии
| Цериметрия | Особенности и области применения физико-химических методов анализа |
| Ванадатометрия | Основные физико-химические методы анализа |
