Оглавление:
Химические источники постоянного тока. электрохимические расчеты
Пример 92
Среди перечисленных ниже металлов найти те, которые могут восстановить катион никеля 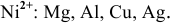
Решение:
Выпишем значения стандартных электродных потенциалов данных металлов:
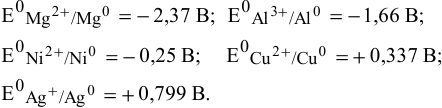
Так как 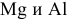 имеют более низкие электродные потенциалы, чем Ni, то они являются более сильными восстановителями по сравнению с никелем:
имеют более низкие электродные потенциалы, чем Ni, то они являются более сильными восстановителями по сравнению с никелем:
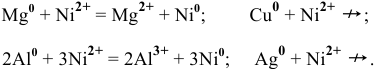
Пример 93
Среди перечисленных ниже катионов металлов найти те, которые могут окислить цинк: 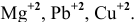
Решение:
Согласно ряду напряжений металлов
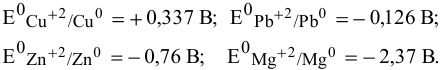
Свинец и медь имеют стандартные электродные потенциалы выше, чем цинк.
Таким образом, катион меди и катион свинца являются окислителями более сильными, чем катион цинка, и будут окислять 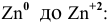
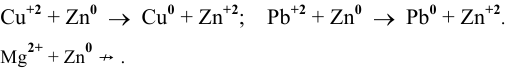
Пример 94
Как изменится восстановительная активность цинка, если его погрузить (при Т = 298 К) в раствор нитрата цинка с концентрацией 0,0001 моль/л ?
Решение:
Воспользуемся формулой Нернста:
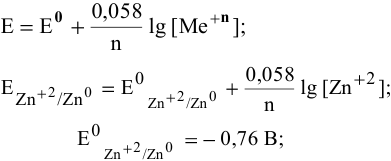
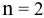
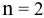 , так как
, так как 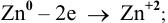
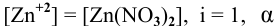 принимаем равной 1,
принимаем равной 1,
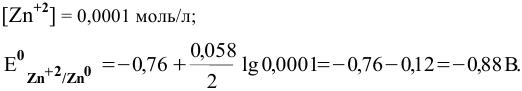
Вывод. С разбавлением раствора восстановительная активность возрастает, так как электродный потенциал понижается.
Пример 95
Среди приведенных ниже частиц укажите наиболее сильный окислитель. Эти частицы участвуют в следующих полуреакциях:
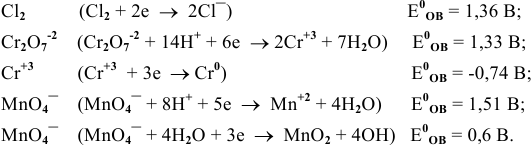
Решение:
Самый сильный окислитель тот, который обладает наибольшим значением редокс-потенциала  . Таковым является анион
. Таковым является анион 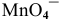 в кислой среде.
в кислой среде.
Пример 96
Рассчитать редокс-потенциал полуреакции:
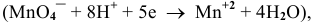
если стандартный 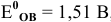 , а концентрации ионов равны:
, а концентрации ионов равны:

Решение:
Воспользуемся формулой Нернста для расчета редокс-потенциалов:
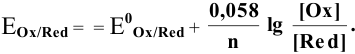
Так как уравнение электродной полуреакции —
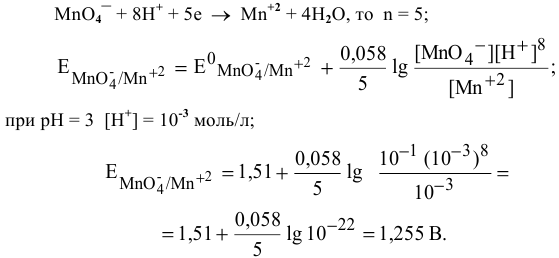
Вывод. В условиях, отличающихся от стандартных, окислительная способность аниона 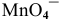 изменяется (в данном случае — уменьшается).
изменяется (в данном случае — уменьшается).
Пример 97
Определить, можно ли окислить 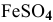 до
до 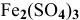 с помощью
с помощью 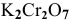 в кислой среде при стандартных условиях (С = 1 моль/л, Т = 298 К) согласно уравнению реакции:
в кислой среде при стандартных условиях (С = 1 моль/л, Т = 298 К) согласно уравнению реакции:
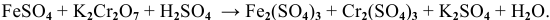
Решение:
Записываем сокращенное ионное уравнение данной реакции:
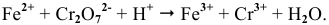
Составляем уравнения полуреакций, записывая в левой части окисленные формы каждого из изменяющихся веществ, а в правой — восстановленные формы, и находим по таблице стандартные 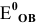 :
:
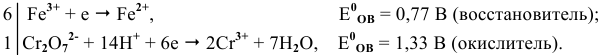
По величине 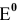 более сильным окислителем является ион
более сильным окислителем является ион 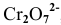 , а более сильным восстановителем — ион
, а более сильным восстановителем — ион 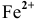 , следовательно, они будут реагировать друг с другом, и их записывают в левой части ОВ реакции.
, следовательно, они будут реагировать друг с другом, и их записывают в левой части ОВ реакции.
Записываем ионное уравнение реакции с учетом множителей:
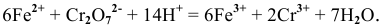
Составляем молекулярное уравнение:
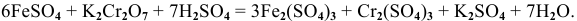
Пример 98
По данным полуреакциям составить ионное и молекулярное уравнение ОВ реакции:
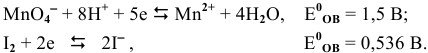
Решение:
Роль окислителя будет выполнять окисленная форма I полуреакции, а роль восстановителя — восстановленная форма II полуреакции.
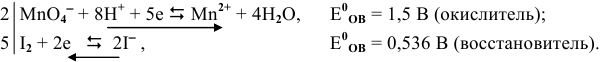
Составляем ионное и молекулярное уравнение, подобрав противоионы:
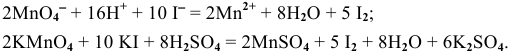
Пример 99
Определить возможность протекания окислительно-восстановительной реакции
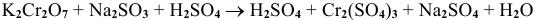
в кислой среде, pH которой равен 1, а концентрации:
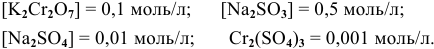
Решение:
Для упрощения расчетов предполагаем, что диссоциация всех веществ полная, тогда:
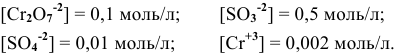
Изучаемая реакция состоит из двух полуреакций, стандартные редокс-потенциалы которых находим в таблице:
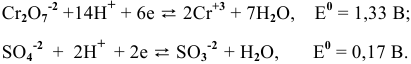
Определяем редокс-потенциалы каждой полуреакции по формуле Нернста для соответствующих концентраций:
при 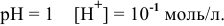
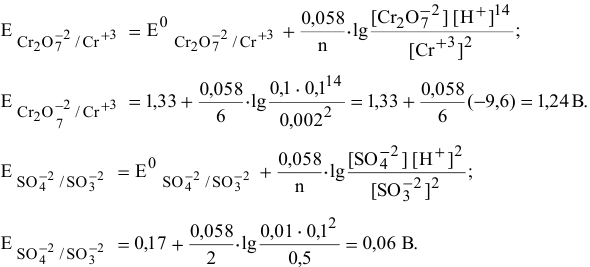
По формуле 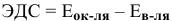 определим направление процесса.
определим направление процесса.
В роли окислителя выступит бихромат — ион 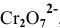 , а в роли восстановителя выступит сульфит — ион
, а в роли восстановителя выступит сульфит — ион 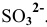 .
.
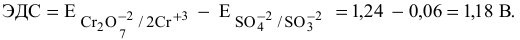
Так как 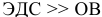 , то окислительно-восстановительная реакция практически необратима и идет в заданном направлении при данных условиях.
, то окислительно-восстановительная реакция практически необратима и идет в заданном направлении при данных условиях.
Задача 68
Рассчитать электродный потенциал гальванической пары: раствор 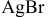 (насыщенный при 298 K)/
(насыщенный при 298 K)/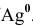 .
.
Решение:
Определяем концентрацию ионов 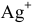 в насыщенном растворе
в насыщенном растворе 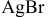 . Для этой цели в справочнике находим растворимость
. Для этой цели в справочнике находим растворимость 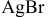 :
:
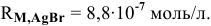
Таким образом, 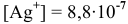 моль/л.
моль/л.
Для расчета электродного потенциала гальванической пары 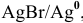 , которой соответствует электродная полуреакция
, которой соответствует электродная полуреакция 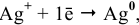 , воспользуемся уравнением Нернста:
, воспользуемся уравнением Нернста:
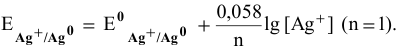
В справочнике находим: 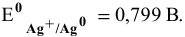
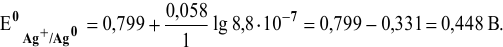
Задача 69
Рассчитать электродвижущую силу гальванического элемента, состоящего из медной пластины, погруженной в 0,001 М раствор 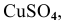 , и магниевой пластины, погруженной в 0,0001 М раствор
, и магниевой пластины, погруженной в 0,0001 М раствор 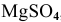 , при Т = 298 К.
, при Т = 298 К.
Решение:
Прежде всего, рассчитаем электродные потенциалы медного и магниевого электродов по уравнению Нернста:
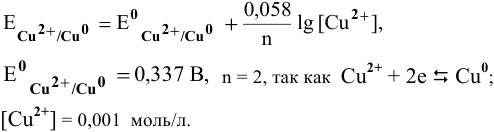
Предположив, что диссоциация разбавленного раствора соли полная (а = = 1,0), вычислим электродный потенциал меди:
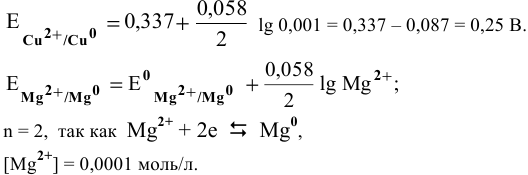
Предположив, что диссоциация разбавленного раствора соли полная, вычислим электродный потенциал магния:
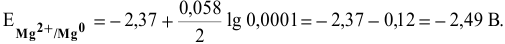
Рассчитаем электродвижущую силу гальванического элемента по формуле
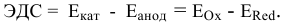
Роль катода выполняет электрод, имеющий более высокий электродный потенциал, в данном случае — это медный электрод. Тогда находим:
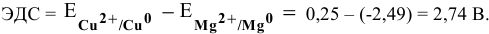
Задача 70
Составить два гальванических элемента: медный электрод играет роль катода; медный электрод играет роль анода. Составить схемы этих гальванических элементов и написать процессы, происходящие на катоде и на аноде.
Решение:
1. Медный электрод играет роль катода, если электродный потенциал гальванической пары 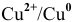 выше электродного потенциала анода.
выше электродного потенциала анода.
Таким образом, подбираем для этой цели любую гальваническую пару, электродный потенциал которой ниже электродного потенциала медного электрода, например 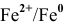 :
:
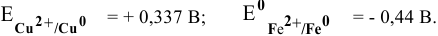
Железный электрод играет по отношению к медному электроду роль анода.
Схема полученного гальванического элемента следующая:
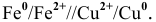
Процессы, происходящие на электродах:
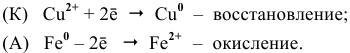
2. Медный электрод играет роль анода, если в качестве катода подобрана такая гальваническая пара, электродный потенциал которой выше электродного потенциала пары 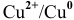 , например
, например 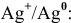 :
:
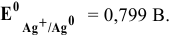
Схема полученного гальванического элемента следующая:
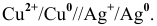
Процессы, происходящие на электродах:
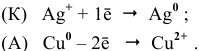
Задача 71
Рассчитать электродвижущую силу концентрационного элемента, схема которого следующая:
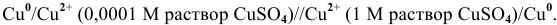
Написать процессы, происходящие на электродах.
Решение:
Определяем, прежде всего, электродные потенциалы каждого электрода.
Электрод с концентрацией 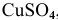 , равной 1 моль/л, при условии, что диссоциация
, равной 1 моль/л, при условии, что диссоциация 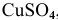 полная, является стандартным. Для него в справочнике находим значение стандартного электродного потенциала:
полная, является стандартным. Для него в справочнике находим значение стандартного электродного потенциала:
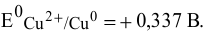
Для электрода с концентрацией 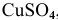 , равной 0,0001 моль/л, электродный потенциал определяем по уравнению Нернста:
, равной 0,0001 моль/л, электродный потенциал определяем по уравнению Нернста:
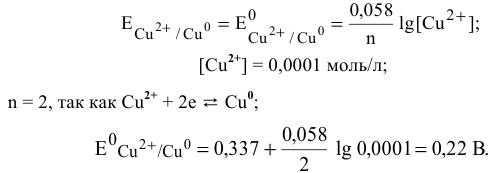
Второй электрод с более низкой концентрацией катионов 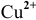 выступает в роли анода, так как имеет более низкий электродный потенциал.
выступает в роли анода, так как имеет более низкий электродный потенциал.
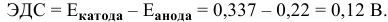
Процессы, протекающие на электродах, следующие:
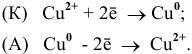
Задача 72
Рассчитать произведение растворимости 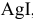 , если электродвижущая сила концентрированного элемента
, если электродвижущая сила концентрированного элемента
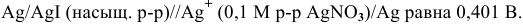
Решение:
Прежде всего, рассчитаем электродный потенциал катода, предположив, что 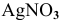 диссоциирует полностью:
диссоциирует полностью:
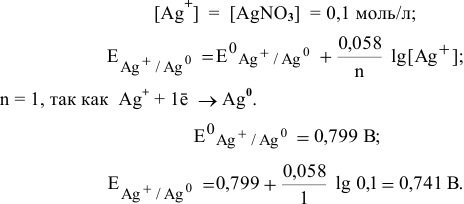
Зная величину электродного потенциала катода и величину ЭДС, рассчитаем величину электродного потенциала анода:
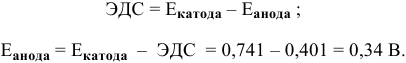
Рассчитаем концентрацию ионов 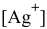 у анода:
у анода:
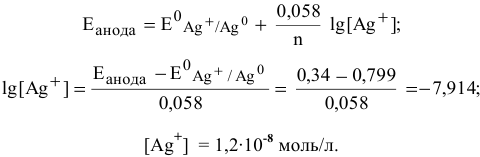
В насыщенном растворе 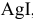 устанавливается следующее равновесие:
устанавливается следующее равновесие:
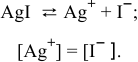
Рассчитаем произведение растворимости 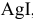 :
:
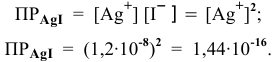
Задача 73
Рассчитать ЭДС свинцового аккумулятора, состоящего из шести банок, соединенных последовательно.
Решение:
Рассчитаем ЭДС одной банки свинцового аккумулятора. При разрядке аккумулятора происходят следующие процессы:
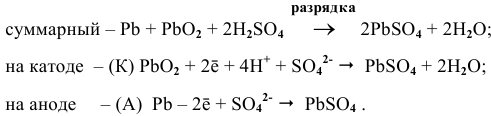
Для каждой из электродных полуреакций находим в справочнике значения стандартных электродных потенциалов:
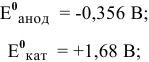
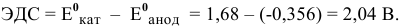
Электродвижущая сила шести последовательно соединенных банок будет равна:
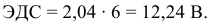
Эти задачи взяты со страницы решения задач по неорганической химии:
Задачи с решением по неорганической химии
Возможно эти страницы вам будут полезны:
| Задачи с решениями на водородный показатель |
| Задачи с решениями на окислительно-восстановительные (ов) реакции |
| Задачи с решениями на электролиз растворов |
| Задачи с решениями на коррозию металлов |
