Законы электролиза (фарадея)
Масса электролита, подвергшаяся разложению электрическим током, а также массы веществ, выделившихся на электродах, прямо пропорциональны количеству протекшего через электролит электричества и электрохимическим эквивалентным массам веществ:
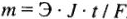 , где
, где
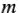 — масса электролита, подвергшегося разложению, или массы веществ — продуктов разложения, г;
— масса электролита, подвергшегося разложению, или массы веществ — продуктов разложения, г;
Э — масса вещества эквивалента, для которого рассчитывается т, г/моль;
J — сила тока, А;
t — продолжительность электролиза, с;
F — число Фарадея, F = 96500 Кл/моль.
Для газообразных продуктов рассчитывают объем, например, для водорода:
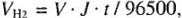
где 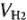 — объем выделившегося газа; V — объем молярной массы эквивалента.
— объем выделившегося газа; V — объем молярной массы эквивалента.
Эта теория взята со страницы подробного решения задач по всем темам химии:
Возможно эти страницы вам помогут:
| Кинетика электродных реакций в химии |
| Поляризация в химии |
| Выход по току в химии |
| Коррозия металлов в химии |
