| 🎓 Заказ №: 22180 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
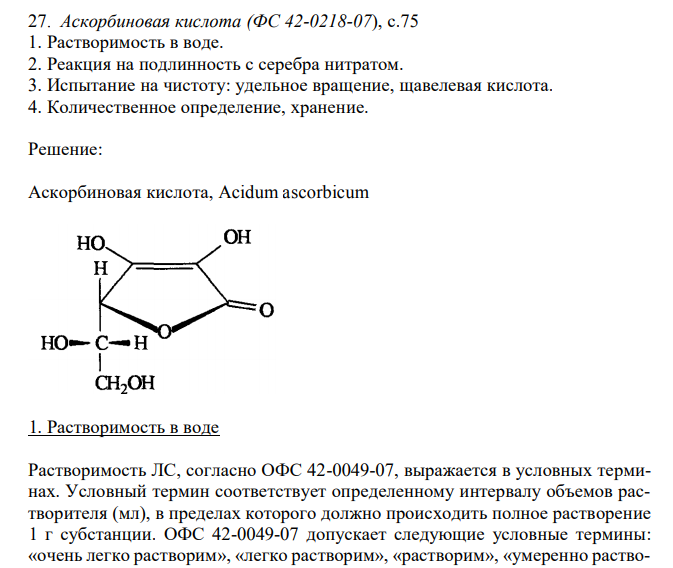
Аскорбиновая кислота (ФС 42-0218-07), с.75 1. Растворимость в воде. 2. Реакция на подлинность с серебра нитратом. 3. Испытание на чистоту: удельное вращение, щавелевая кислота. 4. Количественное определение, хранение.
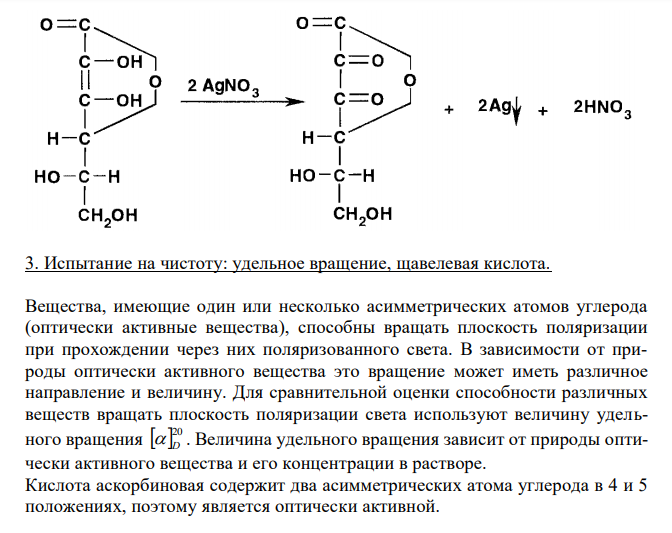
Решение: Аскорбиновая кислота, Acidum ascorbicum 1. Растворимость в воде Растворимость ЛС, согласно ОФС 42-0049-07, выражается в условных терминах. Условный термин соответствует определенному интервалу объемов растворителя (мл), в пределах которого должно происходить полное растворение 1 г субстанции. ОФС 42-0049-07 допускает следующие условные термины: «очень легко растворим», «легко растворим», «растворим», «умеренно растворим», «мало растворим», «очень мало растворим», «практически нерастворим». 307 Согласно ФС 42-0218-07, аскорбиновая кислота легко растворима в воде. То есть, для растворения 1 г субстанции необходим объем воды от 1 до 10 мл. К субстанции аскорбиновой кислоты массой 100 мг, растертой в тонкий порошок, прибавляют 1,0 мл воды и непрерывно встряхивают в течение 10 мин при 20 ± 2°С. Субстанцию считают растворившейся, если в растворе при наблюдении в проходящем свете не обнаруживаются частицы вещества. 2. Реакция на подлинность с серебра нитратом. Аскорбиновая кислота проявляет восстановительные свойства и легко окисляется. Способность к окислению обусловлена подвижностью атомов водорода ендиольной группировки. Особенно легко окисление протекает в растворах. Согласно ФС 42-0218-07, одна из реакций, используемых для подтверждения подлинности аскорбиновой кислоты, – взаимодействие с раствором серебра нитрата. При этом происходит окисление аскорбиновой кислоты до дегидроаскорбиновой кислоты. Катионы серебра восстанавливаются. Выпадает темный осадок (металлическое серебро). 3. Испытание на чистоту: удельное вращение, щавелевая кислота. Вещества, имеющие один или несколько асимметрических атомов углерода (оптически активные вещества), способны вращать плоскость поляризации при прохождении через них поляризованного света. В зависимости от природы оптически активного вещества это вращение может иметь различное направление и величину. Для сравнительной оценки способности различных веществ вращать плоскость поляризации света используют величину удельного вращения 20 D . Величина удельного вращения зависит от природы оптически активного вещества и его концентрации в растворе. Кислота аскорбиновая содержит два асимметрических атома углерода в 4 и 5 положениях, поэтому является оптически активной.

| Научись сам решать задачи изучив химию на этой странице: |
| Услуги: |
Готовые задачи по химии которые сегодня купили:
- Составьте электронные уравнения и укажите, какой процесс – окисление или восстановление происходит при следующих превращениях. P –3 → P +5
- Подберите по три молекулярных уравнения для реакций, которые выражаются следующими сокращенными ионно-молекулярными уравнениями: а) Al3+ + 3OH- = Al(OH)3; б) Mn2+ + S 2- = MnS↓
- С помощью метода электронного баланса расставьте коэффициенты в уравнениях окислительно-восстановительных реакций. Для каждого уравнения укажите, какое вещество является окислителем, какое восстановителем, а также процесс восстановления-окисления. K2Cr2O7 + HCl Cl2+ CrCl3 + KCl + H2O HClO3 + H2S → HCl + H2SO4
- Укажите восстановитель и окислитель в указанных реакциях.
- Реакция горения аммиака выражается уравнением: 4NH3(г) + 3O2(г) = 2N2(г) + 6H2O(ж).
- Что такое ковалентная связь? Приведите схему перекрывания электронных облаков при образовании молекул H2 и H2O.
- Электролиз водного раствора вещества X проводили с угольными электродами катодного и анодного процессов. X=KI
- Составьте уравнения реакций, расставив коэффициенты методом электронно-ионного или электронного баланса. Mg
- Для водного раствора CuSO4: напишите уравнения процессов, идущих на платиновых электродах при электролизе; рассчитайте, сколько и каких веществ выделится на катоде и аноде, если электролиз вести при силе тока 1А в течение времени 1 час.
- В 400 мл раствора (плотностью 1,5 г/мл) содержится 300 г растворенного вещества.
