| 🎓 Заказ №: 22193 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
Кальция глюконат (ФС 42-0238-07), с.72 1. Растворимость в кипящей воде. 2. Реакции подлинности на глюконат. 3. Испытание на чистоту: прозрачность, сульфаты. 4. Количественное определение, хранение.
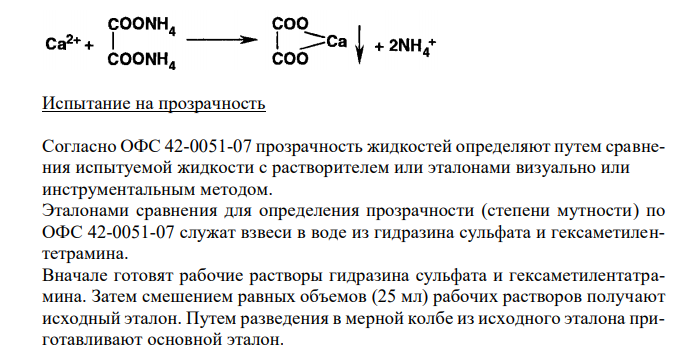
Решение: Кальция глюконат, Calcium Gluconate Растворимость в кипящей воде Растворимость веществ согласно ОФС 42-0049-07 выражается в условных терминах. Условный термин соответствует определенному интервалу объемов растворителя (мл), в пределах которого должно происходить полное растворение 1 г препарата. ОФС 42-0049-07 допускает следующие условные термины: «очень легко растворим», «легко растворим», «растворим», «умеренно растворим», «мало растворим», «очень мало растворим», «практически нерастворим». Согласно ФС 42-0238-07, кальция глюконат легко растворим в кипящей воде. То есть, для растворения 1 г препарата необходим объем кипящей воды от 1 до 10 мл. Для подтверждения подлинности и доброкачественности навеску предварительно растертого кальция глюконата массой 1,00 г вносят в 1 мл кипящей воды и непрерывно встряхивают в течение 10 мин при 20 ± 2°С. Препарат считают растворившимся, если в растворе при наблюдении в проходящем свете не обнаруживаются частицы вещества. В случае неполного растворения препарата постепенно небольшими порциями прибавляют кипящую воду (до объема 10 мл) при непрерывном встряхивании. Если навеска полностью растворится в объеме растворителя от 1 до 10 мл, то делают вывод о доброкачественности препарата. Согласно ФС 42-3019-94 подлинность кальция глюконата подтверждается: А — реакцией с раствором железа окисного хлорида. Навеску препарата массой 1,00 г растворяют в 50 мл воды и прибавляют 0,3 мл 3 % раствора железа окисного хлорида. Наблюдается светло-зеленое окрашивание. Б – характерной реакцией на катионы кальция. Сущность этой реакции заключается в том, что катионы кальция при взаимодействии с оксалат–ионами (в слабощелочной среде) образуют оксалат кальция в виде белого кристаллического осадка или белой мути, нерастворимых в разведенной уксусной кислоте и растворе аммиака. 137 Испытание на прозрачность Согласно ОФС 42-0051-07 прозрачность жидкостей определяют путем сравнения испытуемой жидкости с растворителем или эталонами визуально или инструментальным методом. Эталонами сравнения для определения прозрачности (степени мутности) по ОФС 42-0051-07 служат взвеси в воде из гидразина сульфата и гексаметилентетрамина. Вначале готовят рабочие растворы гидразина сульфата и гексаметилентатрамина. Затем смешением равных объемов (25 мл) рабочих растворов получают исходный эталон. Путем разведения в мерной колбе из исходного эталона приготавливают основной эталон.



| Научись сам решать задачи изучив химию на этой странице: |
| Услуги: |
Готовые задачи по химии которые сегодня купили:
- Подберите коэффициенты в схемах окислительно-восстановительных реакций.
- В каком направлении сместится равновесие реакции PCl PCl Cl , H 92,45 кДж/ моль 5 3 2 298 если повысить температуру на 40 °С ?
- Характеристика элемента с порядковым номером 20.
- Даны уравнение реакции и исходные концентрации веществ (см. вариант табл. 4). 1. Запишите выражение для константы равновесия KC химической реакции через концентрации веществ.
- Составить гальванический элемент из Cr(3) и Cu.
- Исходя из степени окисления хрома в веществах Cr, KCrO2, K2Cr2O7, определите, какое из них может быть только восстановителем, только окислителем или проявляет окислительно-восстановительную двойственность?
- Дано уравнение реакции (см. вариант в табл.4). 1. Для всех веществ, участвующих в реакции, выпишите из приложения 1 значения стандартных термодинамических величин f H298 и 298 S . 2. Вычислите изменение энтальпии реакции реакции rH298 и определите, является ли данная реакция экзо- или эндотермической.
- Сделайте предварительный расчёт объёма 0,1 М раствора хлористоводородной кислоты, который должен израсходоваться при количественном определении субстанции натрия гидрокарбоната по методике ГФ XII, ч.3, ФС 42- 3076-94 (см. приложение, с. 69). М.м. 84,01.
- Напишите формулы: а) монобромпроизводного метана; б) монохлорпроизводного этана.
- Дано комплексное соединение (см. вариант в табл. 10). 1. Укажите: а) внутреннюю и внешнюю сферы, их заряды;
