| Заказ №: 22217 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
Можно ли при стандартных условиях окислить хлороводород до хлора Cl2 с помощью серной кислоты, если G кДж моль 298 HCl(г) 95,27 ; G кДж моль H SО a q 742,00 298 2 4 ; G кДж моль 298 H S г 33,02 2 G ж кДж моль H О 237,5 298 2 ?
Решение Проводим подбор коэффициентов 293 8 (г) ( ) 4 ( ) (г) 4 (ж) HCl H2 SO4 aq Cl2 к H2 S H2O Определяем G298 процесса

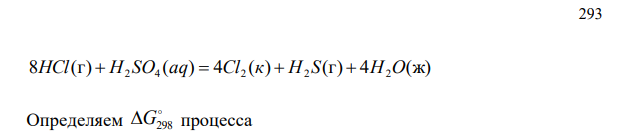
| Научись сам решать задачи изучив химию на этой странице: |
| Услуги: |
Готовые задачи по химии которые сегодня купили:
- Методом электронно-ионного баланса подберите коэффициенты окислительно-восстановительной реакции: KI + KIO3 + H2SO4 = I2 + K2SO4 +H2O
- Напишите уравнения реакций в молекулярном и ионном виде следующих превращений. Назовите все соединения: Ca → CaO → Ca(OH)2 → Ca(NO3)2 → CaSO4
- Окислительно-восстановительные реакции выражаются схемами: AgNO3 + Na2SO3 + NaOH → Na2SO4 + Ag + NaNO3 + H2O KClO3 → KClO4 + KCl.
- Исходя из степени окисления хрома в соединениях K2Cr2O7, Cr2(SO4) 3, CrO определите какое из них является только окислителем, только восстановителем и какое может быть как окислителем так и восстановителем.
- Общая жесткость волжской воды равна 6,52 ммоль/л, а временная – 3,32 ммоль/л.
- Осуществить химические превращения для молекул органических соединений, указав реагенты, с которыми вступают в реакцию.
- Какое из веществ Al(OH)3; H2SO4; Ba(OH)2 будет взаимодействовать с гидроксидом калия?
- Реакция термического разложения аммиачной селитры NH4NO3 может протекать одновременно по двум стадиям: NH3 + HNO3 NH4NO3 NH3 + NO2 + O2
- Дописать правую часть уравнения и расставить коэффициенты: Окислители – простые вещества.
- Какие из перечисленных веществ будут взаимодействовать с раствором гидроксида натрия: Р2О5, СО2, А1(ОН)3, MgO, H2SO4.
