| Заказ №: 22217 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
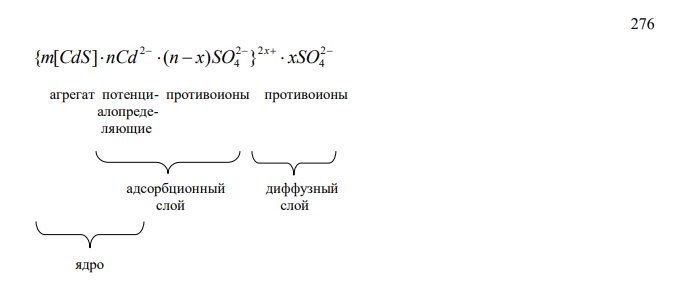
Напишите формулы мицелл, полученных сливанием равных объемов электролитов 0,01 н. CdSO4 и 0,001 н. H2S. Приведите названия всех составляющих мицеллы. Укажите место возникновения дзета-потенциала.
Решение Записываем уравнение реакции CdSO4 H2 S H2 SO4 CdS Поскольку при равных объемах смешиваемых растворов концентрация сульфата кадмия больше, то он находится в избытке. Строение мицеллы сульфида кадмия гранула 276 2 4 2 2 4 2 {m[CdS] nCd (n x)SO } xSO x агрегат потенци- противоионы противоионы алопреде- ляющие адсорбционный диффузный слой слой ядро

| Научись сам решать задачи изучив химию на этой странице: |
| Услуги: |
Готовые задачи по химии которые сегодня купили:
- Составьте уравнения реакций, протекающих на электродах при электролизе водного раствора сульфата железа (II) при нерастворимом аноде.
- Методом электронного баланса подберите коэффициенты в данной схеме окислительно-восстановительной реакции.
- Осуществите следующие превращения Sn → Sn(NO3)2 → Sn(OH)2 → SnCl2 → SnCl4 → Sn Для окислительно-восстановительных реакций приведите уравнения электронного баланса, реакции ионного обмена запишите в молекулярной и ионной формах.
- Виды экспертизы: дополнительная, повторная, комплексная, комиссионная.
- Окислительно-восстановительные реакции выражаются ионными уравнениями: а) Cr2O7 2- + 6Cl- + 14H+ = 2Cr3+ + 3Cl2 + 7H2O б) 2Fe3+ + S 2- = 2Fe2+ + S.
- Внешние и предпоследние энергетические уровни атомов имеют вид: …3d 24s 2 ; …4d 105s 1 ; …5s 25p 6 .
- При сгорании 3 кг углеводорода было получено 8,8 кг углекислого газа и 5,4 кг воды.
- Начальные концентрации исходных веществ в системе CO + Cl2 → COCl2(г) были равны 0,3 моль/л CO и 0,2 моль/л Cl2.
- Написать формулу вещества: а) сульфат тетрамминмеди (II) б) тетрагидроксо-(II) купрат натрия в) гексацианоферрат (III) калия
- Расставьте коэффициенты в уравнении окислительно-восстановительной реакций методом электронного баланса: Na2S + KMnO4 + H2O = S + MnO2 + NaOH + KOH
