| 🎓 Заказ №: 22193 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
Рассмотрите основность органических соединений с точки зрения теории Бренстеда и Льюиса. Дайте сравнительную характеристику оксониевых и аммониевых оснований на примере простых эфиров, спиртов, фенолов, алифатических и ароматических аминов. Обоснуйте, приведите соответствующие уравнения реакций. Дайте определение понятиям: субстрат, реагент, механизм реакции. Приведите типы реакций. Охарактеризуйте статические и динамические факторы, влияющие на реакционную способность органических соединений.
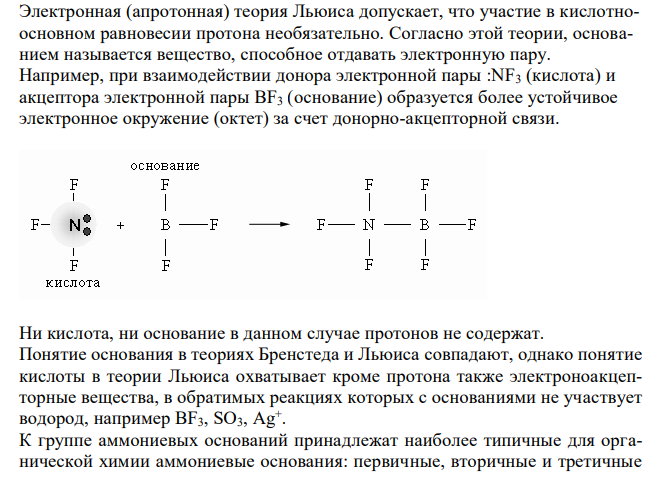
Решение: Согласно протонной теории Бренстеда основанием называется любая частица (молекула или ион), которая может присоединить (акцептировать) протон. Любому основанию соответствует сопряженная с ней кислота, например Любое кислотно-основное равновесие включает взаимодействие двух пар сопряженных кислот и оснований. Основания могут быть: а) нейтральными б) анионными в) катионными NH2-NH3 + В определенных условиях многие вещества могут вести себя как кислота или как основание. Поэтому правильнее говорить о кислотно-основных свойствах данного вещества. Теория Бренстеда объясняет основной характер таких органических соединений, как эфиры, спирты, фенолы, амины тем, что они присоединяют Н+ на неподеленные пары азота или кислорода, образуя оний-катионы. Электронная (апротонная) теория Льюиса допускает, что участие в кислотноосновном равновесии протона необязательно. Согласно этой теории, основанием называется вещество, способное отдавать электронную пару. Например, при взаимодействии донора электронной пары :NF3 (кислота) и акцептора электронной пары BF3 (основание) образуется более устойчивое электронное окружение (октет) за счет донорно-акцепторной связи.


| Научись сам решать задачи изучив химию на этой странице: |
| Услуги: |
Готовые задачи по химии которые сегодня купили:
- Мышьяк образует два оксида с массовыми долями мышьяка 65,2 % и 75,8 %.
- 20 % раствор FeSO4 имеет плотность 1,213 г/см3 .
- Охарактеризуйте влияние электронодонорных и электроноакцепторных заместителей на направление и скорость реакции электрофильного замещения в ароматическом ядре.
- Сколько протонов и нейтронов содержат ядра изотопов Se 78 34 и Se 82 34 ?
- Укажите ответ в виде соответствующей буквы с полным обоснованием выбора ответа и написанием химизма реакции.
- Написать уравнения диссоциации следующих соединений: KOH, H2SiO3, Al2(SO4)3, HF.
- По формулам написать названия веществ: а) NiO, б) CaSiO3, в) Al(OH)2Cl; По названию написать формулы веществ: а) сульфат бария, б) гидроксид кобальта (II), в) гидрокарбонат калия.
- Дайте обоснование ацидиметрическому методу количественного определения натрия тетрабората (ГФ XII, ч. 3, ФС 42 -, см. приложение с. 63).
- Константа равновесия реакции N2 + 3H2 ↔ 2NH3 равна 0,1 (при температуре 400 °С).
- На основании электронных уравнений расставьте коэффициенты в уравнениях реакций; укажите окислитель и восстановитель: S KOH K2 S K2 SO3 H2O KMnO4 K2MnO4 MnO2 O2
