| 🎓 Заказ №: 22177 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
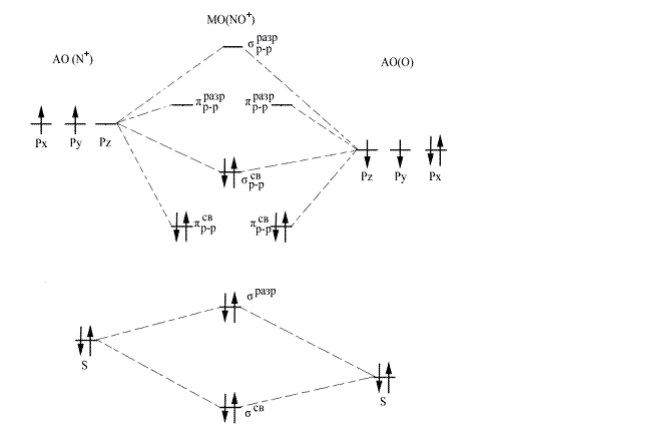
Составьте энергетическую диаграмму МО частиц NO+ , NO и NO- и сравните их кратность и энергию связей.
Решение: В методе молекулярных орбиталей молекула рассматривается как единая система, содержащая ядра и электроны. При образовании молекулы возникают молекулярные орбитали двух видов – связывающие и разрыхляющие. Если при образовании молекулы из атомов переход электрона молекулярную орбиталь сопровождается уменьшением энергии, то такая молекулярная орбиталь будет связывающей, если повышением энергии, то – разрыхляющей. Порядок размещения электронов по молекулярным орбиталям: прежде всего заполняются орбитали с низкой энергией, заполнение орбиталей подчиняется принципу Паули и правилу Хунда. Кратность связи – число связей между атомами двух элементов. Чем больше кратность связи, тем больше энергия связи и тем меньше длина связи. По методу МО кратность связи (к.с.) определяется по формуле 2 . . . . число электронов на связ МО число электронов на разр МО к с то есть половина разности между числом электронов на связывающих молекулярных орбиталях и числом электронов на разрыхляющих молекулярных орбиталях. Электронное строение частицы NO+ [KK*( 2s) 2 ( *2s) 2 (p2px) 2 (p2py) 2 ( 2pz) 2 ]. Энергетическая диаграмма МО частицы NO+ имеет следующий вид


| Научись сам решать задачи изучив химию на этой странице: |
| Услуги: |
Готовые задачи по химии которые сегодня купили:
- Начальные концентрации реагирующих веществ реакции СО + Н2О(г) → СО2 + Н2 были равны (моль/дм3 ): [CO] = 0,8; [H2O] = 0,9; [CO2] = 0,7; [H2] = 0,5.
- Какими химическими свойствами обладает искусственно полученный элемент с порядковым номером 87?
- При стандартных условиях реакция 2 2( ) 2 ( ) 1 H2(г) О г Н О ж протекает самопроизвольно.
- Сделайте предварительный расчет объема 0,1 М раствора натрия тиосульфата, который должен израсходоваться на титрование 25,0 мл раствора, полученного растворением 2,0000 г фенола в мерной колбе вместимостью 1,0 л, добавлено 50,0 мл 0,0167 М раствора калия бромата.
- Дайте заключение о качестве фенилсалицилата (М.м. 214,22) по количественному содержанию с учётом требования ФС.2.1.0199.18 (фенилсалицилата должно быть не менее 99,0 % и не более 100,5 % в пересчете на свободное от остаточных органических растворителей вещество), если к навеске 1,0025 г прибавили 25,0 мл 0,5 М раствора натрия гидроксида, на избыток которого израсходовалось 15,70 мл 0,5 М раствора хлористоводородной кислоты (К = 1,0000).
- Проверьте, нет ли угрозы того, что оксид азота (I), применяемый в медицине в качестве наркотического средства, будет окисляться кислородом воздуха до весьма токсичного оксида азота (II) по реакции 2N2O(г) + О2(г) = 4NO(г).
- Обоснуйте испытание салициловой кислоты по показателю «Железо» в соответствии с требованиями ФС.2.1.0033.15 (Приложения № 3, 7).
- Дайте обоснование фармакопейному методу количественного определения сульфадиметоксина по методике ФС.2.1.0180.18 (Приложение № 3).
- Приведите уравнения реакций взаимодействия: а) пара-бромфенола с едким натром; б) фенола с формальдегидом в кислой среде; в) фенолята натрия с бромистым этилом.
- Вычислите процентное содержание безводной соли в растворе, полученном растворением 0,01 моль Al2(SO4)3·18H2O в 1 моль воды.
