Оглавление:





Аддитивный расчет мольного критического объема
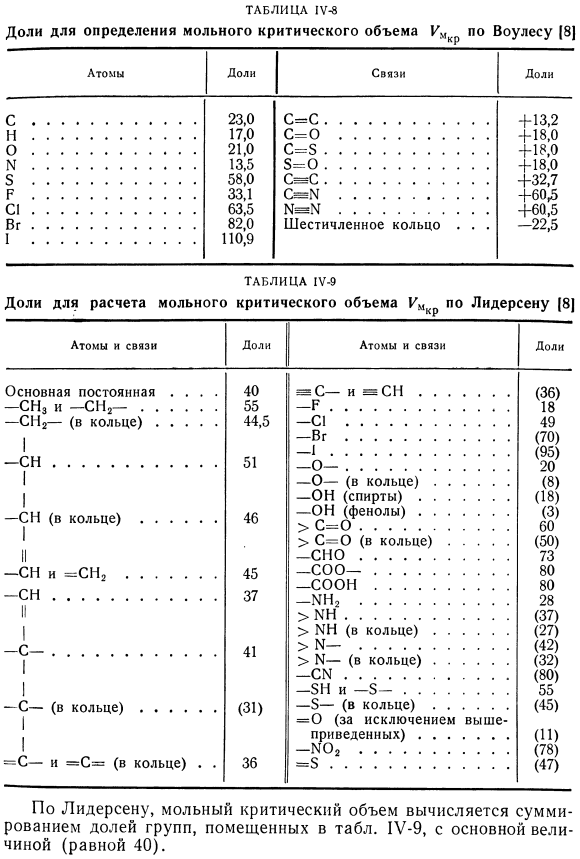
Аддитивный расчет мольного критического объема. Молярный объем 1 / Мкип при нормальной температуре кипения жидкости является приблизительной величиной добавления (правило Коппа, фракция Шредера, Le Baix-Ch. II). Более точный расчет значений молярного объема в ТКПП является очень сложной задачей, так как необходимо учитывать структуру молекулы (дробные значения зависят не только от типа атома, связи или группы, но и от соседних атомов и групп в молекуле). Можно определить значение 1 / м по доле параколла и моля cr. Рефракция по формуле Мейснера (1U-7). Voules [8] обобщил таблицу долей молярного критического объема V *(таблица 1U-8).
Аналогичную задачу можно увидеть при расчете сложения молярного критического объема. Людмила Фирмаль
- Более подробная таблица была предложена лиdersen [8](таблица IV 9), значения в скобках не являются надежными. Таблица 1У-8 Фракции для определения молярного критического объема км согласно Voules / 8 | Таблица 1У-9 Фракция для расчета критического молярного объема КМКР по лиддерсену[8] Согласно Лидерсену, молярный критический объем вычисляется путем суммирования пропорций групп, расположенных в таблице. 1U-9, основное значение (равное 40). Он рекомендует метод расчета величины сложения, заключающийся в замене групп, атомов или связей типичного соединения (известен молярный объем) на другие, фракции которых известны, с целью получения тестируемого соединения из типичного соединения.
При замене одних групп, атомов или связей другими значения разности в доле, которая добавляется к молярному объему типичного соединения, приведены в таблице. Таблица показывает молярные критические объемы типичного вещества. Ив-106. Таблица 1 \ M0a Разница в доле молярного критического объема(7) Таблица 1У-106 Молярный критический объем типичного вещества, см! Мкмоль / 7) Пример 1У-6.Рассчитайте критический объем молярного 2,4-триметилпентана n хлорбензола с помощью метода Риделя. Решение. Н. 1 СН3 1 н 1 СН 1 н 1. н-с-1 1 С-1. с.1 секунда. 1 1. с N 1. 1. Н 1 sn3 1. Н 1 Н 1 н. В типичном веществе (пропан) 5 атомов водорода, обозначенных звездочкой*, заменяются группой CH$. Н Н Н * Я. Н * С-С-С-Н * Я я я н * н н Молярный объем типичного вещества (Пропан) 195 см * / моль 5 замещений атомов H на CH3 группы 5 * 59 = 259 см * {моль = 490 СМГ! Мэл. cr. Экспериментально найдено Умкр = 470 СМГ! Моль. Погрешность расчета составляет + 4,3%. 2.
- В типичном веществе (циклогексане) необходимо заменить 3 связи CH — CH на C = C, а атом I H на C1. Расчет в: cr. Типичный объем вещества (циклогексан) 308 см?(Литератор 3 подстановка CH-CH = CH при C. 3 (-17)= −51 СМГ / моль C1 H1 замещен+44 см ^ моль Umkr =: 301 см3 / моль V * найдено экспериментально. = 308 см * / моль. cr. Погрешность расчета составляет −2,3%. Тодос предложил формулу для расчета молярного критического объема алифатических углеводородов (насыщенных и ненасыщенных: К * СГ =нет (1У-19) Где b-константа уравнения ван-дер-Ваальса, вычисленная путем суммирования долей (см. главу II). Р-коэффициент.
Его величина зависит от количества атомов углерода в нас и их расположения в молекуле углеводорода. согласно ван дер Ваальсу, U*. = 3 b, но так как это не точно Зависимости, то Тодос ввел поправочный коэффициент р. Для насыщенных углеводородов нормальной структуры значение Р определяется по формуле: = 0,7849-0,0137 МС(1U-20) Где y-число атомов углерода в молекуле. Если цепь насыщенных углеводородных молекул разветвлена: = 0.8100-0, ОШ(1У-21) Р-значение ненасыщенных алифатических углеводородов определяется путем умножения соответствующего значения насыщенных углеводородов на 0,9931. Рсн, = 0,9931 РС » (1У-22) I 2L P% PM Пример 1У-7.Рассчитайте молярный критический объем гептана. Решение. Найдите общую долю Ф&(см. вкладку P-17).
Согласно Риделю, добавление критического молярного объема материала путем суммирования фракций не дает точных результатов. Людмила Фирмаль
- Метан(первичное значение)… 17.371. Первая замена ч3. 。 * 6,497 5 порядок перестановки 1(2). •5•6.686 = 33.430 2Ф » = 57,298 Если заменить его формулой (11-18), то он выглядит так: Отсюда: 57.298 = б° н б * 205.8 РМЖ (молярная По формуле (1U-20) это выглядит так: = 0,7849-0,0137■7 = 0,6913 UMcr = 3•0.6913•205.8 = 426,8 см ^ моль Умкр » 426 СМГ \ моль найдено экспериментально. Погрешность расчета+ 0,2%. По мнению многих исследователей[6-8], погрешность расчета критического молярного объема по-разному является средней (% : Метод Мейснера-формула (1U-7)^ 3.4 Вкладка метод Leadersen. 1У-9—2.1 Метод Риделя-таб. 1U-10a и 106 <2 Метод Тодос-Формула (IV-19) < 1.3
Смотрите также:
Возможно эти страницы вам будут полезны:
