Оглавление:




Ароматические углеводороды (арены)
- Ароматические углеводороды (Арена) Представители ароматических углеводородов-C6H6BENZENE и его гомологи-уже упоминались в предыдущем разделе. Их молекулы имеют циклическую структуру(с. 157). кроме того, некоторые из них обладают приятным ароматом. Поэтому их прежнее историческое название-ароматические углеводороды-сохранилось.
- В настоящее время такого запаха нет, но известно много веществ, которые по своей структуре и химическим свойствам классифицируются как ароматические углеводороды. Бензол является наиболее типичным представителем ароматических углеводородов, молекула которых имеет 6 атомов углерода. Структура молекулы бензола.
Экспериментальные данные показывают около 92,3% углерода в молекуле бензола и молекуле ацетилена. Людмила Фирмаль
Поэтому самая простая формула для бензола такая же, как формула для ацетилена-CH. Но плотность паров бензола в водороде равна 39, а масса моля-78 г(2 дн,= 2 * 39).Если формула бензола на самом деле CH, то масса моля должна быть 78 г, а не 13 g. So, молекула бензола состоит из 6 атомов углерода и 6 атомов водорода (78: 13 = 6), молекулярная формула которых C6H6.
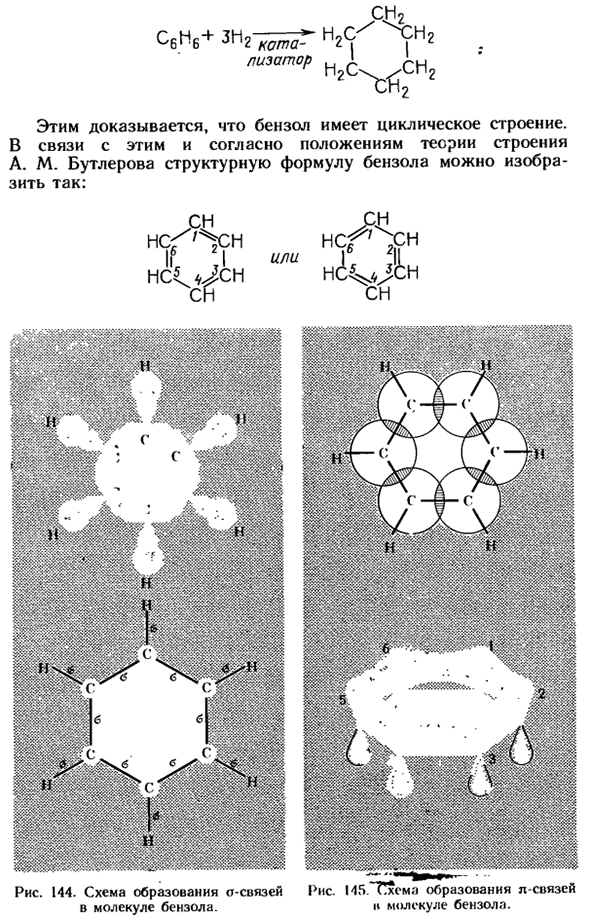
Эксперименты показали, что в присутствии катализатора при высоких температурах 3 молекулы водорода связываются с каждой молекулой бензола, образуя циклогексан. C6H6 + Предатель. n2с xn2 ^ ^ H2C \ ^ CH2 Это доказывает, что бензол имеет циклический характер structure. In в связи с этим, согласно положениям теории строения бторелова, структурная формула бензола может быть выражена следующим образом: ХКФ ^ ч Миллиард £Ч НСГ ’ ^ ЦН Я Или экс ^ ЗП нс * ГЛ.. …..»:•;■:■:::■:•:: :: Шшшшшшшш: wshr \ ЗР НМК Шии С’ , ? ■ Рисунок 145. G.
II схема образования l связей молекул бензола. В.//. Один ■ Рисунок 144.Схема образования связи молекул бензола. Рисунок 146.Интегральная структурная схема молекулы бензола. Основываясь на последних представлениях об электронном облаке, его форме и взаимном перекрытии, можно более точно определить расположение химических связей в молекуле бензола.
Согласно современным представлениям, в молекуле бензола каждый атом углерода гибридизуется с 1 s-электронным облаком и 2 p-электронным облаком (гибридизация sp2), а 1 p-электронное облако не гибридизуется. Все 3 перекрывающихся гибридных электронных облака образуют o-связь в одной плоскости.2 из них перекрывают друг друга, а 3-й-с s-электронным облаком водорода atom.
As в результате образуются 3 o связи (рис. 144).Не-гибридизации Р-электронного облака атома углерода перпендикулярно плоскости, в направлении Бонд. Эти облака также перекрывают друг друга. Поскольку трудно показать перекрытие всех электронных облаков на 1 диаграмме, мы рассмотрим 2 фотографии подряд.
В цикле молекул бензола отсутствуют 3 отдельные двойные связи (рис.145).Если символы атомов углерода в цикле молекул бензола пронумеровать по часовой стрелке, то можно увидеть, что негибридизированные Р-электронные облака первого атома углерода перекрываются с негибридизированными Р-электронными облаками 2-го и 6-го атомов углерода, а р-электронные облака 2-го и 3-го атомов углерода перекрываются с негибридизированными Р-электронными облаками 2-го и 3-го атомов углерода. clouds.
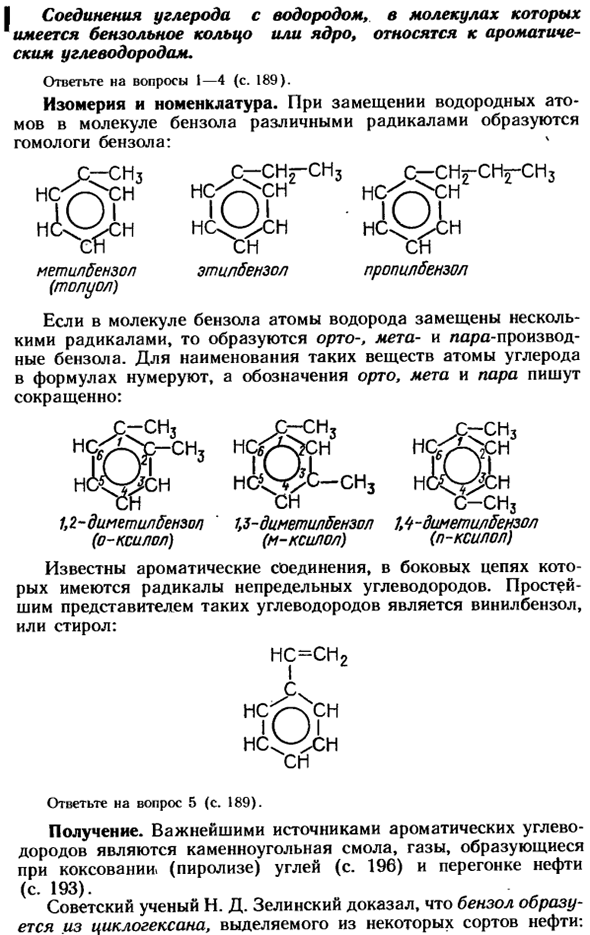
To чтобы показать однородность связей в молекуле бензола, структурная формула рисуется с использованием одной из схем, показанных на рисунке 146 (1). Поскольку тли равномерно распределены в молекуле бензола, структурная формула бензола H3oVn ^более точна в виде шестиугольника с кругом внутри. ИБТ / МГО содержит много ароматических углеводородов, таких как бензол.
Соединение углерода и водорода с бензольным кольцом или бензольным ядром в молекуле представляет собой ароматический углеводород. Вопрос 1-4 (стр. 189). Гетеросексуальность и номенклатура. При замещении атомов водорода в молекуле бензола различными радикалами образуется гомолог бензола. Толуол этилбензол (Толуол) Пропилбензол При замещении атома водорода молекулы бензола несколькими радикалами образуются Орто -, Мета-и Лара-производные бензола. formed.
- To назовите такое вещество, атомы углерода в Формуле пронумерованы, символы Орто, Мета и пар записаны аббревиатурами. 1, г-imegtschljensol с-диметилбензол 1,4-диметилбензол (о-ксилол) (м-ксилол)(п-ксилол) Ароматические соединения, как известно, имеют ненасыщенные углеводородные радикалы в своих боковых цепях.
Простейшим представителем таких углеводородов является винилбензол, или Стирол. Наиболее важным источником ароматических углеводородов является каменноугольная смола, газ, образующийся при коксовании, термическом разложении угля(с. 196), а также перегонка нефти. (стр. 193).
IP = SM2 Ответьте на вопрос 5 (стр. 189). Мы получили ваши отзывы. Людмила Фирмаль
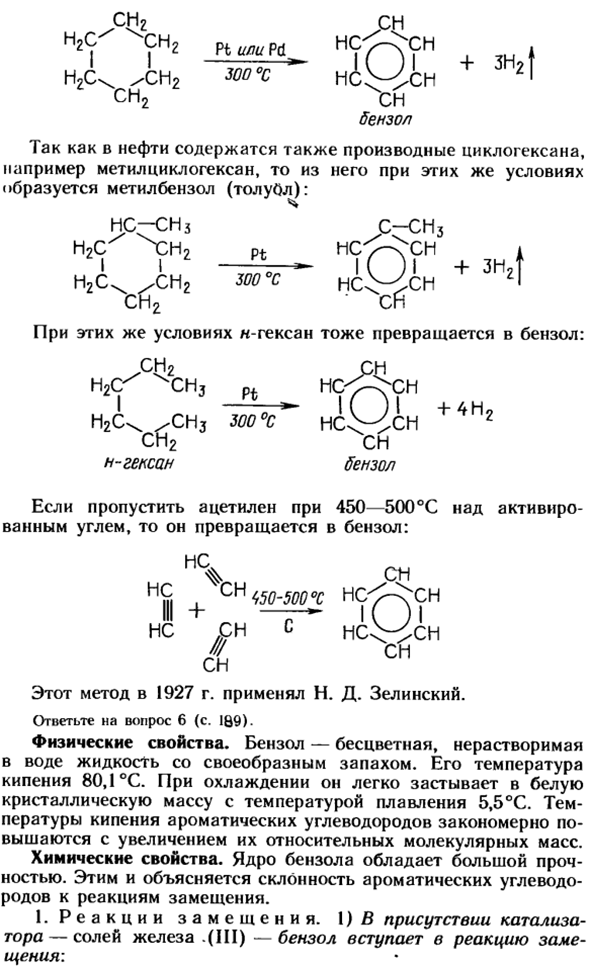
Советский ученый Н. Д. Зелинский доказал, что бензол образуется из циклогексана, который выделяется из определенного сорта нефти. — Си? / СИ CH2 Нидиры H9 ^ 9M, 4 С I2C \ ih2 на ^ Н + 3H21 см2 ЗП Бензол Потому что масло также содержит производные циклогексана、 Например, метилциклогексан, а затем в тех же условиях Образуется метилбензол (толуол) : х NS-CH3 C-CH3 Н <«К) fн + Отель h2c ^ СН2 300 «с НС <^ ЦН
При тех же условиях и-гексан может быть также бензолом. Н2С^ ^СНз300 » S * NS ^ CN + 4NG СН2 СН Н-гексан-бензол Когда ацетилен пропускают через активированный уголь при температуре 450-500°C, он превращается в бензол. СР%ч Ч | + Ч $ 50-500°С Н. зп и HCWCH д ЗП cn Этот метод в 1927 году был использован в виде ofn. D. It был использован Зелинским. Ответьте на вопрос 6 (стр. 189). Физические характеристики. Бензол-бесцветная, нерастворимая в воде жидкость со специфическим запахом.
Его температура кипения составляет 80,1°С. При охлаждении он легко затвердевает до белой кристаллической массы с температурой плавления 5,5°с. Температура кипения ароматических углеводородов естественным образом увеличивается с увеличением относительной молекулярной массы. Химическое свойство. Ядро бензола обладает большой прочностью. Это объясняет тенденцию реакций замещения ароматических углеводородов.
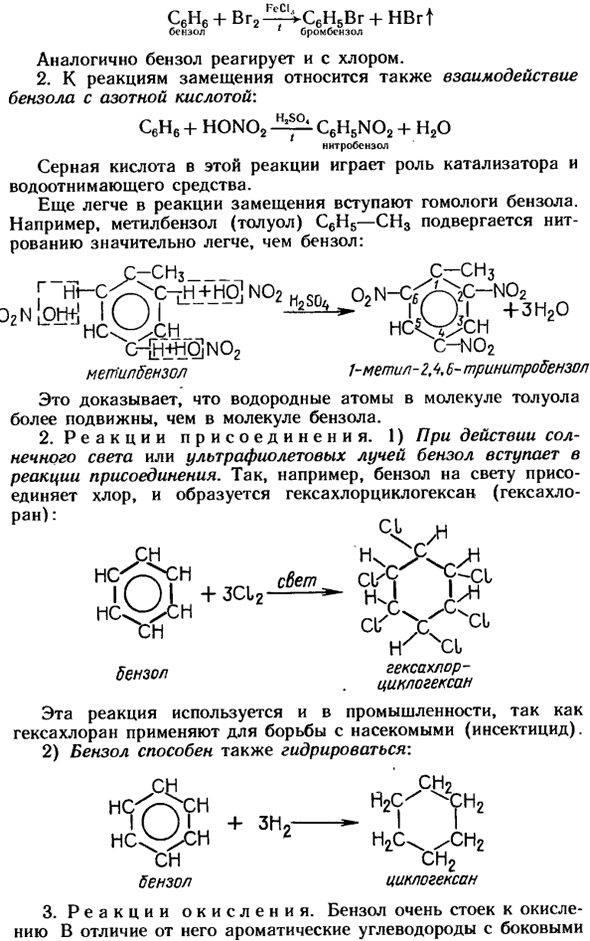
1.Реакция замещения. I) в присутствии катализатора-соли железа (III) — бензол вступает в реакцию замещения: С6Н6+Вгг-^С6Н5Вг+ HBrt 1 B, B, B, B, B. Бензол реагирует аналогично хлору. 2.Реакция замещения также включает взаимодействие бензола с азотной кислотой. C6H6 + H0N02 C6H5N02 + H20 Нитробензол Серная кислота в этой реакции играет роль катализатора и дренажного агента и чистящего агента. Еще проще, гомологи бензола вступают в реакцию замещения.
Например, метилбензол (толуол) С6Н5—СН3 нитруется гораздо легче, чем бензол. С-СМз _ _ _ _ −3 Н\ — С< — >С-гН + но] N02HOON ^ ^ VC-NOZ C — [H + HQjN02 C-NO2 Метилбензол метил 2,4, 6-тринитробензол Это доказывает, что атом водорода молекулы толуола более подвижен, чем молекула бензола. 2.Дополнительные реакции. I) из-за действия солнечного света и ультрафиолетовых лучей бензол имеет сцепление reaction.
So например, в легком бензоле хлор связывается и образуется гексахлоран (гексахлоран). / Северный ХК ^ ч C1CX в Гексахлор бензол Циклогексан Гексахлоран используется для борьбы с насекомыми (инсектицидами), поэтому эта реакция также используется в промышленности. 2) бензол можно также гидрировать: Ч2 + ZN2-Я / Ч2 СН2 Циклогексан 3.Реакция окисления. Бензол очень устойчив к окислению. Цепь относительно легко окисляется. I) под действием высокоэнергетического окислителя (KMp04) на гомолог бензола окислению подвергается только боковая цепь.
Например, если налить в пробирку 2-3 мл толуола, добавить раствор марганцовки и нагреть его, то можно увидеть, что фиолетовый цвет раствора постепенно исчезает. Это связано с тем, что метильная группа под действием перманганата калия Толуол окисляется и становится группой- П С6Н5—СН3-я — 30С6Нб-С^ +Н20 Он был Бензойная кислота 2) бензол и его гомологи при горении воздуха пламенем дыма » 2С6Н6+ 150212С026Н20
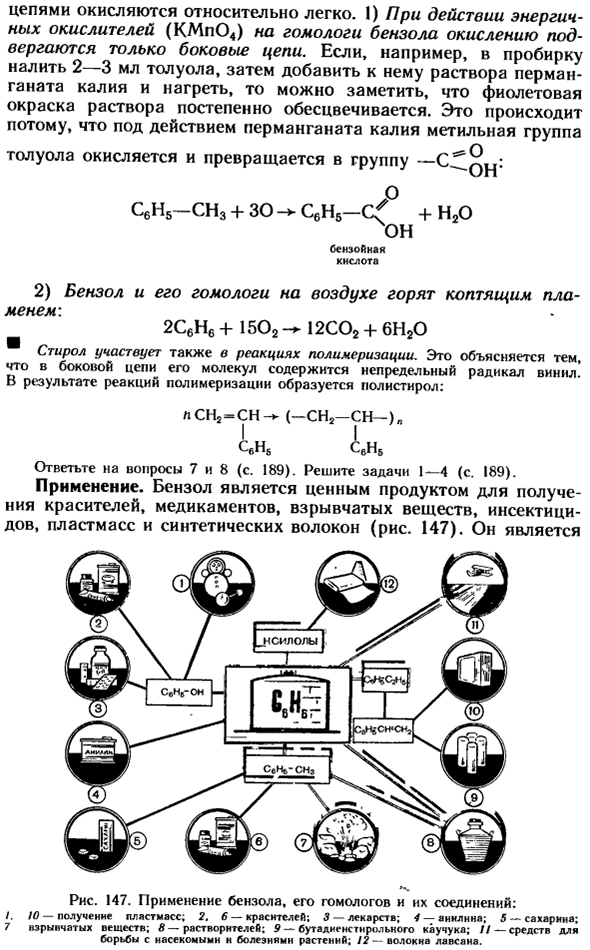
Стирол также участвует в реакции полимеризации. Это связано с тем, что ненасыщенные виниловые радикалы содержатся в боковых цепях его molecules. As в результате реакции полимеризации образуется полистирол: ГЛ..-)» Я Sv6 Sv6 Ответьте на вопросы 7 и 8 (стр. 189).Задача 1-4 (стр. 189).Приложение. Бензол является ценным продуктом, красителей, лекарств, взрывчатых веществ, инсектицидов, пластмасс и синтетических волокон (рис. 147).Он был л СН2-СН(—CHJ успешно Рисунок 147.
Применение бензола, его гомологов и их соединений:/. 10-наличие пластика. 2. 6-красители; 3-лекарственные препараты; 4-анилин; 5-сахарин; 7-взрывчатые вещества; 8-растворители; 9-бутадиеновый каучук; / / — средства борьбы с насекомыми и болезнями растений. / 2-Лавсановое волокно. Это также отличный растворитель для многих органических веществ. Толуол в основном используется в производстве красителей и тринитротолуола.
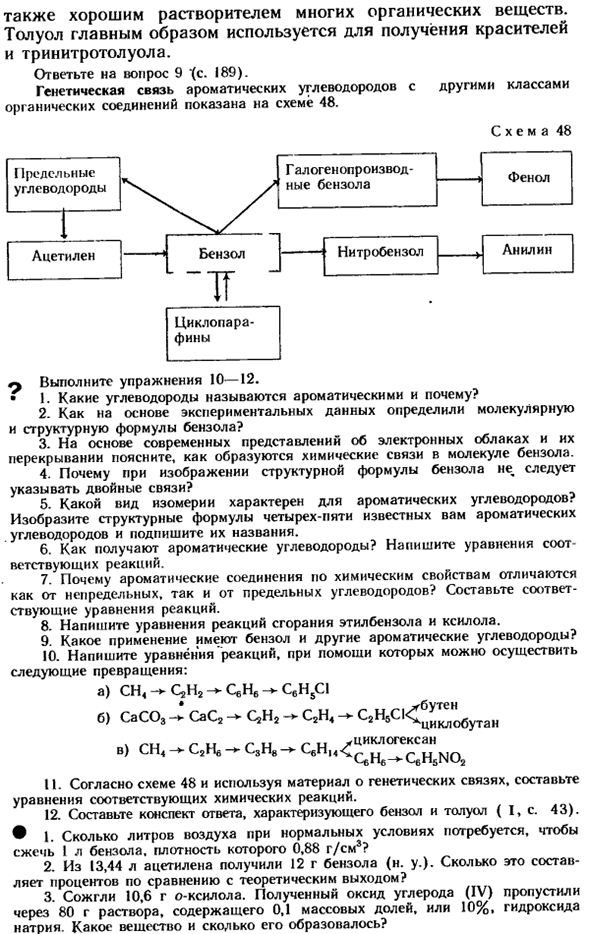
Ответьте на вопрос 9 (стр. 189). Генетическая связь между ароматическими углеводородами и другими классами органических соединений показана на схеме 48. Рисунок 48 Циклофарафин Выполните 10-12 упражнений. * 1.Что такое углеводород называется ароматическим и почему? 2.Как определить молекулярно-структурную формулу бензола на основе экспериментальных данных?
3.Основываясь на последних представлениях об электронном облаке и его перекрытии, мы опишем, как образуются химические связи в молекуле бензола. 4.Почему при составлении структурной формулы бензола необходимо указывать двойную связь? 5.Какой тип изомерии характерен для ароматических углеводородов? Нарисуйте структурную формулу известных 4-5 ароматических углеводородов и подпишите их названия.
6.Как получить ароматические углеводороды? Напишите уравнение соответствующей реакции. 7.Почему химия ароматических соединений отличается как от ненасыщенных, так и от насыщенных углеводородов? Создайте правильное уравнение реакции. 8.Напишите уравнение реакции горения этилбензола и ксилола. 9.Каковы области применения бензола и других ароматических углеводородов?
10.Напишите формулу реакции, которая позволяет выполнять следующие преобразования: а) CH4 CjH2 QHe QH5C1 b)CaC03 CaQ QH2-C2H4 C2H5C1 ^ЦИКЛОБУТАН 3 8 ^ CeHe — ^ QHsNOj 11.In в соответствии со схемой 48, используйте материал по генетической связи для создания соответствующих уравнений химической реакции. 12.Мейк Резюме реакций, характеризующих бензол и толуол(I, стр. 43).
1.В нормальных условиях, сколько литров воздуха необходимо для сжигания 0,88 литров бензола с плотностью 3 г / СМ1. 2. Из 13,44 л ацетилена было получено 12 г бензола(N. a. it это не так. Насколько этот процент сопоставим с теоретической доходностью? 3. Сжигание 10,6 г о-ксилола. Полученный монооксид углерода (IV) пропускали через раствор, содержащий 0,1 массовой доли или 10% гидроксида натрия 80 г.
Какие вещества и количества образовывались? Предельные углеводороды (декан) СЛН2я + 2 ненасыщенные углеводороды Множественный этиленовый углеводород (алкилы) SlH2p Диеновый углеводород (алкадиены) CflHio-2 CH4 метан 0> HB Этан c3n8 пропан-бутан C * H / 2 характерна реакция замещения пентана. Перманганата калия и бромную воду раствор обесцвечивается не CHJ успешно =СН2 этилен(воздушная система)
СН2=СН-СН3 пропилен(пропан) 12 3 4CH2inCH-СН2— ЧС и-бутен 12 3 4СН3—СН-СН—СН82 Бутен Дж 2 3СН2> =С—СНЗ2-метил пропена характерны реакции марганцевой кислоты соли раствор 12 3 1СН2-СН-СН=СН21, 3-бутадиен(дивинил) 1 2Л4СН2= С—СНСН22-метил-1,3-бутадиен(изопрен)Си,-С— СН = СН2 2-хлор-1,3-бутадиен(хлоропрен)соединения, окисление, и•калия и бромной воды Добавляли 4,39 г бензола в присутствии хлорида железа (III) 1моль брома. Какие вещества и что из них получилось после реакции?
Смотрите также:
| Каучуки | Природный газ |
| Ацетилен и его гомологи | Попутные нефтяные газы |
Если вам потребуется помощь по химии вы всегда можете написать мне в whatsapp.
