Оглавление:







Ацетилен и его гомологи
- Ацетилен и его гомологи По международной номенклатуре углеводороды ацетиленовой системы называются алкинами. Строение молекулы. Анализ ацетилена показывает, что ацетилен содержит приблизительно 0,923 массовых долей (92,3%) углерода и 0,077 массовых долей (7,7%) водорода. Самая простая формула-это: Самая простая формула для ацетилена CH соответствует молярной массе 13 г / моль.
- Из плотности ацетилена в водороде 13 мы можем найти молярную массу ацетилена: M = 2 DH; MD = 2. 13 = 26 основываясь на теории Бутлерова, можно установить структуру молекулы ацетилена. Н-С = С-Н Кроме ацетилена известно много других углеродных соединений, в том числе водород, молекулы которого имеют тройную связь. Общая формула для таких соединений — C / .H2P-2, то есть то же, что и для Диеновых углеводородов.
Итак, молекулярная формула ацетилена — C2H2. А. М. Людмила Фирмаль
Это означает, что изомерия может существовать не только в пределах 1 класса соединений, но и между соединениями разных классов. Например, 1,3-бутадиен СН2=СН—СН=СН2 и ацетиленовый углеводород СН3—С=С—СН3 органических соединений различных классов представителей, однако молекулярная формула одинакова для изомеров в-С4Н6. I общая формула углеводороды Сиангл-2 относятся к ряду ацетиленов с 1 тройной связью в молекуле.
На основе структурной и электронной формулы ацетилена H: C: C: H все связи в его молекуле являются То же самое. Но это не так.2 связи между атомами углерода в химической реакции разрываются гораздо легче, чем 3-я связь. Это явление можно объяснить на основе современных представлений о формах электронных облаков, их гибридизации и взаимном наложении. При образовании молекулы ацетилена каждый атом углерода гибридизуется в 1 s и p электронные облака Рисунок 141.
Структура молекулы ацетил. 142.Получить ацетилен из Мелии. Тана. в результате каждый атом углерода приобретает 2 гибридных электронных облака, а 2 р-электронных облака не гибридизуются. 2 гибридных электронных облака (по 1 от каждого атома) перекрывают друг друга, образуя o-связь между атомами углерода, гораздо более сильную, чем другие 2 связи (рис.141).
Оставшиеся 2 гибридных электронных облака перекрываются с S-электронными водородными облаками, и между ними и атомами углерода также образуются o-связи(рис.141). 4 (от каждого атома углерода 2) негибридизированные F ^ — электронные облака располагаются перпендикулярно и перпендикулярно друг другу в направлении o bond. In эти плоскости, Р-электронные облака перекрывают друг друга, образуя 2 самосвязи.
Они относительно хрупкие и легко ломаются при химических реакциях. Номенклатура. Как и этиленовые углеводороды, уравнение для ацетиленовых углеводородов может быть выведено из уравнения для насыщенных углеводородов. Их названия формируются путем замены суффикса-an на-in(таблица 80). Таблица 80.Простейшие гомологи ацетилена Молекулярная структура имя температура
Форма > la формула кипения (°C) QH2 H-CssC-H ацетилен-83,8 Н(ethin) QH4 H-C-C = C-n 1 пропин-23,3 н С » НВ cn3 для-ву2-с = CN 1-Butium + 8.5 С4Н, sn8-с= = s-sleep 2-Butin + 27.0 Вопрос 1-4 (стр. 181).Решите задачу 1 (стр. 181). Мы получили ваш feedback. In в лаборатории и промышленности ацетилен получают взаимодействием карбида кальция с водой. В. Х. Ка ^ Привет-я — 2H0H ИИИ + Са (он) 2 ^ С С С-Н
Однако производство карбида кальция сопровождается высокими энергетическими затратами. Был также способ получения ацетилена из природного газа разработана(рис. 142).Метан (основной компонент природного газа) разлагается при высоких температурах до углерода и водорода. СН4ЛС+2Н2 В этом процессе ацетилен является одним из промежуточных продуктов, но он быстро разлагается на углерод и водород. 2CH4-я-С2Н2+ЗН2С2Н24*2С+Н2
Когда полученный ацетилен быстро удаляется из горячей зоны и охлаждается, он защищен от decomposition. In в промышленности это осуществляется с помощью различных устройств. Ответьте на вопрос 5 (стр. 181).Решите задачи 2 и 3(стр. 18-1182). Физические характеристики. Ацетилен-это газ легче воздуха, слабо растворимый в воде и почти не имеющий запаха в чистом виде.
Изменения физических свойств углеводородов на основе ацетилена(а также алканов и углеводородов этиленовых систем) следуют общему закону: с увеличением относительной молекулярной массы температура кипения вещества возрастает (табл.80). Химическое свойство. Ацетилен и его гомологи характеризуются реакциями присоединения, окисления и полимеризации (аналогичными многим этиленовым углеводородам).
1.Дополнительные реакции. 1) многие ацетиленовые углеводороды вступают в реакцию с галогенами. Например, ацетилен обесцвечивает бромную воду. Добавление брома осуществляется в 2 этапа. НС =СН+Вг2СНВг=СНВг 1,2-Гибралтар STARTg = STARTg + Бк2 с start2-с start2 1.2, 2-цраброметам 2) при высоких температурах(в присутствии катализатора) ацетилен связывается с водородом.
Гидрирование ацетилена(например, бромирование) также проводят в 2 этапа. NS-CH + H2 — * H2C = CH Катализатор Хок = чо + Хо — > — Чо — Чо * * * Катализатор А Л Этан. 3) ацетилен также вступает в реакцию со сложными веществами. Например, в присутствии сульфата ртути (II) ацетилен связывается с водой(гидратом) и образуется ацетальдегид (yk -: альдегид): H-C ^ C ^ C-H + HOH — ^ CH3-Cf°(реакция Кучерова) XN Ацетальдегид
Когда хлористый водород присоединяется к ацетилену, он образует газообразное вещество, винилхлорид или хлорвинил: CH-CH-f HC1 + CH2 = CHC1 Винилхлорид Этилен 2.Реакция окисления. 1) ацетилен обесцвечивает раствор калия permanganate. As в результате ацетилен (как и этилен) легко окисляется. 2)в воздухе ацетилен горит с пламенем дыма. Если при сгорании ацетилена воздух дополнительно вдувается в пламя, то он будет гореть полностью без сажи. 2Х2Х2+ 50240202-4-2Х20
- Смесь ацетилена и воздуха или кислорода является взрывоопасной. Ацетилен также может взорваться во время горения, поэтому он хранится и транспортируется в цилиндры в виде раствора ацетона, пропитанного пористым материалом. 3.Реакция полимеризации. Винилхлорид может быть полимеризован: СН2 = СН + СН2 = СН +(-СН2 — СН-) Ди Ди: я <!:! 1JU.1ivninl хлорид
Из поливинилхлорида получают химически и механически прочные пластики с хорошими диэлектрическими свойствами. При нагревании выделяется и разлагается хлористый водород. Ацетилен полимеризуется и превращается в бензол(стр. 186). Приложение. Ацетилен широко используется в органическом синтезе(рис. 143).
Это 1 из исходного сырья в производстве синтетического каучука, поливинилхлорида и других полимеров. Людмила Фирмаль
Ацетат, растворитель (1,1,2,2-тетрахлорэтан и 1,2-трихлорэтан) получают из ацетилена. Когда ацетилен горит с кислородом, температура пламени достигает 3150°C, поэтому он используется для сварки и резки металлов. Рисунок 143.Применение ацетилена и его соединений: /-Для резки и сварки металлов. 2-наличие искусственных волокон. 8-красители; • / — лак; 5-одеколон с духами, фруктовая эссенция;
6-лекарственные средства:7-хлоропреновый каучук; 8-поливинилхлорид. Выполните упражнения 9-11. О как была определена молекулярно-структурная формула ацетилена по экспериментальным данным? 2. Нарисуйте электронную Формулу 1-Бутина и 2-Бутина. 3.Основываясь на современной концепции электронного облака и его перекрытия, мы объясняем, как образуются химические связи в молекулах ацетилена, и сравниваем их с химическими связями молекул этилена.
4.К каким веществам относятся многие ацетиленовые углеводороды? Указаны следующие молекулярные формулы углеводородов: C2H2, C3H4, C4H6.Напишите их структурные формулы и названия. 5.Как получить ацетилен в лаборатории или на производстве? Напишите уравнение соответствующей реакции. 6.Какие закономерности можно наблюдать при изменении физических свойств ацетиленовых углеводородов в большом количестве?
7.Каковы различия в химических свойствах многих ацетиленовых углеводородов: а) от насыщенных углеводородов. Б)от большого количества этиленовых углеводородов? Объясните ответ в уравнении реакции. 8.Где используется ацетилен? Напишите соответствующую формулу реакции.
9.Опишите уравнение реакции, которое может выполнять следующие преобразования: а)ЧС-СН3-» — ч ж-CH2C1 СН2-с Н2-» * CH2C1 — CH2C1 ч = ч б)CaC08- # -Сас2-СН=СН-СН2-СН—С=СН-«-СН2=С—СН=СН2 А! с)Ч <-»-ч = CHCH2 = CHCH1(-СН2-СН-) 10.Согласно схеме 47, приведите соответствующее уравнение химической реакции. 11.Напишите резюме ответов, характеризующих ацетилен, пропин(I, стр. 43). F 1.Углеводороды содержат 0,8889 массовой доли, то есть 88,89% углерода.
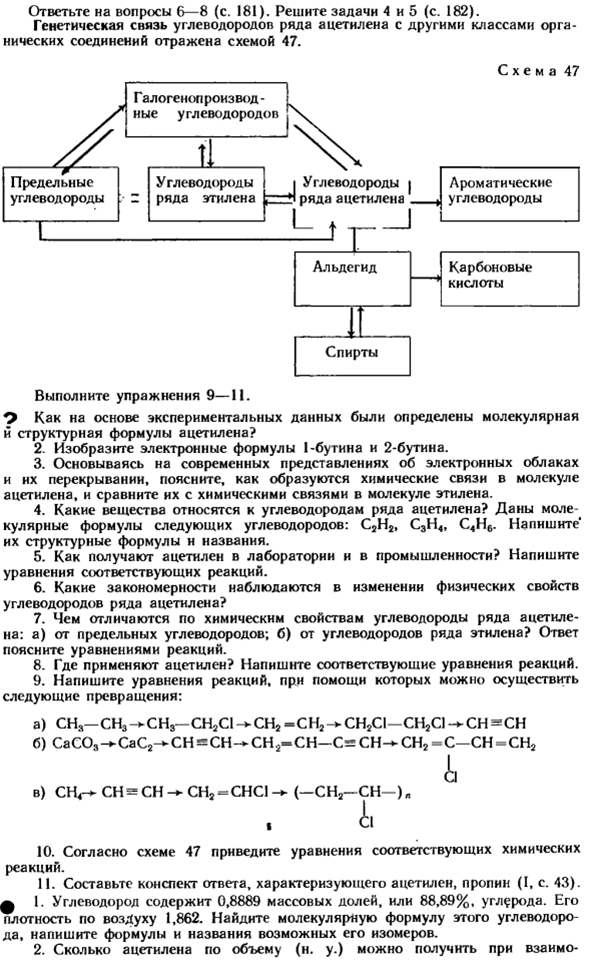
Его плотность воздуха составляет 1,862.Найдите молекулярную формулу этого углеводорода и напишите формулу и название его возможного изомера. 2.Объем ацетилена (т. е.) Ответьте на вопрос b-8 (стр. 181).Решите задачи 4 и 5(стр. 182).Генетическая связь между ацетиленовыми углеводородами и другими типами органических соединений показана на схеме 47.
Образец 47 Если выход ацетилена составляет 0,84 массовой доли, или 84%, по сравнению с теоретическим значением, то 51,2 кг карбида кальция и воды 3.Сколько ацетилена и водорода по объему (N.) Я могу получить из природного газа с объемной долей 0,96 или 96% (объем) метана с 1042 м3? 4. Какое количество воздуха необходимо для сжигания 1 м3 1-Бутина?
5. Чтобы получить 44,25 кг хлоролена, объем ацетилена(т. е. сколько времени это займет)? Лабораторные опыты Наличие ацетилена и эксперименты с ним. 1. В пробирку наливают 1-2 мл воды и помещают в нее 2-3 кусочка карбида кальция CaQ. Закройте трубу газовой пробкой. 2.Опустите конец вентиляционной трубы и поместите его в другую пробирку, содержащую бромистую воду, пропуская газ.
3.Конец вентиляционной трубки опускают в пробирку с раствором перманганата калия, подкисленного серной кислотой. 4.Используйте припой или стеклянную трубку, чтобы вдуть воздух в газовое пламя. Задача. Какие газы выделяются при взаимодействии карбида кальция с водой? Что делать, если этот газ проходит через раствор брома воды или перманганата калия? Каким пламенем горит газ? Почему он загорается, когда воздух вдувается в пламя? Напишите уравнение соответствующей реакции.
Смотрите также:
| Диеновые углеводороды (алкадиены) | Ароматические углеводороды (арены) |
| Каучуки | Природный газ |
Если вам потребуется помощь по химии вы всегда можете написать мне в whatsapp.
