Оглавление:





Атомно-кристаллическая структура металлов
- Атомно-кристаллическая структура металла RA Атомно-кристаллические структуры понимаются как взаимное расположение атомов, присутствующих в кристалле. Кристаллы состоят из атомов (ионов), расположенных в определенном порядке, которые периодически повторяются в трех измерениях. Для описания кристаллической структуры I-атома используется понятие пространства или кристаллической решетки.
Кристаллическая решетка представляет собой фиктивную пространственную сеть, в которой атомы (ионы), образующие металлы (твердые кристаллические тела), расположены на nodes. An пример такой кристаллической решетки показан на рисунке 1. 4.Самый маленький параллелепипед отмечен толстой линией, и, непрерывно перемещаясь в пространстве по 3 осям, можно построить решетку или целый Кристалл. Наименьший объем кристалла называется монокристаллической ячейкой, .
дающей представление об атомном строении металла по всему объему Людмила Фирмаль
Пространственная сетка делится на 7 систем (синонимов), основанных на соотношении осевых единиц и углов. Представляют краям ячейки(параллелепипеда) по углам между A, B, с, кра в, р, г(Рис. 4).Затем 7 кристаллографических систем соответствуют следующим форматам ячеек: 1) триклинные: a ^ b c и a ^ p ^ = a y # 90 «; 2) моноклинные: A f c и a = y = 90°; 3) ромб: A h / s; A = p = y = 90»; 4) ромб: a = B ^ s; a = P = 90°; y = 120°; 5) ромб: a = D = c; A = P = 90° C ; a = 90° F; A = F; A) F; A) ромб; a) ромб; y = 90°; 7) кубический: d = b = s; a = p = y = 90°. Кристаллическая решетка, в которой 1 атом занимает 1 атом, называется простой.
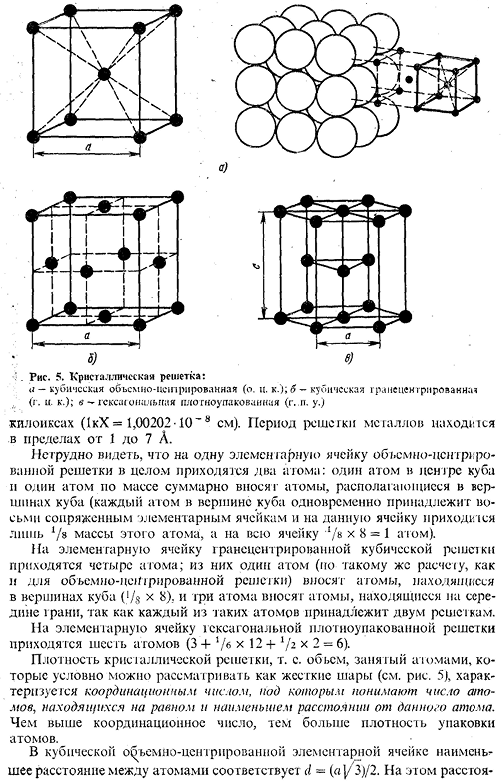
Решетка, в которой одна элементарная ячейка содержит несколько атомов, называется комплексом. Металл образует одну из следующих высокосимметричных сложных решеток с плотной массой атомов: центр объема куба, центр грани куба, шестиугольник. В кубической Центральной решетке атомы (рис.5а)расположены в узлах ячейки, а 1 атом расположен в центре куба. (1, Ta, W, V, Fea, Cr, Nb, Ba и др.) (см. таблицу 1).
- В гранецентрированной решетке Куба атомы находятся в углах Куба и в середине каждой грани(рис.5, б). Металлы как Ca7, Ce, Sr Th, Pb, Sc, Ni, Ag, Au, Pd, Pt, Rh, Ir, Fe, Cu, Coa имеют этот тип решетки (см. таблицу 1). В гексагональной решетке(Рис.5) атомы расположены по углам и центрам дна шестиугольника призмы, а в центральной плоскости призмы расположены 3 атома. Упаковка этого атома включает в себя такие металлы, как Hf7, Mg, Tia, Cd, Re, Os, Ru, Zn, Cop, Be, Ca» La», Tl7, Zr7 и др. Наконец, некоторые металлы (Snp, In) Таблица 1). Размер кристаллической решетки характеризуется величиной периода. Это означает расстояние между ближайшими параллельными атомными плоскостями, образующими элементарные ячейки (см. Рис.5).
Цикл сетки измеряется в ангстремах (1A = 10-8 см), или 1 рентгеноструктурный анализ используется для изучения атомного кристалла structures. It основан на рентгеновской дифракции на очень коротких длинах волн (0,2-2,0 а) столбцами атомов в кристаллическом теле. также электроны и нейтроны, которые также дают дифракционный спектр при взаимодействии с ионами (атомами) Кристалла. 2 а, (J, y) означает, что соответствующие металлы имеют различные кристаллические структуры при различных температурах. 14 Рисунок 5
В последнее время для этой цели помимо рентгеновских лучей используются Людмила Фирмаль
.Кристаллическая решетка: а-кубический объем (около С. К. ’); б-грань кубического сердца (С.〜). c — самый плотный шестиугольник(g. p. s.) Kilox (1kX = 1.00202-10〜8 см).Ассортимент металлической сетки цикл 1-7а. 1 единичная ячейка всей объемно-центрированной решетки имеет 2 атома:1 атом в центре куба и 1 полный атом в верхней части куба (каждый атом в верхней части куба принадлежит 8 сопряженным единичным ячейкам, при этом эта ячейка занимает только массу этого атома / 8, а весь атом в верхней части куба). Существует 4 атома на единицу решетки гранецентрированной кубической решетки. Из них 1 атом (согласно тому же расчету, что и расчет решетки тело-разум) вносится атомом, расположенным в верхней части куба (/s x 8), а 3 атома вносятся атомом, расположенным в центре плоскости.
Он принадлежит к 2 сеткам. Существует 6 атомов на единицу решетки (3 + J / 6×12 + 5 / g x 2 = 6) в гексагональной плотно упакованной решетке. Плотность кристаллической решетки, т. к. Объем, занимаемый объемом, который условно можно считать твердым шаром (см. Рис. 5), характеризуется числом координат. Координационное число понимается как число атомов, находящихся на равном минимальном расстоянии от указанного атома. Чем выше номер регулировки、Более высокая атомная плотность упаковки. В кубической решетке единиц тело-разум минимальное расстояние между атомами соответствует d =(a] / s)/ 2.At это расстояние 15 Рисунок 6: схема, показывающая количество атомов на одинаковом минимальном расстоянии от заданного атома для разных решеток: а-гранецентрированная кубическая. б-объемный центр Куба; в — наиболее плотный гексагональный\
У этого атома(а) есть 8 соседей (рис.6.6). таким образом, число конфигураций этой решетки соответствует 8 и обозначается K8.Коэффициент заполнения ячейки равен 68%, что определяется как отношение объема атома к объему ячейки. Для гранецентрированной решетки координационное число равно 12 (K 12).Каждый атом имеет 12 ближайших соседей на расстоянии d =(a] / 2)/ 2 (Рис. 6, а). это соответствует наибольшей плотности упаковки или упаковки атомов в виде шариков. C / a = 1.633, гексагональное координационное число ближайшей к ближайшей решетке равно 12 (G12), что соответствует наибольшей плотности упаковки шара(рис.6).
Для многих металлов, которые кристаллизуются в гексагональной системе, отношение c / a находится в диапазоне 1,57-64.То есть наблюдаются отклонения от наиболее плотной упаковки(c / a = 1,633). если отношение c / a сильно отличается от 1,633 (например, цинк и кадмий), то гексагональная решетка соответствует 6. Гранецентрированные кубические и гексагональные крупным планом (c / a = 1,633) решетки являются наиболее компактными, с коэффициентом заполнения объема атомами 74%. Если количество регулировок в решетке G12 уменьшить до 6, то коэффициент заполнения составит около 50%, а если количество регулировок равно 4, то он составит около 25%.
Элементы в периодической системе границы между неметаллическим и металлическим (иногда их называют неметаллическими) имеют более сложную кристаллическую решетку с малым координационным числом, аналогичную неметаллической. Координационное число кристаллической структуры полуметаллических и неметаллических элементов групп VII,. VI, V и частично IV (подгруппа B) можно определить по следующему правилу: 8-N, где N-число групп периодических систем, в которых существует этот элемент. с номером 3. Половина минимального расстояния между центрами атомов называется атомным радиусом. Атомный радиус увеличивается с уменьшением координационного числа. Это позволяет нам、 162. д.)
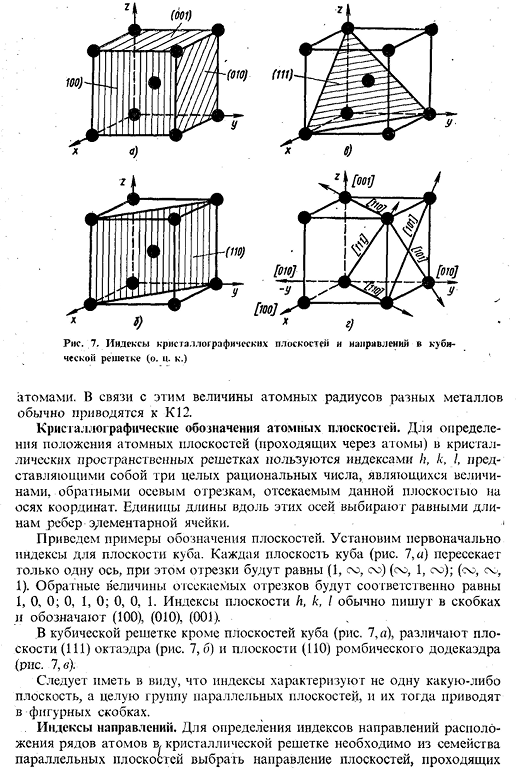
7, направление индекса стороны кристалла и кубической решетки(о к〜) Atoms. In в связи с этим атомный радиус различных металлов обычно сводится к K-12. Крис Галло графическое обозначение atomic airplane. To определите расположение атомных плоскостей (проходящих атомов) в кристаллической решетке пространства, используя индексы h, k, I, которые являются 3 рациональными целыми числами, взаимными осям отрезков, вырезанных этой плоскостью на координатных осях. Единицы длины вдоль этих осей выбираются равными длинам концов единичных ячеек. < Приведу пример обозначения самолета. Во-первых, установите индекс кубической плоскости.
Каждая плоскость Куба (рис. 7, а) пересекает только 1 ось, но сегменты равны (1, sy, sy) (sy, 1, sy). (сы, сы, 1).Взаимные значения отрезанных сегментов равны 1, 0 и 0 соответственно. 0、1、0; 0、0、1。индексы плоскостей H, k и I обычно записываются в скобках、(100)、(010)、(001)в следующей таблице перечислены В кубической решетке, помимо кубических плоскостей (рис.7, а), различают восьмигранные (111) плоскости (рис. 7, Б) и ромбовидные 12-плоскостные (110) плоскости (рис. 7, в). Следует отметить, что индекс характеризует не только 1 плоскость, но и всю группу параллельных плоскостей, они обозначаются фигурными скобками. Индекс direction. To определив индекс направления расположения рядов атомов в кристаллической решетке, необходимо выбрать направление плоскости, проходящей из семейства параллельных плоскостей 17 от начала.
Далее определите координаты любой точки в этом направлении, взяв за единицу длину ребра единичной ячейки (период сетки).Значением координат полученных точек будет отношение 3-х наименьших целых чисел к числам. Эти числа, заключенные в квадратные скобки[hkw], являются индексами в указанном направлении и во всех параллельных направлениях. На рисунке показаны основные направления кубической решетки. 7, д. Оси сетки индекс Х — [100], а y — [010] и Z [001]. Индекс пространственной диагонали[111].Для кубической решетки индекс направления (hid) [iww], перпендикулярный плоскости, численно равен этому индексу плоскости, например, индекс оси x равен [100], а индекс плоскости, перпендикулярный оси x, равен*. * Набор из 6 кристаллографических эквивалентных поверхностей Куба обозначается индексом нескольких граней, заключенных в фигурные скобки. Например, индекс{100, или; 001 J.
И так далее. Набор из 8 кристаллографических эквивалентных плоскостей октаэдра Обана не показывает таких, как£111}. Анизотропия свойств metals. It нетрудно заметить, что атомная плотность на разных плоскостях не одинакова. same. So например, плоскость (100) объемно-центрированной кубической решетки содержит только 1 атом (1D x 4), а плоскость (110) ромбоидной плоскости 12 содержит 2 атома. атом: 1 атом вносит свой вклад в атом, который расположен в вершине (1/4×4), а 1 атом расположен в центре cube. In гранецентрированная кубическая решетка, расположение атомов наиболее плотная грань-это восьмигранная грань (111), а в телецентрированной кубической решетке-грань(но). — ’
Многие свойства каждого кристалла (химические, физические, механические) зависят от направления решетки, так как плотность атомов в разных плоскостях и направлениях решетки неодинакова. Подобные различия в свойствах монокристалла в разных кристаллографических направлениях называются анизотропией. Кристаллы представляют собой анизотропные тела, в отличие от аморфных тел (стекло, пластик и др.), свойства которого не зависят от направления. Промышленный металл поликристаллический. То есть он состоит из большого количества анизотропных microcrystals.
In в большинстве случаев, как уже говорилось выше, кристаллиты статистически хаотично ориентированы относительно друг друга, поэтому их характеристики примерно одинаковы во всех направлениях. То есть поликристаллическое тело является изотропным. Если кристаллиты имеют одинаковую предпочтительную ориентацию в нескольких направлениях, то мнимой изотропии такого металла не наблюдается. Это направление, или текстура, создается в некоторой степени, но не полностью в результате значительного холода deformation. In в этом случае поликристаллический металл приобретает характерную анизотропию.
Смотрите также:
Решения задач по материаловедению
| Дефекты кристаллического строения металлов | Металловедение и термическая обработка металлов |
| Диффузия | Общая характеристика металлов |
