Оглавление:




Атомные модели
- Атомная модель. Планетарная модель имела огромное фундаментальное значение как новый важный шаг на пути к положению внутренней структуры атома. Однако сначала это не удалось выяснить, так как не известно ни количество, ни расположение электронов в атомах отдельных элементов. Решение первого вопроса было дано исследованием так называемого рентгеновского излучения.
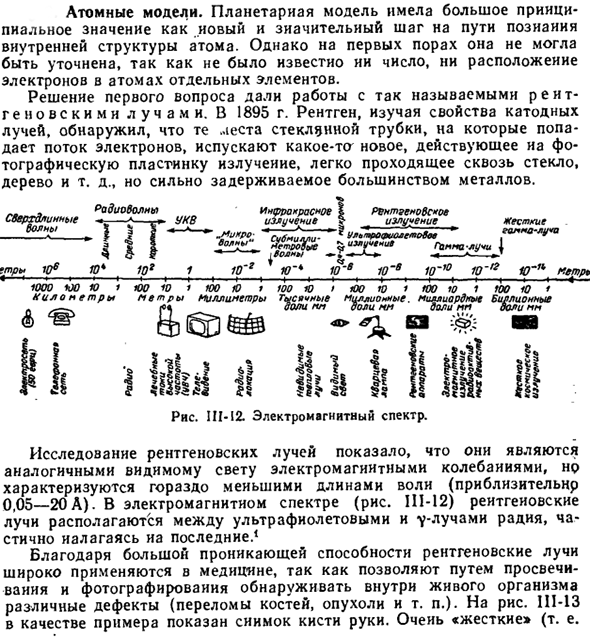
- В 1895 году рентгенолог изучил свойства катодного луча и обнаружил, что расположение стеклянной трубки, на которую воздействует пучок электронов, действует на фотопластинку и высвобождает новое излучение, которое легко проходит через стекло, дерево и т. д. Он прочно удерживается в большинстве металлов. Диаграмма III-12.Электромагнитный спектр. Но характеризуются гораздо более короткой длиной волны(около 0,05-20А).
Рентгеновские исследования показали, что они напоминают электромагнитные волны видимого света. Людмила Фирмаль
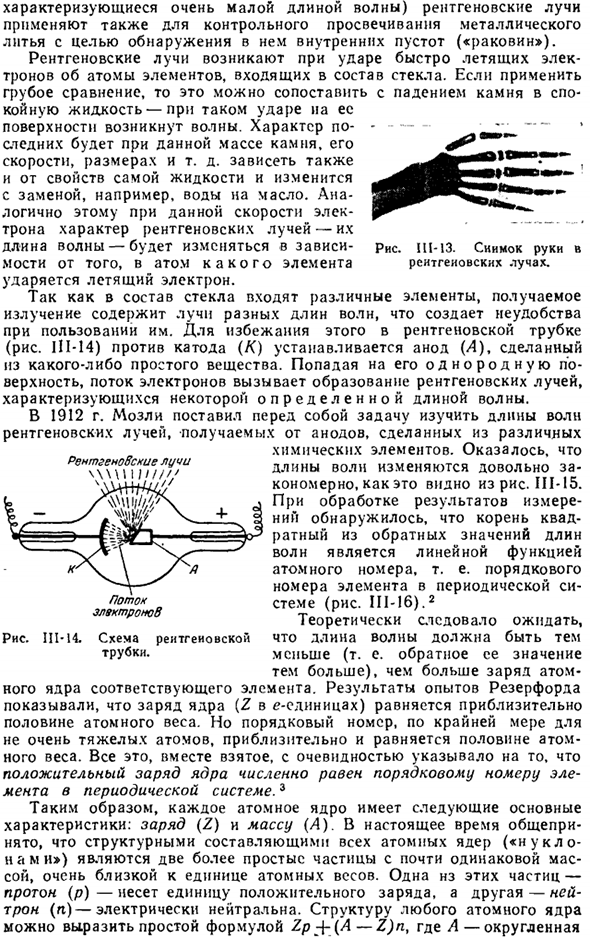
В электромагнитном спектре(рис.111-12) рентгеновские лучи расположены между ультрафиолетовой и 7 *радиевой линиями, частично обертывая Радий. Поскольку рентгеновские лучи обладают высокой проникающей способностью, они широко используются в медицине, так как могут выявлять различные дефекты (переломы, опухоли и др.) in vivo через передачу и фотографию. Рис. 111-13, примером может служить изображение руки.
Очень » суровый «(т. е.、Рентгеновские лучи (которые характеризуются очень короткими длинами волн) также используются для контроля прозрачности металлических отливок для обнаружения внутренних пустот («оболочек»). Рентгеновские лучи возникают, когда быстро летящие электроны сталкиваются с атомами элементов, составляющих стекло.
Применяя грубое сравнение, можно сравнить его с падением камня на нежную жидкость-с таким ударом по ней Возникают поверхностные волны. Природа—- Их следы на массе, скорости и размерах камня и т., также зависят от свойств самой жидкости и изменяются, например, при замене воды маслом. Точно так же при заданной скорости электрона природа рентгеновского излучения-его длина волны—изменяется в зависимости от того, с каким атомом сталкивается летящий электрон.
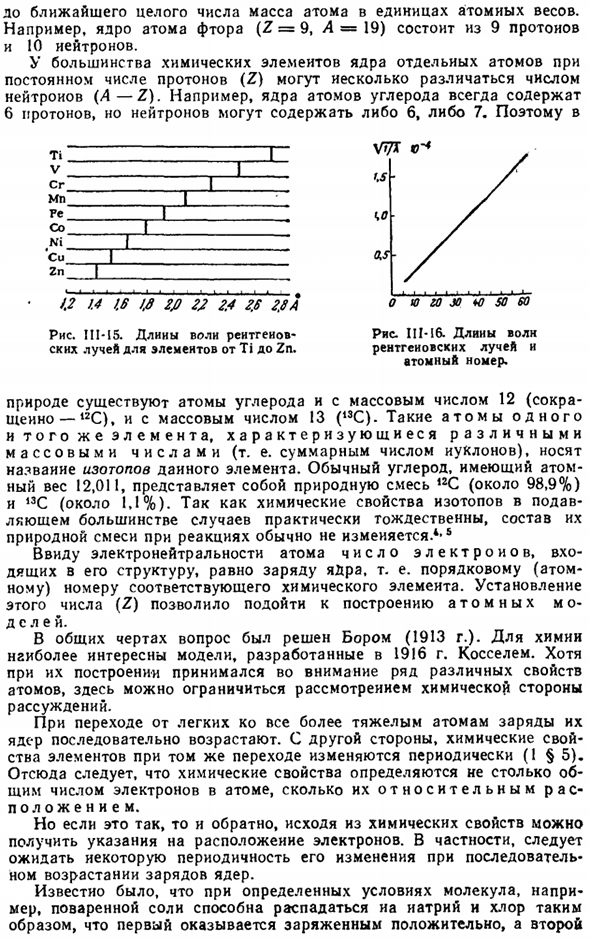
Поскольку стекло содержит множество элементов, полученное излучение включает в себя лучи различной длины волны, что делает его неудобным для использования. use. To во избежание этого в рентгеновской трубке (рис.111-14) к катоду (к) присоединен анод (а), изготовленный из любого простого вещества. Когда он достигает своей однородной поверхности, поток электронов образует рентгеновские лучи, характеризующиеся определенной длиной волны.
В 1912 году Мосли поставил перед собой задачу изучить длины волн рентгеновских лучей, полученных из анодов, изготовленных из различных материалов. Химическое вещество elements. As как видно из рисунка, Мы обнаружили, что длина волны изменяется очень естественно. III-15.
Обработав результаты измерений, мы обнаружили, что квадратный корень обратной длины волны является атомным номером, то есть линейной функцией порядкового номера элемента в периодической системе (рис.111-16).Два Теоретически предполагается, что чем больше заряд атомного ядра соответствующего элемента, тем короче длина волны (то есть тем больше обратная ее величина).
Результаты экспериментов Резерфорда показали, что ядерный заряд (Z в единицах e) составляет примерно половину атомного веса. Но для атома, который не очень тяжелый, по крайней мере, серийный номер будет примерно равен половине атомного веса. Рассматривая все это вместе, было ясно показано, что положительный заряд ядра численно равен порядковому числу элементов периодической системы.
Итак, в каждом атомном ядре существуют основные свойства: заряд (Z) и масса (L).В настоящее время общепринято, что структурными компонентами всех атомных ядер («нуклонов») являются 2 простые частицы с примерно одинаковой массой, очень близкой к единице атомной массы. Протоны (Р), составляющие 1 из этих частиц, несут единицу положительного заряда, а еще 1 нейтрон (Р) электрически нейтрален.
Структура любого атомного ядра может быть представлена простой формулой Zp ^^ A-Z) N. где A округляется Рисунок Ил-13. Рука снимок с рентгеном. Рентгеновский \\ 11 \ ч. /// Диаграмма III-14. Поток зл&электропередачи Иллюстрация рентгеновской трубки. Ближайшее целое число-это масса атома в единицах его атомного веса. Например, ядро атома фтора (Z = 9,A = 19) состоит из 9 протонов и 10 эфиров.
В большинстве химических элементов ядра отдельных атомов с постоянным числом протонов (Z) могут несколько отличаться по числу нейтронов (A-Z).Например, атомное ядро атома углерода всегда содержит 6 протонов, в то время как нейтроны содержат b или 7. Ти. V, Cg’MPS » Re » Co Ni_ Си_ Цинк [ 1.2 14 16 tf 2jD 2J 2.4 2.6 2.8 A Рисунок III-I5. Рентгеновские длины волн элементов от Ti до Zn.
В природе существуют атомы углерода с массовым числом 12 (сокращенно 2С) и массовым числом 13 (13С).Такие атомы одного и того же элемента, характеризующиеся разным массовым числом(то есть общим числом нуклонов), называются изотопами этого элемента. Нормальный углерод с атомным весом 12,011 представляет собой природную смесь 12С (около 98,9%) и 13С (около 1,1%).
В большинстве случаев химические свойства изотопов примерно одинаковы, поэтому обычно состав природной смеси не изменяется в ходе реакции. Благодаря электрической нейтральности атома, число электронов, входящих в его структуру, равно заряду ядра, то есть порядковому (атомному) номеру соответствующего химического элемента.
С установлением этого числа (Z)можно было приблизиться к построению атомных моделей. В целом эта задача была решена Бором (1913 г.). Что касается химии, то наиболее интересна модель, разработанная Косселем в 1916.In их состав, различные свойства атома были приняты во внимание, но здесь мы можем ограничиться рассмотрением химической стороны вывода.
При переходе от более легкого атома к более тяжелому атому заряд Р ядра последовательно возрастает. С другой стороны, химические свойства элементов периодически меняются в течение одного и того же перехода (1§ 5).в результате химические свойства определяются не общим числом электронов в атоме, а их относительным расположением.
Но если это так, то на основе химии, и наоборот, можно получить признаки расположения electrons. In в частности, следует ожидать определенной периодичности изменений при непрерывном увеличении ядерного заряда. При определенных условиях, например, молекула хлорида натрия, первая молекула положительно заряжена, а вторая молекула О, пошли.*О, да. Рисунок Части.
- Рентгеновские лучи указывают длину и атомный номер. Отрицательный. Изучение этих частиц показывает, что заряд каждой из них численно равен заряду электрона. Происхождение обоих зарядов наиболее естественно объясняется переходом 1 электрона от атома натрия к атому хлора. Но в хлориде натрия и натрий, и хлор являются одновалентными.
Это означает, что 1 единица валентности соответствует 1 переносящему электрону. А в случае двухвалентного кальция, например, переход 2 электронов является expected. Аналогично, в других случаях валентность элемента совпадает с числом передающего электрода.
In опыт показывает, что полученные частицы кальция имеют 2 положительных заряда. Людмила Фирмаль
Наиболее вероятным переносом-валентностью-являются только электроны, наиболее удаленные от положительно заряженного ядра. Наконец, большую роль сыграли соображения о свойствах инертных газов. Тот факт, что с элементами этой группы начались химические реакции, свидетельствует об особой стабильности электронной структуры атома. Построение простейших моделей атомов водорода не составляет труда.
Электроны вращаются вокруг протонов в этом атоме. Следующий элемент-гелий-уже способен к 2 различным моделям (рис. II1-17): его 2 электрона могут вращаться на разных расстояниях от ядра (/4) или на одном и том же (£).Поместите их на 1 круг. Их выбор может быть основан на химических свойствах гелия.
Если модель а верна, то внешние электроны будут сильнее привязаны к гелию, чем к водороду. Согласно этому, гелий durget похож на водород по характеристикам. С другой стороны, он химически инертен. Это останавливается в модели B, потому что она предполагает, что оба электрона находятся в одном и том же состоянии и что оба очень сильно связаны с ядром. А Б В Г Д Диаграмма III-18.Возможные модели атомов лития. Следующий элемент-литий-уже имеет 3 electrons. As показанный на рисунке 4, он показан 4 различными моделями. III-18.
Литий имеет химическое свойство подобное и-трию и металл 1 валентности В всех смесях. По-видимому, модель G оптимальна для этого, и принципиально важно, чтобы в ней сохранялось устойчивое расположение гелия 1 из 2 электронов во втором слое, близком к ядру. Бериллий, который является элементом с атомным номером 4, всегда является двухвалентным. Это показывает, что только 2 электрона являются валентными электронами, оба из которых находятся в одном и том же состоянии.
Очевидно, что стабильный гелий 2 также хранится в бериллии, а остальные 2 электрона находятся в следующем слое. Элемент N°5-бор-трехвалентный. Таким образом, его модель построена аналогично бериллиевой модели, но есть только одно отличие, что от ядра до 2-го слоя уже есть 3 электрона. Элемент № 6 -* -’ Рисунок II1-17.Возможные модели атомов гелия. Углерод имеет 4-валентность, расположение его электронов выглядит так: 2, 2, 4 в первом слое.
Общая тенденция в развитии атомных структур уже есть clear. It постепенно заполняется электронами в следующем слое, сохраняя при этом гелий 2 в первом слое. Это заполнение 2-го слоя явно продолжается до тех пор, пока не достигнет числа электронов, соответствующего его максимальной стабильности. Однако необходимо приобрести атом инертного газа.
Если мы рассмотрим элементы, которые следуют за углеродом в системе, мы можем видеть, что азот (2 и 5), кислород (2 и 6) и фтор (2 и 7) являются химически active. It получается, что только элементы № 10-неон-структуры 2 и 8 являются аналогами гелия, который является инертным газом. Из этого можно сделать вывод, что 2-й электрон-ft слой стабилизируется с помощью 8 электронов. Если мы продолжим обсуждение, то увидим, что элемент 11 (натрий) является одновалентным, магний-двухвалентным и т. д.2-й электронный слой уже заполнен неоном, поэтому валентные электроны этих элементов расположены в 3-м layer.
An электронная модель элементов от неояса до аргона показана на рисунке. 111-19. Al SI P s C1 рис III-19.Электронная модель атома. Поскольку трудно выразить структуру соединений с помощью атомарных моделей (с чисто графической точки зрения), обычно используются упрощенные методы их выражения.
Здесь указывается только количество электронов во внешнем слое. М•м * м и М и Н: Нэ * На Мг Al Си П » * » С1:: Али Свободная электронная пара может быть обозначена тире. Например. Формы атомов серы и хлора в этом изображении: и » SC. Само собой разумеется, что вышеупомянутая атомная модель отражает свою структуру лишь очень схематично. Но фундаментальное значение понимания химических свойств и процессов имеет начальный этап познания атомных структур-распределение электронов по слоям.
Добавь 1) излучение, соответствующее отдельным областям электромагнитного спектра, по-разному поглощается атмосферой АЭС (рис. II1-20).Наличие нерки имеет большое значение для радиоволн сантиметров и метров. Во-первых, вы можете получить отражение радиоволн, передаваемых с Земли от различных небесных тел. Такой путь может, например, определить расстояние до Луны (в среднем 384 000 км) с ранее недоступными accuracy.
At в то же время, перед радиоастрономом открывается возможность регистрации собственных радиоизлучений, поступающих из разных частей Вселенной. 2) наиболее достоверные результаты получены при использовании жестких рентгеновских лучей. Уравнения Мосли, примененные к ним, имеют вид J / ^ a (Z-1).Где X-длина волны, а Z-порядковый номер элементов периодической системы、 а-это константа.
Постоянство этой константы при переходе от одного элемента к другому свидетельствует о правильности найденного соотношения. 3) приведенные в тексте выводы, раскрывающие физический смысл серийного номера, были очень простыми, поэтому казалось крайне желательным получить прямое экспериментальное подтверждение серийного номера. ..Оптический^ _ Молекула^и сига-Молехдтрн ^область.
Окно «отражения-около устья естественного поглощения 1» Орла радиоволн из ионосферы Полупрозрачный Прозрачность._ Поддержка Q> oooi O. ooj 0.01 a / _ _ __ Микрон-сантиметр С этой целью было тщательно изучено рассеяние частиц тонкими листами меди, серебра и платины на основе усовершенствованной технологии(Chadwick, 1920).
По результатам отдельных экспериментов были получены следующие положительные значения заряда ядра (единицы заряда электрона):: Си-27л; 29.0; 29.6; 27.6; 29.6; 29.6; 30.0; 28.2; 30.4; 29.6-средняя 29Л АГ-46.0; 41.0; 44.0; 45.9; 46.5; 49.1-средняя 46.3 Пт-60.6; 79.4; 79.6; 76.0; 71.1; 78.5; 77.0; 76.5; 75.3; 76.5; 76.2-средняя 77.4 Серийные номера исследуемых элементов — каждый 29. Поскольку она равна 47 и 78, то результаты прямых решений, несомненно, подтвердят правильность вывода задачи.
4) в качестве примера ниже приведены данные по изотопному составу инертных GAE. Массовое число отдельных стабильных изотопов и их процентное содержание в природных смесях (в скобках). / ВНУТРИВЕННЫЙ Гелий (Z-2): l-3 (s-4), 4 (00 100) Неон (Z-I0): А-20(90.92). 21(0.26). 22 (8.82) аргон (Z-18): D-36(0.34)、38(0.06)。 40(99,60) Криптон (Z-36): I-78(0.35). 80 (2.27). 82(11.56). 83 (11.55). 84(56.90). 86(17.37) Зенойя (Z-54): I-124 (0.09). 126 (0,09). 128 (1.92). 129(26.44). 130 (4.06). 131(21.18))* 132(26.89). 134(10.44). 136(8.87))
5) Лада(Z = 86) не стабильна, то есть радиоактивный распад не испытывает изотоп. Его атом является наиболее стабильным с массовым числом 222, а его средняя продолжительность жизни составляет 5,5 дней. Существует относительно мало природных радиоактивных изотопов подобных радиоизотопам 222, но они могут быть искусственно получены со всеми элементами.
Примерами являются атомы IS и 14C, средняя продолжительность жизни которых составляет 30 минут и 8,5 миллионов лет соответственно. Такие радиоизотопы («радиоизотопы») широко используются в различных научных исследованиях и методиках. Ряса. II1-20.Различная Воля и взаимодействие с атмосферой.
Смотрите также:
| Реальность атомов и молекул | Теория водородного атома |
| Сложность структуры атома | Валентная связь |
