Оглавление:







Валентная связь
- Валентная связь. Вопрос о природе сил, обусловленных образованием химических соединений, возник в начале 19 века. Но этого оказалось недостаточно. Благодаря развитию знаний о строении атомов мы немного приблизились к выяснению природы химических взаимодействий и первопричины их возникновения.
- Конечно, в этом случае надо иметь в виду, что»человеческое понятие причины и следствия всегда несколько упрощает объективную связь явлений природы»(Ленин). Как известно, ток, протекающий по замкнутому контуру (минус от ранее рассмотренного плюса), генерирует магнитное поле, которое индуцируется по»закону Буравчика» (рис.31). Диаграмма III-31.Правила Буравчика.
Электроны, вращающиеся по орбите, ведут себя аналогично (но в противоположном направлении от магнитного поля). Людмила Фирмаль
Так называемый электронный спин естественной оси. Поскольку электрон не является математической точкой, А имеет несколько (хотя и незначительных) измерений, его собственное вращение опять же связано с появлением магнитного поля. field. So, каждый электрон орбитали, которые присутствуют в атоме, являются, так сказать, очень маленькими магнитами.
Но 2 отдельных Магнита притягиваются к противоположным полюсам, и их магнитные поля закрыты для каждого other. To отрежьте их снова, вам нужно провести некоторую работу. Таким образом, в результате замкнутого магнитного поля система становится более устойчивой. То же самое относится и к случаю электронных орбиталей. Для гелия, например, мы получаем схему взаимодействия магнитного поля, показанную на рисунке 2. III-32.
In более сложные атомы, большинство электронных орбиталей должны быть закрыты парами таким же образом. Исходя из особой устойчивости атомной структуры инертного газа, необходимо учитывать, что все его орбиты прочно спарены. Если мы полностью приблизим 2 атома с неспаренными («простаивающими») электронами в структуре, то между последними начнет действовать взаимное притяжение. fields.
As в результате оба атома сближаются, и электрическое поле замыкается, образуя электронную пару. По мнению Льюиса, в этом и заключается суть возникновения валентных связей между атомами. Конструкция валентной связи электронных пар составляет 1 электрон от каждого из соединяющихся атомов. Таким образом, валентность элементов некоторых соединений определяется числом электронов атомов, участвующих в образовании таких электронных pairs.
At в то же время максимально возможная валентность элемента будет равна общему числу неспаренных (или слабопарных) электронов в системе. atom. As как правило, это число совпадает с числом групп периодической системы, в которой присутствуют определенные элементы. Например, процесс образования молекул NaF и F3 можно схематично представить следующим образом: На + — Е * * * * * Ф * * * * * * 4- .Ф * * * * * Ф * * * * * * * * * * *
Из этого рисунка видно, что 1 набор электронов соответствует валентной связи (тире) обычной структурной формулы. Большое значение имеет вопрос о расположении этой пары относительно ядра атома соединяться. Вот 2 случая, которые отличаются по своей природе. Орбиты парных электронов почти полностью принадлежат 1 или связаны с обоими ядрами.
Первый случай имеет место, когда один из атомов притягивает электронную пару, которая делает валентную связь намного сильнее, чем другой. 1.Очевидно, что в результате полного вывода электронной пары первый атом приобретает 1 электрон, а второй теряет его. Следовательно, оба атома заряжены. Такие заряженные частицы образуются из атомов (или групп атомов) вследствие потерь* РНС. III-32.
Замкнутая цепь магнитного поля атома гелия. Или добавление электронов называется Ионом. Это особенно касается образования молекул NaF, в которых натрий положительно заряжен, а фтор отрицательно. Из-за противоположного заряда оба Иона притягиваются друг к другу. Однако, приближаясь к определенному пределу, сила взаимного отталкивания электронной оболочки заставляет притяжение остановиться на соизмеримом расстоянии.
Валентная связь с почти полным выводом электронных пар на 1 из атомов и последующим сжатием образующихся ионов называется ионной связью (иначе называемой электронным атомом, gstsopolar).Ионные связи возникают, когда химические свойства реагирующих атомов полностью противоположны. В более формальной интерпретации ионных связей(по Косселю) Кэ можно считать результатом простого перехода электрона от одного атома к другому (рис.111-33).
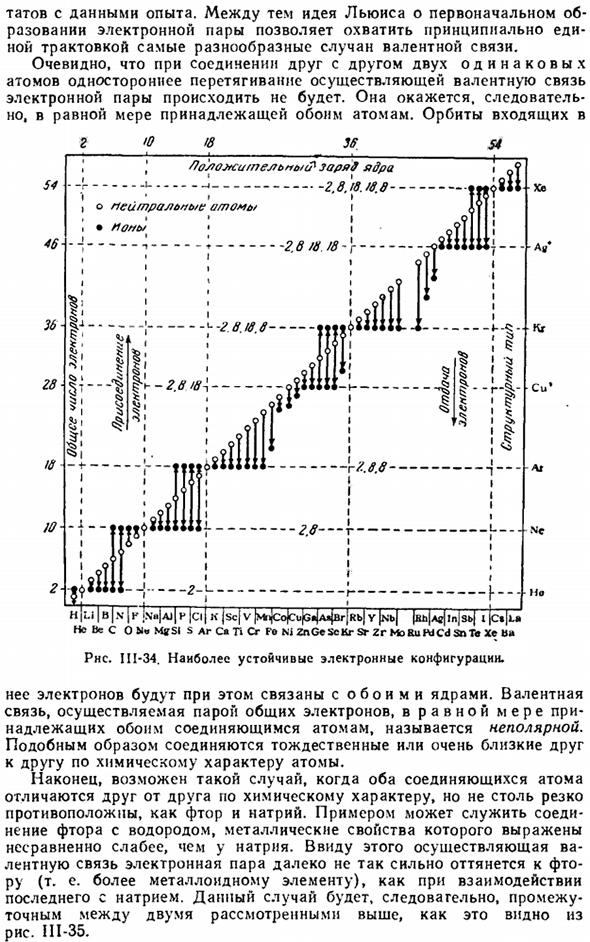
Этот метод простого рассуждения очень полезен во многих случаях. Вы получите тот же конечный результат, что и выше. С точки зрения косселя, причиной химического взаимодействия является»желание» атома достичь наиболее устойчивого расположения электронов. Рассматривая соединения различных изученных элементов с максимальной валентностью, он показывает на Рис. 1 111-34 (в несколько измененном виде), что предпочтительно, чтобы некоторые электронные структуры образовывались раньше других электронных структур.
Это в основном структуры инертных газов, а во внешнем слое находятся 18 электронов. Атомы достигают ближайшего атома путем отдачи или присоединения электронов. Число оставшихся электронов определяет положительную валентность соответствующего атома, а число присоединенных электронов определяет его отрицательную валентность.
Диаграмма III-19 из соображений электронных схем означает, что Na, Mg и AI переходят в структуру неона, P, S, CI легче и ближе к структуре аргона. Обычно первые 3 элемента характеризуются как металлические, вторые-как полуметаллические. Подводя итог этому результату, можно сказать, что с электрохимической точки зрения металлы называются элементами, и в процессе реакции преобладает тенденция отдавать электроны, металлоиды в их отложения.
Однако известно, что многие элементы испускают или объединяют электроны, в зависимости от условий. Таким образом, четкой границы между металлами и полуметаллами нет, но само деление не является абсолютным, подчеркивая лишь доминирующие тенденции определенных типов атомов.
Главным преимуществом идей Косселя является простота и наглядность, а главным недостатком-ограниченность его возможностей. applicability. In дело в том, что все органические соединения и так много неорганических соединений построены по неионному типу, так что если подумать с точки зрения ионов、 Atoch Ф Атай\ я Ко Купянск% Г РНС. Ш-33.
Схема молекулярного образования Kossel NaF. У нас есть большой опыт. С другой стороны, идея Льюиса о начальном образовании электронных пар позволяет охватить различные случаи валентных связей принципиально Единой интерпретацией. Очевидно, что если 2 одинаковых атома соединены друг с другом, то одностороннее притяжение валентной электронной пары не будет occur.
So вы можете видеть, что оба атома одинаково притяжательны. Орбита И / Ли |В / Н Ъ К) Н’jaj | П МПМ / назначения| СК / в / MrijCojCujGftjAijBrjRbJ г | ш | 「* Не C O ’MffSI S Ar S» G » Cr Fo NJ ZnGeScKr Sr Zr MoRuPdCd snTe Xe b * Рнс. II1-34.Самая стабильная Электронная конфигурация. Ее электроны соединены с обоими атомными ядрами.
Валентная связь, которая осуществляется парой общих электронов, принадлежащих в равной степени обоим связанным атомам, называется неполярной. Точно так же связаны атомы, которые идентичны или очень близки по химическим свойствам. Наконец, такой случай возможен, когда химические свойства обоих соединенных атомов отличаются друг от друга, но не так резко противоположны, как фтор или sodium.
An примером может служить комбинация фтора и водорода, металлические свойства которых описаны как гораздо более слабые, чем металлические свойства натрия. Учитывая это, электронная пара валентной связи далеко не притягивается к фтору (то есть к более полуметаллическим элементам), как при взаимодействии фтора с натрием.
Таким образом, в данном случае, как видно из рисунка 2, будет 2 промежуточных, которые мы рассмотрели выше. II1-35. 3-й основной тип валентной связи-полярная связь-характеризуется тем, что электронная пара притягивается более или менее односторонне одним из соединяющихся атомов, но не настолько, чтобы образовался независимый Ион.
Орбиты его электронов остаются связанными с обоими nuclei. In с точки зрения последней ситуации, полярная связь обычно сочетается с неполярной связью в родовом названии коалентной (иначе атом, гомеополярная) связи. Наиболее важными свойствами валентных связей являются их энергия и полярность.
И то, и другое в какой-то степени зависит от длины связи (d), то есть расстояния между ядрами образующих ее атомов. Коммуникационная энергия понимается как работа, которую необходимо потратить, чтобы отключить это connection. So, энергия связи характеризует ее интенсивность.
Обычно эта энергия связана с g-молекулой (то есть с 6.02-10 ^связью) и выражается в килокалориях. Для некоторых она связана с n! * F может быть очень разным. Например, энергия! * H-H связь составляет 104 ккал / моль, энергия связи ! F-F составляет 38 ккал / mol. As в результате, соединение * Т * между атомами в молекулах водорода намного сильнее «Больше, чем молекула фтора.* −12 Диаграмма II1-35.
Схема полярности характеризует электрические симметрии различных типов валентных связей symmetry. As это видно из рисунка валентной связи. II1-35, ионные и неполярные связи являются случаями крайней полярности в природе. Если полярность (Р) строго неполярной связи равна нулю, а чистый Ион (включая одновалентные ионы) считается единичным, то в случае середины возможна четкая оценка полярности связи простой дробью.
Например, rng = 0.39, то есть связь H-F несколько ближе к неполярному типу, чем к ионному. Аналогичная количественная характеристика полярности связей может быть объяснена только для очень небольшого числа простых молекул. Добавь 1) первой попыткой объяснить природу сил химического взаимодействия была теория Бертоле. Кто отождествил их с гравитацией.
Очевидно, что с этой точки зрения атомы должны быть сильнее и притягивать друг друга с большей массой. Поэтому специфика взаимодействия различных элементов была принципиально отвергнута. Отрицанием этой специфичности стала разработанная Березнелусом электрохимическая теория.
Согласно последнему, в каждом атоме есть 2 противоположно заряженных полюса: положительный и отрицательный. negative. In в одном случае (в металле) преобладает первый, в другом-второй (в полуметале).Таким образом, считалось, что электрохимическая теория делит все элементы на 2 четко разделенных класса, и только атомы с противоположными электрическими свойствами могут соединяться друг с другом.
Электрохимическая теория была отвергнута, когда стало ясно, что элементы одного и того же класса также могут быть взаимосвязаны. Его отрицание было настолько резким, что в течение нескольких лет наука вообще не ставила вопрос о природе химических взаимодействий и оставалась формальной интерпретацией экспериментальных данных.
Теория валентности, разработанная на основе этого подхода, в основном делала возможной возможность связи между любыми атомами, но на самом деле она учитывала, что один элемент связан друг с другом, а другой-нет. Поэтому она признала специфику химического вещества Действуйте, не подавая вида well. It был последним ее абсолютным характером и был приписан ей электрической теорией.
Попытки вновь поставить вопрос о природе химических взаимодействий и решить его на основе электронных представлений возникли только в этом century. It включает, в частности, эти 2 направления теории валентности, основные положения которой были сформулированы косселем и Льюисом в 1916 году.
2) Как установлено расчетами, замыкание самого магнитного поля дает лишь очень малую часть его полной энергии. Это соответствует образованию валентных связей между атомами, что определяет прочность этой связи. Главный Важна электроэнергия, возникновение которой можно четко интерпретировать с помощью рассмотренных ниже моделей.
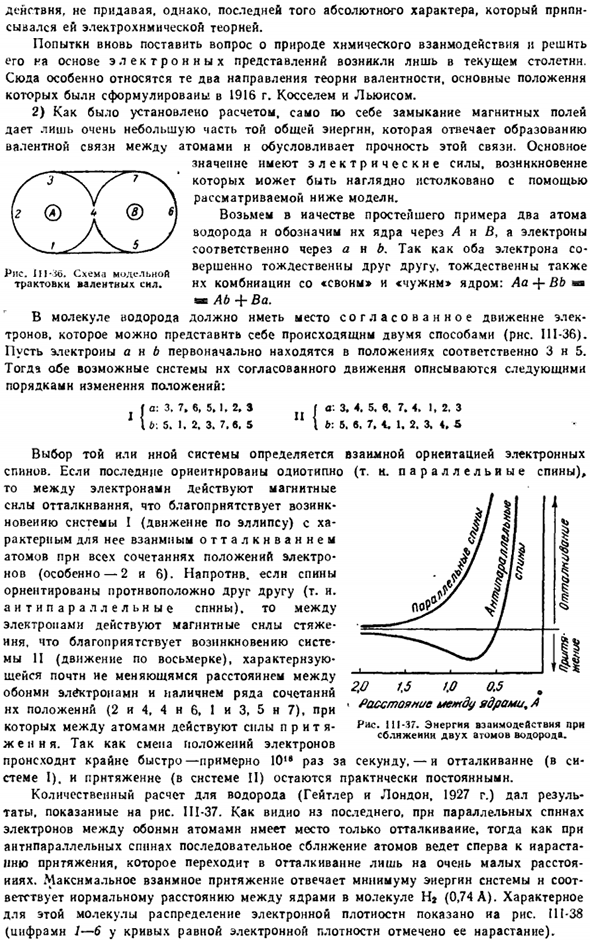
В качестве простого примера возьмем 2 атома водорода, и обозначим их ядра как A и B соответственно, а электроны как a и B. Оба электрона полностью идентичны друг другу, поэтому они также идентичны в сочетании с лебедями и чужеродными»ядрами: Aa-f-Bb»»Ab + Ba». В молекулах водорода необходимо скоординированное движение электронов. Вы можете представить себе, что это происходит двумя способами (рис.111-36).
Предположим, что электрон a n b сначала расположен на 3 и 5 соответственно. Порядок изменения положений: / а: 3. 7. С, 5.1. 2, с ф С. 3. Б: 5. 1. 2, 3. 7. С. 5 \ Б: 5. Фиг болезнь-ЗБ. Схема модельной интерпретации валентности. с. 3. 4. 5. с. 7. 4. Я, с 2.3. 7. 4. 1. 2. 3, 4, 5 Выбор той или иной системы зависит от взаимной ориентации электронных спинов.
Если последний ориентирован в одном направлении(в случае параллельных спинов), то между электронами действует магнитная сила отталкивания, которая способствует появлению системы I(движение по эллипсу) с характерным обратным отталкиванием атома для всех комбинаций положений электронов(в частности, 2 и 6).Наоборот, если спины направлены в противоположные стороны друг к другу (то есть не параллельны Данне).
- Тогда магнитная сила напряжения действует между электронами. Это способствует возникновению системы II (движение на рис. 8). она характеризуется наличием комбинации их положений (2 и 4, 4 и 6, 1 и 3, 5 и 7), с небольшим изменением расстояния между обоими электронами. 。Изменение положения электронов происходит очень быстро, поэтому оно составляет около 10 раз в секунду. — Отталкивание (Система 1) и притяжение (система II) остаются почти постоянными.
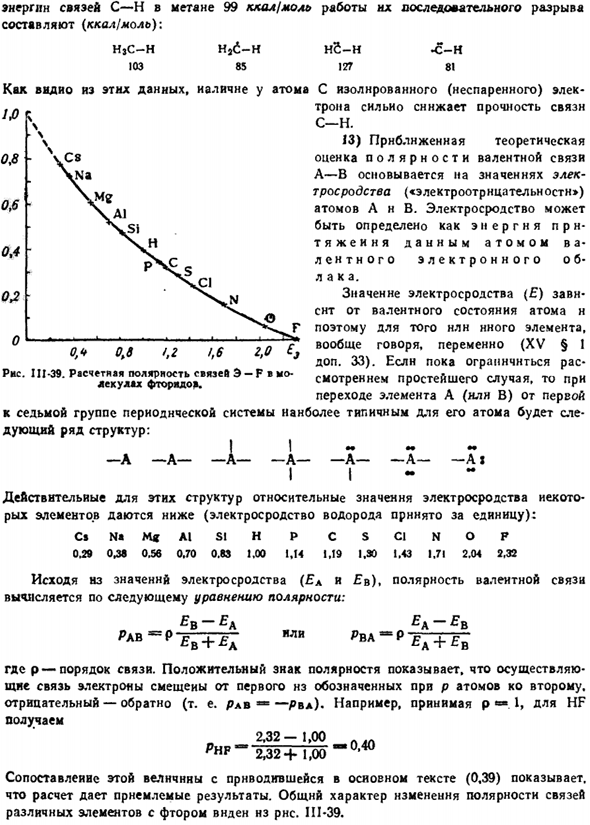
Количественный расчет водорода (Geithler and London, 1927) дал результат. Показано на фиг. II1-37. В случае антипараллельных спинов непрерывное сближение атомов сначала приводит к увеличению силы притяжения, и только на очень малом расстоянии переходит в отталкивание.
As из последнего видно, что только отталкивание происходит между параллельными спинами электронов между 2 атомами. Людмила Фирмаль
Максимальное взаимное притяжение соответствует минимальной энергии системы и нормальному расстоянию между ядрами в молекуле Н2 (0,74 а).Распределение электронной плотности, характерное для этой молекулы, показано на рисунке. 111-38(на рисунке/ −6 кривой той же электронной плотности видно увеличение). 2.0 1.5 KO 0.5 * дистанция и ралли яд ралли, а Рисунок Ил-37-энергия взаимодействия при сборе 2 атомов водорода.
Таким образом, валентная сила имеет не магнитную, а электрическую природу. Однако необходимым условием проявления этих сил является наличие неявного параллельного спина обоих электронов, что приводит к замыканию взаимных магнитных полей. Ярким примером является работа двигателя автомобиля.
Тяга, которую он производит, достигается за счет сгорания бензина, но это возможно только при наличии воспламенения system. As в результате основные мысли Льюиса о роли образования электронных пар в образовании валентных связей между атомами полностью сохраняют свое значение. 3) Кроме внешних электронных октетов (8) и 18-электронных оболочек, характерных для большинства инертных газов, во многих случаях можно видеть, что внешний электрон 2 стабилен.
Например, кроме SOj. Из их числа Сера притягивается кислородом ко всем 6 электронам во внешнем слое, и есть еще один стабильный оксид SOj. Только 4 тянет сюда. Аналогичным образом, построенное соединение известно для многих других элементов. 4) с электрохимической точки зрения правильнее было бы разделить химические элементы не на металлоиды и металлы, а на электрофильные агенты (они склонны присоединять электроны в ходе реакции) и электроды (они склонны терять электроны в ходе реакции).
Не говоря уже о ясности самих этих терминов, возможна более существенная классификация. Правда, помимо металла, типичным электродом является такой. И, более или менее, отолитовому электроду (то есть склонности к развитию положительной валентности) присущи почти все остальные metalloids. An примером может служить, по крайней мере, фосфор, а соединение кислорода гораздо более характерно, чем водород.
Напротив, преобладающая электрофильность (то есть тенденция к проявлению отрицательной валентности) характерна лишь для относительно немногих наиболее типичных металлоидов на практике. 5) Следует подчеркнуть, что идея о том, что 1 из атомов при образовании ионной связи вытягивает связывающее электронное облако полностью, является упрощением reality. In на самом деле, такая тяга может быть белее, чем почти полная.
Ситуация, близкая к этой, происходит с наиболее типичными кристаллами соли, но связи отдельных молекул(пар) уже существенно отличаются от связей чисто ионной природы. Таким образом, нет границы между полярными и ионными связями. 6) из вышесказанного, в общем случае, следует полярность валентной связи, то есть она является промежуточной между Ипполитом и ионами.
С другой стороны, во многих случаях все валентные связи грубо делятся на 2 крайних типа атомов (общих) и ионов. — Обеим даны совершенно разные характеристики. Не говоря уже о значении приписывания свойств связей тому или иному типу в явно промежуточных случаях (таких как HF), такой примитивный подход затемняет индивидуальные свойства отдельных валентных связей и тем самым препятствует более глубокому пониманию свойств материи.
7) признание полярности валентных связей в общем случае приводит к важному следствию: в химических молекулах вещества (добавление I§ 6.3) валентная связь (а иногда и только принятые ковалентные связи) описывается схематически указанной структурной формулой.
Например, если вы можете описать структурную формулу молекулы нитрата, вы можете описать структурную формулу молекулы нитрата натрия. Однако связь N’A-O очень полярна. Между ними нет принципиальной разницы (XIII§ 1, add. См. 104). г Рис. 111-38. H}распределение электронной плотности молекулы. С кремнием-как taloid 8) в терминах волновой механики (§ 4, дополнение 13) валентная электронная связь образуется электронным облаком, и характер распределения плотности между атомами определяет характер связи.
Общая плотность валентного облака не обязательно должна точно соответствовать 2, 4 или 6 электронам. То есть фактическая степень (p) ковалентной связи может несколько отклоняться от ее целочисленной кратности (1, 2 или 3).Это тот случай, когда общая плотность валентных электронных облаков увеличивается(за счет облака 1 свободного электрона атомов или облака смежных валентных связей) или уменьшается (в результате выделения части валентных электронных облаков на 1 атома или смежные валентные связи).
Подобное смещение электронного облака в молекуле часто обозначается изогнутой стрелкой. Вышесказанное можно объяснить следующей схемой: / О-Б ^ -Б А — 1Г-Б Ив » Вт ПА」 Поскольку отклонение порядка связи от кратности целых чисел обычно невелико, в большинстве случаев классическая структурная формула числителя дает приближение, более близкое к реальности, чем другие.
9) разложение ионных валентных связей, происходящее в ходе химических реакций, происходит, как правило, в гетероретическом (то есть с образованием противоположно заряженных ионов), а разрушение неполярных связей происходит равномерно(т. е. с образованием нейтральных радикалов).Тип разрыва полярной связи сильно зависит от общего характера процесса, в котором участвует эта связь.
Понятие энергии связи^обычно относится к ее гомеровскому разрыву. 10) строго говоря, энергия связи равна работе ее разрушения, а состояние образующихся радикалов (квантовые свойства, пространственная структура, распределение электронной плотности) не изменяется по сравнению с исходным radicals.
In дело в том, что такое изменение большого или малого всегда происходит, но, как правило, установить энергетический эффект не представляется возможным. Обычно энергия связи просто приравнивается к теплоте разрыва гемолиза, рассчитанной по экспериментальным данным. 11) для валентных связей того же типа энергия обычно обратно пропорциональна длине. Однако это соотношение является приблизительной оценкой и часто нарушается.
Поскольку кратность энергетических связей увеличивается, энергетические связи быстро увеличиваются, например, как вы можете видеть из средних данных, обычно отображаемых. Общение………… СК-СС-СС-КИ С-С Н-Н-Н-Н-Н-Н-Н-Н-Н-Н-Н-Н-Н Энергия, ккал / моль….. | 83 146 200 | 73 147 213 | 48 104 226 Для связи C с N, если энергия приблизительно пропорциональна кратности, то для остальных 2 Эта пропорциональность уже не наблюдается.
Существует специальная монография по энергии связи. •• 12) когда одна или другая молекула содержит несколько одинаковых связей, их энергия сама по себе одинакова. Например, разложение молекул воды по общей схеме НОН Н «н + о + +» требует затрат 221 ккал / моль, что соответствует средней энергии связи H — O 110,5 ккал / моль. Однако если разбирать последовательно по схеме HOH = H-OH и OH = O + H, то расход энергии уже будет разным.
Для разделения первого атома водорода требуется 119 ккал / моль, второго-102 ккал / моль. Следует иметь в виду, что в литературе обычно приводится только середина энергии валентной связи, от которой реальная работа разрушения рассматриваемых процессов отличается более или менее существенно. Например, pr-среда * Коттрейалт.
Прочность соединения. С английского, Изд. А. А. Балландина. М отек. 1956.281 секунд •* Кондратьев В. Н » успехи химии. 1957,. * 8. Восемьсот шестьдесят один、Energy-energy энергия связи метана 99 ккал / моль, работа NX непрерывного разрушения(ккал / моль) н, з-п£ — н уг-ч «с-н 103 85127 81
Как видно из этих данных, наличие изолированного (неспаренного) электрона-lfl-трона в атоме С.、 ВТ Ч 13) теоретическая аппроксимация полярности валентной связи A-B основана на величине электрического („электро-направленного“) сродства атомов A и B. электронное сродство можно определить как энергию гравитационного притяжения облака валентных электронов, обусловленную конкретным атомом.
Величина ( £ ) электричества зависит от валентного состояния атома, поэтому для других элементов nln она обычно является переменной (XV§ I add.33).Если ограничиться рассмотрением простейшего случая, когда элемент A (nln B) проходит через 1-7-ю группу периодической системы, то наиболее типичной для его атомов становится структура следующей структуры. — А-А.— —1— — А— А-А-А-А-А-А-А Фигура III-39.Вычислите полярность связи EF молекулы фтора.
Исходя из величины электрического сродства (£A и£in), его вычисляют по следующему уравнению полярности: Рава 1.43 1.71 2.04 2.32 полярность валентной связи £А — £Р £ А +£Б Ниже приведены относительные значения некоторых элементов, эффективных для этих структур(в качестве единицы используется водородное электричество): С » NaM » A1 SIHPCS cio 0.29 0.38 0.70 0.83 0.14 1.19 1.30 Или Ров Где p-порядок связи.
Положительный знак полярности указывает на то, что электрон, осуществляющий связь, перемещается от первого атома×ко второму, обозначенному p, а отрицательный атом переворачивается (то есть rcv-rvl).Например, если взять p»1, то для HF、 2.32-1.00 pH-2 ^ 32 4-1. Ноль ноль Если сравнить это значение со значением, указанным в теле (0.39), то можно увидеть, что расчет дает приемлемые результаты. Общая природа изменений полярности связей различных элементов и фторидов присуща РНС. III-39.
Смотрите также:
| Атомные модели | Типы простейших молекул |
| Теория водородного атома | Межмолекулярные силы |
