Оглавление:








Типы простейших молекул
- Виды простых molecules. As в результате соединения 2 атомов различными типами связей образуются соответствующие 2-атомные молекулы. II МО. Поскольку ионный и неполярный типы На самом деле являются крайними случаями полюсов, целесообразно исходить из последних в ходе дальнейшего обсуждения. Полярные молекулы, такие как HF, характеризуются неравномерным распределением charge.
- As в результате вытягивания фтором связывающей электронной пары часть молекулы, содержащая его, имеет некоторый избыток отрицательного заряда, а та часть, где находится водород, оказывается положительной. In обычно электрически нейтральные молекулы содержат положительно заряженные атомы (ядра) и отрицательно заряженные частицы (электроны).Для каждой частицы каждого типа можно найти точку, которая является электрическим «центром притяжения».
Вы можете подойти к тому же виду из более общего perspective. Людмила Фирмаль
Его расположение, по-видимому, зависит от расположения самих частиц и величины их заряда. Если электрические центроиды положительных и отрицательных частиц совпадают, то вся молекула характеризуется равномерным электрическим распределением, то есть она неполярна. Если электрический центр тяжести не совпадает, то получается Полярная молекула. Наконец, в случае очень резкого расхождения центра тяжести молекулы строятся по ионному типу. Степень неоднородности распределения электричества в молекуле определяет ее полярность.
Последнее можно количественно охарактеризовать, введя понятие так называемого dipole. It понимается как система различных зарядов 2 одинаковых размеров на известных расстояниях друг от друга. Если величина каждого заряда равна элементарному количеству электричества (заряду электрона) во всех случаях, то расстояние между ними nns. 111-41.Молекула m — это длина диполя, а полярность молекулы визуально характеризуется различными полярностями.
Таким образом, молекула II1-41, схематично показанная на рисунке, является молекулой B с более высокой полярностью. Численное значение длины молекулярного диполя, определенное таким образом, обычно равно доле Ангстрема. Полярность двухатомной молекулы может быть аппроксимирована на основе температуры плавления или кипения рассматриваемого соединения: для вещества с ионным типом молекулы обе температуры очень высоки и относительно низки для неполярного или полярного вещества.
Таким образом, следующие константы соответствуют веществам, изученным выше. N » F HP FP точка плавления, eC 995-83-220 Точка кипения. * С-1702 4-20-188 В более сложных случаях, необходимо различать общие свойства молекул и свойства отдельных облигаций. Важным для первого является наличие или отсутствие ионов. Если это так, то рассматриваемое вещество в отношении плавкости и летучести ведет себя аналогично тому, которое состоит из простейших полярных или неполярных молекул, а если нет, то из простейших ионных молекул.
Например, S03 не имеет ионной связи и его температура плавления составляет-f 17°C. напротив, в Na2S04 связь между натрием и кислородом является ионной, и эта соль эо о N » P NG ИППИ » Полярная непо/ мрная Néléneu/iolém Рис. 111-40.Различные типы молекул. Он плавится только при 884 С. Природа отдельных связей комплексных соединений может быть грубо объяснена (аналогично 2 атомным молекулам), если известны свойства входящих в их состав элементов и порядок их сочетаний с другими атомами.
Структурная формула молекулы (I§ 6) показывает порядок связей между атомами, но ничего не говорит о взаимном расположении атомов в пространстве. С другой стороны, знание этого устройства очень важно для химии. В настоящее время существует множество методов, с помощью которых можно установить пространственную структуру молекул, тем самым получив более полное и точное описание молекулы.
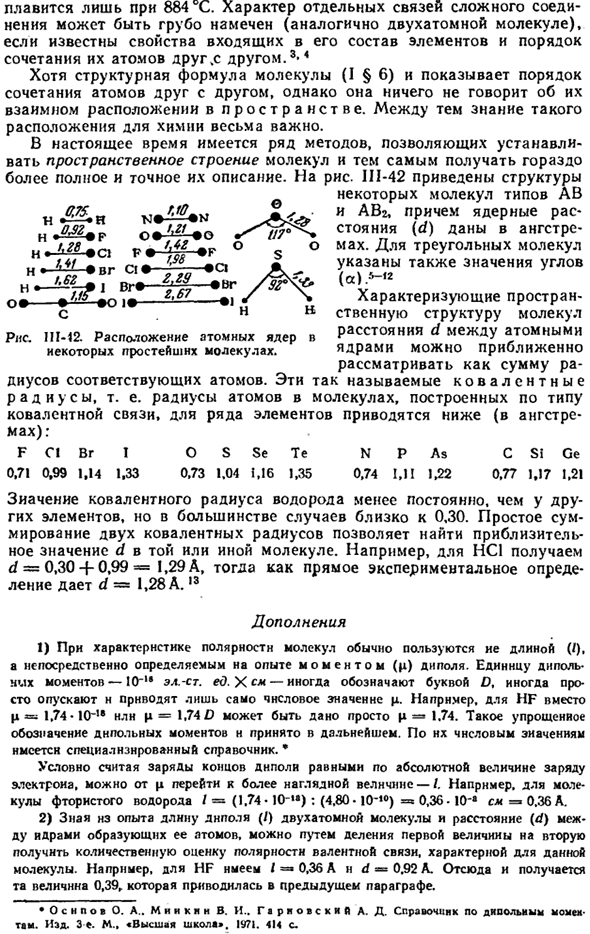
На рисунке II1-42 показана структура Некоторые молекулы типа AB и ABr, а также ядерное расстояние (d) обозначаются ангстремами. Для молекулы треугольника также указывается угол («).-» Расстояние d между ядрами атомов, характеризующее пространственную структуру молекулы, можно грубо считать суммой радиусов соответствующих атомов. Эти так называемые ковалентные радиусы, то есть радиусы атомов в молекуле, построенные по типу ковалентной связи, показаны ниже для некоторых элементов (в единицах Ангстрема).)
: Ф с! BR I O S Se Te N P SI Ge а также 0.71 0.99 1.14 1.33 0.73 1.04 1.16 1.35 0.74 I и 1.22 0.77 1.17 1.21 Величина общего радиуса водорода менее постоянна, чем у других элементов, но в большинстве случаев она ближе к 0,30. Простая сумма 2 общих радиусов позволяет нам найти приблизительное значение d для конкретной молекулы. Например, для НС1, д = 0.30-0.99 Ф = 1.29, но если вы решили на прямом эксперименте, д = = 1.28 А.
Это будет 13. Добавь 1) при характеристике полярности молекулы обычно используется длина ( / ).Дипольный момент © определяется непосредственно опытом. Единицы измерения диполя момента — 10 «и Эл. ст. единиц X см-могут быть обозначены буквой D, а могут просто отображаться, опуская только число C. Например, для HF вместо p 1. 74-10〜, nln c = 1.74 D можно легко определить.= «1.74.такое упрощенное обозначение момента dkpol будет принято в будущем.
По их данным, nmset является профессиональным справочником. Если условно принять во внимание, что абсолютное значение заряда на обоих концах диполя равно заряду электрона, то можно перейти от р к более очевидному значению -/.
Например, молекула фтористого водорода/ = «(1.74-10-«):(4.80•10’10)0.36-10 «см =.0.36 А. 2) из опыта, если мы знаем длину диполя двухатомной молекулы ( / ) и расстояние между ядрами образующих ее атомов (d), то, разделив первое значение на 2-е значение, мы можем получить количественную оценку полярности валентной связи, характерной для конкретной молекулы. Например, для КВ,/ = 0,36 а н д = 0.92 А.
Таким образом, вы получите значения в 0,39, что вы получили в предыдущем разделе. Осипов О. А.. М и к Н И В. И.. Гариковский А. Д. Справочник есть. Эд. 3 Э. М.. «Высшая школа.»1971 год. 414 С. Рисунок II1-42.Расположение атомных ядер в некоторых простейших молекул. Следует отметить, что измерение полярности такой связи не является точным, так как даже самая простая молекула АВ является дипольным моментом.
Вообще говоря, это может зависеть не только от распределения между А и в электронных облаков валентных связей а-в, но и от других особенностей рассматриваемой связи и молекулы в целом (нет единой точки зрения на относительную значимость таких сложных моментов, ясно, что величину дипольного момента момента можно определить только по кажущейся полярности связи а — в).От этой полярности истинная полярность несколько отличается.
- Однако нет общепринятого способа установить истинную полярность связи, поэтому вы должны использовать эту связь (которая будет условно применять кажущуюся полярность как истинную). «Выдвигать гипотезу, которая со временем может стать неточной, лучше, чем ничего» (Менделеев). 3) природа валентной связи многоатомной молекулы не может быть очерчена, как правило, на основе экспериментально определенной полярности (z-значение).
Например, молекула типа AB4 является биполярной, что не устанавливает неполярности связей AB в молекуле. Реальная причина общей неполярности таких молекул связана со свойствами их пространственной структуры(полярность каждой из 3 связей точно компенсируется полярностью 4-й).при этом диполи многоатомных молекул часто располагаются не вблизи их геометрических центров, а вблизи 1-го конца.
4) при детальном описании внутримолекулярного распределения электричества необходимо установить степень электронного насыщения каждого атома, образующего данную молекулу, которая может быть выражена с помощью его формального эффективного заряда(в).
Последняя определяется численно (в единицах е) как алгебраическая сумма полярностей связей, связывающих конкретный атом со всеми другими атомами. Людмила Фирмаль
Для молекул типа AB (§ 5 add.13) ББ = РВЛ и ба = л » рлв. в прнмере. Для молекул воды pno = » 0.34, 6c =* + 0.34 и 5o = −0.68.Расчет экспериментальных данных (пар пространственной структуры и момента дна) дает приблизительно совпадающее значение= = +0.33 и bo = −0.66. 5) простейший тип пространственной структуры молекул АБ показан на рисунке. Ш-43.Поскольку двухатомная молекула AB линейна, для ее объяснения достаточно знать расстояние (d) между ядрами обоих атомов. Расстояние обычно составляет 1-для.
Трехатомная молекула AB3 имеет форму изометаллического треугольника, который в большинстве случаев имеет Атом A на своем конце. apex. To объясняя их, нужно знать не только расстояние d, но и уже. угол наклона вершины io и треугольника (a). Выравнивание молекулы ABA не очень распространено, но его можно считать частным случаем треугольника(pr a = 180°). Для молекулы ABj форма треугольной пирамиды с атомом A на вершине является наиболее подходящей common.
In кроме расстояния d, необходимо знать высоту угла a или пирамиды (L) вершины, чтобы описать структуру. Форму плоского треугольника с атомом A в центре можно считать частным случаем обычной пирамидальной структуры (a = 120°и h = 0), что делает молекулу AB3 менее характерной. 4 Б, В, Некрасов Структура молекулы AB4 чаще всего соответствует форме тетраэдра с атомом а в центре. Углы правильного тетраэдра постоянны и равны друг другу (BAB = 109,5°), поэтому вы можете описать структуру, если знаете расстояние d. форма четырехугольной пирамиды с атомом A наверху менее распространена в комбинации атомов типа AB4.
Часто вы будете сталкиваться с этим ограничительным случаем-плоским квадратом с атомом A в центре (A = 0).Как и обычные тетраэдры, эта структура может быть описана одним значением D. Это связано с тем, что углы также одинаково постоянны друг от друга(Z BAB = 90e). Относительно редкая комбинация атомов типа AB $обычно имеет структуру Тритон-альбипирамиды с атомом A в центре.
Мысленно сложив основание из 2-х равносторонних пирамид, легко представить себе эту пространственную фигуру. В отличие от предыдущего случая, атомарная комбинация типов AB очень распространена. Они характеризуются формой октаэдра с атомом а в центре. Поскольку углы октаэдров равны друг другу и постоянны (Z = 90°), то для характеристики пространственной структуры достаточно знать расстояние d.
6) если другие атомы, связанные с центральным атомом (а), не совпадают, приведенная выше простая структура получит некоторое искажение, и объяснение будет больше complicated. So, для трех атомарных молекул ABC, не 1, а 2 расстояния{rf (AB) и d(AC)], для 2 молекул ABCD необходимо распознать 3 расстояния и 3 угла и т. д. 7)в области термостабильности данного вещества температурная зависимость структуры его молекул очень велика. small. So, при 25 и 230°C молекула PCU характеризуется следующими параметрами соответственно: d (PCl)= 2,039±0,0014 и 2,045±0,001 b A. ZC1PC1 = 100,27±0,09°и 100,40±0,16°.
8) молекулярная структура 42-42, показанная на рисунке, взята из спектральных данных. подобно n атомам(§ 4), молекулярный спектр квантован. появление hx обусловлено электронными переходами, то есть изменением состояния определенных электронов в молекуле. Такие изменения актуальны ■ Микро-8 ″ отеле™ И » риск заболевания гриппом»」 НПФ ^ РФ-ФИОП ^ Тобо * Незаконные omeflb ст ^ Спектр Он вибрирует. Спельта Центр м-тг Ага.* Л Ю Ш У. один И затем… 1С » 1 1мм y ’00 WO Вт. > 000 1 Мп Цифры 111-44.
Область электромагнитного спектра. Поскольку он содержит эргий порядка сотен или десятков ккал / моль, он отражается в ультрафиолетовой или видимой части спектра. Его инфракрасная часть отражает колебательное движение атома, энергия которого обычно составляет порядка ккал / моль, и вращательное движение молекулы, энергия которой вычисляется в малой части ккал / моль. Отдельные области электромагнитного спектра схематично показаны в РНС. 111-44, длина волны и соответствующее волновое число нанесены на абсциссу.
Имеется монография по инфракрасному спектру неорганических соединений. * * Накамото К. инфракрасный спектр неорганических и координационных соединений с английского языка, Изд. Ю. А. Пентан.«М. .«Мир» Лиу. 411 С. Все вышеперечисленные 3 эффекта накладываются друг на друга, поэтому в отличие от атомного спектра молекулярный спектр состоит не из отдельных линий, а из многочисленных полос («полосовой спектр«).
Область электромагнитной волны, в которой находится система этой полосы, определяется характером электронного перехода, распределение отдельных полос в системе определяется изменением энергии колебаний, а тонкая линейная структура полосы определяется изменением энергии вращения.
Вы можете легко рассчитать энергию процесса, соответствующую появлению каждой линии спектра, используя соотношение E = hv%от соответствующей удельной длины волны(X), частоты вибрации (v).Однако установление природы этого процесса («частотное присвоение») очень затруднено, иногда даже простыми молекулами, из-за сложности молекулярного спектра.
Например, энергия, необходимая для распада молекул N2 атомами, долгое время считалась равной 170,2 ккал / моль, но относительно недавно было обнаружено, что предыдущее»частотное назначение»было неверным, и фактическое значение этой энергии составляло 225,1 моль / КК (pr0°к).
9) если ультрафиолетовая и видимая части молекулярного спектра позволяют установить важные энергетические свойства молекул (энергия возбуждения, разделение электронов, разрывы связей и т.), спектр вращения (от доли 1 миллиметра до сантиметра, то есть часть возбуждения и область инфракрасного спектра). Двухатомная молекула может вращаться вдоль оси, соединяющей оба атома.
Перпендикулярно dr \ r к другим плоскостям. Враще-、» J r Y-V1 3 V рисунок PN5.Роторный тип схемы АВ Первый тип энергии практически не нужен(следовательно, он не отражается в спектре), но остальные 2 типа энергетически идентичны. Ситуация более сложная, есть 3 или более атомных молекул, иногда вращающихся вокруг 3 энергетически различных типов центра тяжести(rns.111-45).
Когда пространственная структура установлена из данных спектра вращения, мы находим волновые числа, соответствующие типу вращения, возможному в исследуемой молекуле. Эти величины связаны определенной зависимостью с моментом инерции, характерным для конкретной молекулы (до 3 возможных).Если мы знаем массу последнего и отдельных атомов, мы можем вычислить структурные параметры (ядерное расстояние и валентный угол) скулы M01.
В простейшем случае двухатомной молекулы значение момента инерции составляет всего 1: / = md1 g * cm2, откуда d = * l/*.Уравнение включает в себя так называемые. прнве- т т т т Я 1.1 Т•Т-2 Масса определяется соотношением — ■■ — — — — или Т — — — -; -, где мм / н] / л — ф-т * 7?/ И r2-это массы атомов конкретной молекулы (то есть массовое число, умноженное на 1.60-> 0 и R.).Этот момент связан с волновым числом, характерным для вращения, благодаря соотношению между ω= 55,8-10 ″ * °g * см.
Например, если хлористый водород a> = 20,7 см\, то расчет ядерного расстояния этой молекулы будет равен d = 1. 28 ″ 10 е см = 1.28 А. Изучение длинноволнового инфракрасного спектра связано с большими техническими трудностями, но оно осуществляется традиционными оптическими методами.
Напротив, радиоспектроскопия, применяемая в области более длинных волн порядка J-G-10 см (иначе-СВЧ-спектроскопия), основана на совершенно иной методике: определяется частота радиоволн, избирательно поглощаемых этим веществом. Спектральный метод (в частности, радиационная спектроскопия) превосходит все остальное по точности полученного структурного определения, но его можно применять только к относительно простым молекулам.
Имеется обзорная статья об использовании радиоспектроскопии для установления структуры молекул. • * Жаботинский Л. М. Е.. Достижения в области химии. I9S5. М 6. 730. 10) очень интересным для химии является колебательный спектр. Это связано с колебанием атома вблизи положения равновесия, которое происходит на частотах от 1 до 10 раз (для легких атомов) до 10-12 раз (для тяжелых атомов).Обычно характеризуется диапазоном микрон или десятками волн (то есть несколькими тысячами или сотнями волновых чисел), расположенных в инфракрасной области.
Колебания атомов могут происходить по линиям валентных связей (растягивающие колебания) и в других направлениях (деформационные колебания).Первое приводит к временному изменению ядерного расстояния, а второе-главным образом к углу связи # )、 Ф * * * меня? f-совместимая, телескопическая вибрация、 ^Постоянная мощность может быть вычислена Диаграмма III-46.
Линейный триатом вибрационного типа ( £ ), характеризующий жесткость молекулы. г’ лейтного соединения, т. е. сопротивления Длина будет vary. In простейший случай двухатомной молекулы、 1 ПГ Идентификатор обеих величин®= 2.4•10 «» dn / a 2.4 mdn / A).С увеличением атомарности молекул определение констант сил становится очень сложным, из-за чего их значения далеко не известны (не всегда достоверны) для всех связей.
Постоянная силы сильно зависит от природы связывающих атомов и очень сильно зависит от краткости bonds.It также несколько отличается в зависимости от природы атомов, окружающих данные.Хорошим примером является среднее значение констант силы для простых (ft-* 4.5), двойных (ft == 9.6) и тройных (ft = 15.6) связей между атомами углерода.
Силовые константы часто характеризуют 1 или другую инжектируемую связь, которая более отчетлива, чем энергия.Последняя менее восприимчива к структурным изменениям, более того, она обычно является специфическим средством, поскольку непосредственно не относится к этой связи(§5, дополнение 12).
Между постоянной силы и энергией связи нет общей численной зависимости, но при переходе от одной связи с той же связью к другой обе величины обычно изменяются (хотя и в разной степени) в одном и том же направлении. 12) исходные данные, необходимые для вычисления постоянной силы, также можно найти из спектра комбинационного рассеяния (также известного как спектр комбинационного рассеяния).
Если вещество освещается определенной длиной волны света (обычно используется лазерный луч или ртутно-кварцевая лампа, из его спектра светофильтром извлекается сильная синяя линия X =»4358 A), то этим веществом рассеиваются не только исходные световые лучи (, Soe>. существует также относительно слабая линия, которая соответствует такому расположению.
Исходные o *(т. е. частоты, определяемые по колебательным спектрам (coi, o> i и др.) хорошо сочетаются с волновыми числами (чтобы соответствовать или дополнять их). ння)энергия падающих лучей с энергией колебательного движения атомов данного вещества. Поскольку изучение комбинационных спектров намного проще, чем инфракрасных лучей, большинство начальных значений ω для вычисления констант сил берутся именно из них spectra.
At в то же время волновое число, которое они дают(обычно называемое частотой), имеет очень независимое значение, поскольку даже сложные молекулы могут установить наличие других связей. Например, характерное волновое число связи C-H («частота комбинационного рассеяния») обычно находится в пределах 2800-3350 см, в то время как общее значение метановых углеводородов составляет около 2900 Эл * 1, для этиленовых углеводородов-около 3050 си», А для ацетилена-около 3300 с**.
Таким образом, проведение»частотного присвоения»той или иной связи относительно простого соединения выявляет многие вопросы молекулярной структуры по спектрам комбинационного рассеяния(смешивание смесей различных видов молекул, а также анализ). 13) значение ковалентного радиуса в тексте соответствует наличию простой ковалентной связи между рассматриваемыми атомами.
Для двойной связи они уменьшаются примерно на 0,10 а, а для тройной связи-на 0,17 А. аддитивность общего радиуса связи строго соблюдается только при низкой полярности coupling. An примером является соединение H-C1 с Puci = 0.17.Напротив, в случае связи H — F расчет сложения дает ядерное расстояние 0,30-f 0,71 = 1,01 A, но в действительности oio составляет 0,92 A.
Аддитивные (то есть осуществляемые простой суммой определенного количества) структуры широко используются в современных теоретических исследованиях. chemistry. To получая приблизительные и приближенные результаты, этот метод вполне применим во многих случаях. Однако переоценка его точности, универсальности и надежности позволяет легче делать ошибочные выводы.
Смотрите также:
| Теория водородного атома | Межмолекулярные силы |
| Валентная связь | Структура твердых тел |
