Оглавление:











Азот
- Особенности азотного азота. Атом азота имеет еще 1 электрон Больше атома углерода; согласно закону Гунда, этот электрон является Свободная орбита 2p. Атомы азота в невозбужденном состоянии、 Теризуется 2 вырожденными 2P электронами в присутствии 2 парных 2 ″ электроны на орбите. 2p, 3 неспаренных электрона на орбите. Жилы в основном трехвалентного азота.
- Вот в чем причина этой черты Летучим атомом водорода азота является аммиак. Азот образует 3 ковалентные связи по механизму обмена с 3 атомами Водород. Азот вряд ли будет стимулировать электроны при переходе к ближайшая орбита N-3 слишком высока для возбужденного состояния Ци для energy. .In Эти 3 ковалентные связи формируются механизмом обмена. 1-донор-акцептор.
So, максимальная валентность азота равна 4 Людмила Фирмаль
Однако азот в состоянии N +、 Все 4 коммуникации в обменном механизме. Азот очень разнообразен. Состояние Окисления:-3、-2、-1、0、+ 1、+ 2、+ 3、+ 4、+ 5。Самые распространенные При окислении образуются производные-3,+ 5, + 3. Азот в природе и его производство. Содержание азота в земле Корочка в виде соединения составляет 0,01 мас., фракционная,%.Атмосфера или больше 75 масс, фракций и% состоят из газообразного азота, который эквивалентен от −4 до J15 т.
Азот образует минералы в виде нитратов: NaNOg в Чили, Индия KNO3-h норвежский CaA * YuzJ нитрат. Композитные азота Производное входит в состав белка и содержится в масле в связанном виде(наиболее крупном 1,5 мас., доля,%), уголь (до 2,5 мас., доля,%). 307. Водородное соединение nitrogen. By свои химические свойства、 Нитрид водорода H3N. химическая структура аммиака、 Орбиталь атома азота образует 3<r связи с 3 атомами водорода.
Он занимает 3 вершины слегка искаженного тетраэдра.4-й пик тетраэдра Он занят одинокой парой атомов азота, которые обеспечивают химическое соединение. Молекулы аммиака ненасыщенные и реакционноспособные, а также крупные Величина электрического момента диполя (fi = 0.5-10〜29 С-М). В нормальных условиях аммиак представляет собой бесцветный газ с резким запахом.
Он ядовитый. Чэнь: раздражает слизистую оболочку и наносит повреждения вследствие острого отравления Глаз и пневмония. При охлаждении до −33°C аммиак разжижается、 −78 ″ с затвердевает. Аммиак в жидкостях и твердых телах действует между молекулами. С водородными связями аммиак имеет много крайностей VA-rpyn-характеристики элемента в сравнении с другими гидридами py. Энтальпия испарения сжиженного аммиака значительно превышает энтальпию боли.
Большинство других сжиженных газов. Для молекул полярности и достаточно высокого диэлектрика Жидкий аммиак является отличным неводным растворителем. Жидкость Аммиак заложил основы химии неводных растворов. Результаты исследования По поведению вещества в жидком аммиаке обобщенное Теория кислот и оснований открыла новые пути для химических реакций В жидком аммиаке, по мере синтеза неизвестных веществ, он хорошо растворяется.
Щелочные и щелочноземельные металлы, сера, фосфор, йод, многие соли И кислота. Вещество с полярной функциональной группой в жидком аммиаке Но они подвержены электролитической диссоциации. Однако, внутренняя ионизация Аммиачная фракция 21ЧН3 (f); f =±NH4 + NH2 пренебрежимо мала, ионный продукт [NHJ] [NH2 = −50°C при 10 3 Аммиак превосходит другие газы по растворимости в воде: 0 ° C при 1 Большое количество воды поглотит в 1200 раз больше газа аммиака.
Мелкую Соль Аммиака в воде обусловлена возникновением межмолекулярных водородных Tie. In в этом случае возможны 2 механизма возникновения водородных связей. Между молекулой аммиака и молекулой воды: H ^ i’F ^ — H-O: и Н. Н. Н. Потому что донорская способность молекул аммиака более выражена, чем эта Вода, и связь O-H более полярна по сравнению с полярностью связи N-H
Аммиак, межмолекулярная водородная связь, образуется по первому механизму. Таким образом, физико-химический процесс в водном растворе аммиака является、 Он существует следующим образом: NH3 + H2O ¦ K = ° ’ 2 ′ NH3 H2O. K = Появление гидроксидных ионов вызывает щелочную реакцию раствора аммиака Вода. Малая константа ионизации (ПК 5) — при низкой температуре Аммиак не горит в воздухе, а окисляется в кислородной атмосфере Свободный азот: 4NH3 +ЗО2 = 2N2 + 6Н26
Аммиак действует как восстановитель, так и в реакции с другими окислителями- реже, чем при им, аммиак действует в качестве окислителя, например Na + NH3 = NaNH2 + V2H2 В этой реакции металлический натрий замещает водород из жидкого аммиака. В этом случае аммиачный водород понижает степень своего окисления и аммиак регенерирует Роль окислителей. С другой стороны, такая реакция、 Свойства аммиачной кислоты.
Амиды металлов, такие как NaNH2、 Соли аммиака, соответствующие его кислотной функции. Довольно очевидный. Что кислотная природа аммиака менее выражена, чем кислотная природа H2O и HF. Поскольку Константа ионизации кислоты пренебрежимо мала(pa’A 35), аммиачная соль Как кислота в воде полностью гидролизуется: NaNH2 + H20 = NaOH + NH3 Кислотная функция аммиака соответствует не только Амиду, но и имиду и нитриду. Metal. In Амид, 1 атом водорода (NaNH2) замещен, а в имиде-2 (Li2NH), затем нитрид-все 3(A1N).
Тщательное окисление аммиака мягкими окислителями, такими как гипохлорит Нитрат натрия, другое аммиачно-водородное соединение-гидразин или Диамид: 2NH3 + NaOcl = N2H4 + Nad + H2O Диамид-бесцветная, Летучая и токсичная жидкость、 Высокой диэлектрической проницаемостью (е = 52 при 25°С).Гидразин. Аммиак является отличным ионизирующим растворителем. Его гидразин, благодаря своим химическим свойствам, во многом напоминает ammonia.
In вода Раствор гидразина используют для АМ- Миака. Когда гидразин взаимодействует с 1 молекулой воды за счет вовлечения водорода Образуются катионы [N2H5] +и 2 — [N2H6] 2t- Оксиды катионных N2He +и N2Hs как отдельные вещества не обнаружены (Аналогично NH4OH).Это и понятно, ведь основные функции гидразина выражены Он слабее аммиака (pA’5) (pa’i 7,pA * 2 15).Однако известны 2 типа.
Соли гидразина, например N2HsCl и N2H6Cl2. При восстановлении раствора азотной кислоты, содержащего атомарный водород、 Гидроксиламина доступен: HNO3 + 6H = NH2OH + 2H2O Гидроксиламин — бесцветный кристалл (^=33°C), термически неустойчивый、 выше взрываются при 00°с водный раствор гидроксиламина больше stable. In И межмолекулярные водородные связи、
Динамическое равновесие: Четыреста один н NH2OH + H20 * =±H-N: H-b:^^ [NH3OH] + + + OH » Да. Н Однако основная функция гидроксиламина не более выражена, чем следующая (pa’J 8) Аммиак и hydrazine. In в случае кислот гидроксиламин образует гидроксиламмониевую соль. Наиболее известным препаратом является гидроксиламмоний хлорид[NH3OH] C1. Раствор соли гидроксиаммония более стабилен, чем твердый、 Гидролиз вызывает кислотную реакцию.
Потому что степень окисления атома азота гидроксиламина равна −1、 Он действует как окислитель, так и восстановитель. Но для него больше Особенно в щелочных средах характерны восстановительные свойства. Среди водородных соединений азота степень отрицательного минимума Лидия Александровна Юта представлена водородом азиатом HN3.In это соединение, степень Окисление азота-это ненормальное состояние окисления, обусловленное структурой, равной — ’ / j Неоднородный атом азота этого вещества.
С точки зрения МВС, эта структура Неравенство тура может быть представлено на схеме 120.- 0.125 Нм О. С. Шнм н 1 на 2 секунды. Главное в этой схеме-делокализация звена тг по прямой, к которой оно подключено Атом азота. Правомерность схемы доказывается расстоянием между атомами Азот 1-2 и 2-3 в середине длины связи — Н-н-и нет. = Северный Водный раствор HNg называется азотной кислотой. Она Окисление гидразина с азотистой кислотой: N2H4 +Н 2 2= HN3 +2Н2О Подходим к уксусу с force.
In разбавленный раствор азота Природные кислоты медленно становятся непропорциональными: HN3 + H2O = N2 + HX2OH В безводном состоянии, не только при нагревании、 Соударение.: 2HN3-Н2 + чистотой 3n2 Смесь азотной кислоты и концентрированной соляной кислоты Копайте также в драгоценных металлах. Соль азотной кислоты-азид- Растворимость в воде подобна Галоиду.
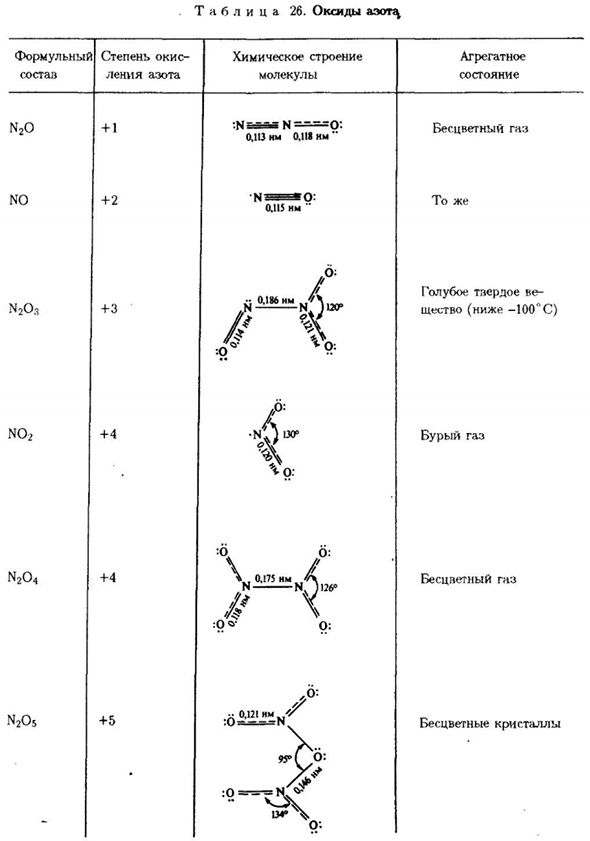
Азид щелочного металла Вода, AgN3, Pb (N3J и Hg (N3J-insufficient. It хорошо растворяется в щелочном азиде) Медленно нагревая щелочноземельные металлы、 Он тает. Азид тяжелого метала взрывается легко из-за удара. Свинец (N3J =свинец+ 3N2 Кислородные соединения nitrogen. In образуется кислород, азот Есть много оксидов.
Исходная информация о них представлена в таблице. 26. Оксид N2O (закись азота, » веселящий газ» Термическим воздействием) получают пиролизом аммиачной селитры или Нитрит гидроксиламмония: −1 + 3 +1 [1CHNZON] 1CHO2 = N2O + 2H2O (внутримолекулярная диспропорция) 1 2С-Т Оксид азота (+1) является эндотермическим соединением. Однако при комнатной температуре Химически низкая активность. При нагревании его реакционная способность Она значительно возрастет.
Водород, металл, фосфор, сера, уголь, органическое вещество、 Другие вещества, например КР + Н20 = Н2 + Сио Когда N2O нагревается выше 700°C, реакция разложения протекает одновременно Этот дисбаланс: 2N2O = 2N2 + O2; 2N2O = 2NO + N2 Оксид азота (+1) не взаимодействует, но кислота H2N2O2 взаимодействует Любой азот имеет степень окисления+1.Эта кислота называется азотной кислотой.
Статистики, и это связано со структурой с 2 эквивалентными атомами азота: Ч-О = НЕТ-Ч Свободную азотную кислоту можно получить следующим образом: H2O NH2OH Я 2е- HNO2 = H2N2O2 Он хорошо растворяется в воде, но кислота слабая(pK \ 8, и pA \ ’ 2 \ 12).Азотонова Винная кислота очень нестабильна и почти не лопается при нагревании. H2N2O2 = N2O + H2O Соль H2N2O2-гипо-и гипо-нитратов-сильное воздействие в воде Гидролиз.
- Большинство гипо-нитратов слабо растворимы в воде, намного лучше Нитраты далее растворяются. Равномерное состояние окисления характеризуется относительно небольшим содержанием азота. Внутри. К таким соединениям относится оксид азота (+2).Числитель N0 содержит нечетное число Количество электронов и, по существу, низкая активность Радикальный.1 ковалентная связь в молекуле с донором акцептором Механизм и 2 тг связывания.
Несмотря на коварство и позитив Для Гиббса Энергия образования N0 из простого вещества, оксида азота (+2) равна Он делится на elements. In факт, согласно ИМО, порядок связи в N0 является Довольно высокий, равный 2,5. Молекула N0 является более мощной, чем молекула O2.
Вой рыхлого МО х *имеет только 1 электрон, а 2-й электрон имеет 2 электрона. Людмила Фирмаль
В лабораторных условиях оксид азота (+2) чаще всего получают под действием разбавленного раствора. Азотной кислоты на медные стружки: 3Cu + 8HNO3 (pas6.)= 3Cu (NO3J + 2NO + 4H2O На воздухе оксид азота (+2) мгновенно окисляется: 2NO + O2 = 2NO2(AG; 98 = −113,4 кДж / моль) Он окисляется N0 и галогенами с образованием галогенидов nitrosyl. 2N0 + G2 = 2N0r
При взаимодействии с восстановителем N0 уменьшается до N20, N2) NH2OH, NH3, в зависимости от редуцирующей способности и условий партнера Осуществление этого процесса. Водный раствор ококда / чжк’в — Д 2} * жжсраявн. — Что?- спросил он. саздагишг — & Эдо&ор Известна соль (ипохондрический нитрат), которая не образуется, но и не отделяется в свободном состоянии Оттаивание азотной кислоты H2N2O3 со степенью окисления азота Ния+2.
Оксид азота N2O3 существует в твердом состоянии (ниже −100°C). в жидкости Состояние парообразования оксид азота (+3)в основном диссоциирован Взрыв из-за дисбаланса: N2O3 ^ NO + N02(AA; 98 = −41,2 кДж / моль) N2O3 получают охлаждением эквимолярных величин N0 и N02.Форма Действующая смесь заданного состава получается взаимодействием 50% азота.
Кислота с оксидом мышьяка (+3): 2HNO3 + As2O3 = 2HAsO3 + NO + N02 Оксид азота (+3) соответствует нестабильному азоту Плавление кислоты HNO2.Равные количества N0 и N02 Вода: N0 + N02 + H20 = 2HNO2 При хранении и нагревании HNO2 становится несбалансированным. 3HNO2 = HNO3 + 2N0 + H20 Наиболее характерны окислительные свойства: 2HNO2 + 2HI = 12 + 2N0 + 2H2O
Однако сильные окислители превращают закись азота в азотную кислоту. 5HNO2 + 2KMnO4 + 3H2SO4 = K2SO4 + 2MnSO4 + 5HNO3 + 3H2O Известны 2 таутомерные структуры азотистой кислоты. * 0,117 Нм » Четыреста пять Соль нитрита-нитрит-получают из обеих форм. Нитрит Активный металл генетически связан с исходной структурой (кислотно-опосредованное связывание От 2-го, а именно прямого металла Связан с азотом.
Азотистая кислота представляет собой амфотерный электролит с более выраженной кислотой Функция (pa’A 4).Существует равновесие в водном растворе: Нет + 4-О — ^ = * hno2 с ^ ЛФ с n02 Ионы N0 + — нитрозил или нитрозоний — это молекулы азота и электроны、 Чай стойкий. Производные азотистой кислоты, соответствующие ее основной функции Те, которые содержат группу[N0] +, называются нитрозилом compounds.
So … Сульфат Nitrosyl NOHSO4 является важным промежуточным Получение серной кислоты сернистым способом. Оксид азота (+4) получают путем растворения меди в концентрированном азоте Кислота: Cu + 4HNO3 = Cu (NO3J + 2NO2-f 2H2O Это хороший окислитель; фосфор, сера, уголь и некоторые Органическое вещество. Диоксид азота начинает разлагаться, когда он превышает 150°C: 2NO2 = 2N0 + O2.
Молекулы диоксида азота с неспаренным электроном по существу Это радикально и легко быть затемненным: 2NO2 Н2О 2O4 = −58 кДж) Димер бесцветный и диамагнитный, в отличие от красно-коричневого、 Парамагнитный NO2 Диоксид азота непропорционально реагирует с водой: 2NO2 + H2O = HNO3 4-HNO2 Если NO2 растворить в горячей воде, то получается азотная кислота.
Первая образовавшаяся азотистая кислота диспропорционирует с выделением Образование оксида азота (+2) и HNO3. Оксид азота (+5) имеет молекулярную структуру только в Газе phase. In Твердое вещество N2O имеет структуру, образованную ионами NO2 и NO3. Н2О — Кристаллы, которые легко сублимировать, и молекулы evaporate. It-это не так.
Таким образом, при сублимации оксида азота (+5) ионы NO2 и NO3 связываются с молекулой N2O5-получают оксид азота (+5) дегидратацией азотной кислоты Р2О5 или окислением NО2 озоном: 2HNO3 + P2O5 = 2HPO3 + N2O5; 6NO2 + O3 = 3N2OS Оксид азота (+5) является активным окислителем, и многие реакции участвуют Тиум протекает очень быстро. При растворении в воде получается азотная кислота : N2O5 + H2O = 2HNO3 406.
Азотная кислота является одной из самых сильных кислот. Молекула HNO3 и нитрат-Ион Со структурой представленной на рисунке Н. Ноль: » 120° О Компании: J Безводная азотная кислота представляет собой бесцветную летучую жидкость. При хранении (особенно при освещении) и нагревании он частично разлагается. 4HNO3 = 4NO2 + 2H2O-f O2 Так называемая «дымящаяся» азотная кислота (Красная) Раствор двуокиси азота в концентрированной Хое.
В лаборатории азотную кислоту и азотную кислоту нагревают до получения HNO3. Много.: NaNO3 + H2SO4 = HNO3 + N. 1HSO4 В промышленности азотную кислоту получают из аммиака. Сначала аммиак Катализируется и далее окисляется до оксида азота (+2) NO2.Затем оксид азота (+4) растворяется в горячей воде и превращается в оксид азота Кислота.
Азотная кислота является сильным окислителем и окисляет почти все металлы ли и неметалл. Последние, как правило, конвертируются в высшие производные Состояние окисления, например S + 6HNO3 = H2SO4 + 6NO2 + 2H2O Металлов, золота, платины, осмия, иридия, ниобия, тантала, вольфрама только Он устойчив к воздействию азотной кислоты.
Некоторые металлы(например, Fe, A1、 Кг)пассивируется концентрированной азотной кислотой. Окислительный Раствор азотной кислоты также имеет характеристики. Обычно процесс уменьшения HNO3 Некоторые параллельные направления, и результат Это позволит вам смешивать самые разные продукты. Обновление.
Природа этих продуктов, их относительная Содержание смеси зависит от прочности восстановителя и、 Концентрация и температура азотной кислоты. Фигура 149 показывает относительное содержание продукта Восстановление азотной кислоты железом, зависимое В зависимости от его концентрации.
Более разбавленная кислота Следует отметить, что в смеси продукты более глубокие Восстановление, например, NH3 с использованием азота Кислота дает соль NH4NO3.In разбавленный раствор Концентрация нитрат-ионов низкая, соответственно Атом азота получает больше электронов от D-5) Есть восстановитель, а значит и более глубокое восстановление.
Сосредоточить. В Каждая молекула HNO3 получает меньше электронов от восстановителя. Поэтому основные продукты восстановления концентрированных растворов Азотная кислота — это N0 и NO2. Сильный окислитель представляет собой смесь концентрированной азотной кислоты и концентрированной азотной кислоты Соляная кислота — «королевская водка».Золото и платина растворяются.
Он не растворяется в азотной кислоте, а также в соляной кислоте. Его окисление Активность обусловлена снижением окислительно-восстановительного потенциала растворимых веществ Металл, а именно через образование для повышения восстановительных свойств Сильные хлоридные комплексы (см. реакции растворения золота в королевской семье И водка. 314).
Соль азотной кислоты-нитрат-известна практически для всех металлов. Боль Большинство из них бесцветны и хорошо растворимы в воде. В кислой воде Нитрат является более слабым окислителем, чем азотная кислота、 Также, в нейтральной окружающей среде, совершенно никакие окисляя свойства. Сильный Они растворимы, когда они растворяются с помощью Генерация кислорода.
При взаимодействии с оксидом азота (+5) 100% Перекись водорода образует пероксо-азотную кислоту (нано-азотную кислоту): N2O5 + 2H2O2 = 2HNO4 + H20 Пероксо-азотная кислота нестабильна, легко взрывается и полностью гидролизуется в воде Это: Ч-О-О-Н H20 = H2O2 + HNO3 Соединения с другими неметаллами. Все ореолы известны Азотный ген NT3. Трифторид NF3(ДЯ ^ 298 = −117,2 кДж / моль)、
Под действием аммиака и фтора: 3F2 + 4NH3 = 3NH4F + NF3 Трифторид азота представляет собой бесцветный токсичный газ, который имеет молекулу Пирамидальная структура. На дне пирамиды есть атом фтора、 А пик занят атомом азота с единственной парой электронов. Разнообразие Химический и термальный NF3 очень стабилизирован.
Оставшийся трехгалогенированный азот является эндотермическим, поэтому он нестабилен и реакционноспособен. Это возможно. NC13 образуется при пропускании газообразного хлора через креп Раствор хлористого аммония: ZC12 + NH4C1 = 4HC1 + NC13 Трихлорид азота летуч. (Wi = 71°С) жидкость Резкий запах. Незначительное нагревание или удар сопровождаются взрывом- Очень много heat.
In в этом случае NCI3 делится на элементы. Три-галогениды NBr3 и NI3 еще более нестабильны. 408. Производные азота, в том числе халькоген, очень нестабильны из-за сильных Эндотермический. Все они плохо изучены и взрываются при нагревании или ударе. И в компаунде. Металл. Нитриды, такие как соль Прямой синтез из металла и азота.
Вода и разбавленная кислота Форма нитрида разлагается: Mg3N2 + 6H2O = 3Mg (OHJ + 2NH3 Ca3N2 +8НС1 = зсас12+ 2nh4c1 Обе реакции демонстрируют основные свойства активного нитрида металла. Нитриды, такие как металлы, получают нагреванием металла в атмосфере азота. Или ammonia. As исходный материал, оксиды, галогены Матрицы и гидриды переходных металлов: 2Ta + N2 = 2TaN; Mn2O3 + 2NH3 = 2MnN +ЗН2О CrCl3 + NH3 = CrN + 3HCl; 2TiH2 + 2NH3 = 2TiN + 5H2 Ковалентные нитриды в основном образуют группу III metals.
In группа Py аналогового элемента при переходе к доминирующему тяжелому металлу Ковалентные типы связей все чаще перекрываются металлами. Общение. Поэтому в сериях A1N, GaN и InN металлизация связей увеличивается. Вызвано уменьшением запрещенной зоны и увеличением электроэнергии Проводимость.
Смотрите также:
| Подгруппа германия | Фосфор |
| Подгруппа титана | Подгруппа мышьяка |
Если вам потребуется заказать решение по химии вы всегда можете написать мне в whatsapp.
