Оглавление:




























Бор
- Бор.1. этот элемент является одним из самых распространенных. Содержание в земной коре составляет около 5-10-4%.Накопление Бора происходит в виде соединений кислорода. Борная кислота (H3BO3), бура (Na2B407•UN20), ашарит (MgHB03) и ряд более сложных минералов. Мировое годовое производство соединений бора достигает сотен тысяч тонн.
- От В свободном состоянии бор получают из борной кислоты acid. Реакция протекает по формуле B203 + 3Mg = 3MgO + 2B-f 127 ккал После обработки продукта реакции соляной кислотой (для удаления MgO) элементарный бор остается в виде темно-коричневого порошка. Очень чистый бор бесцветен. Плотность составляет 2,3 г / СМГ, он плавится при 2075 и кипит при 3700°С.
By нагреваясь, он переносится в кимоно борной кислоты (B203), а затем нагревается с металлическим магнием. Людмила Фирмаль
В нормальных условиях бор очень инертен и взаимодействует только с фтором. Напротив, при высоких температурах он соединяется не только с кислородом, хлором и бромом, но и с серой, азотом и углеродом. Благодаря очень сильному раскалению бор замещает соответствующие свободные элементы даже из стабильных оксидов, таких как P2O. CO? И Сиоа, а также от оксидов многих metals. As в результате слияния бора с некоторыми металлами они образуют бориды, например MgB2.
По отношению к воздуху и воде бор очень стабилен. Взаимодействие с водяным паром по схеме ZN; 0 + 2V = V; 03 + ZN2 + 131 ккал Идите только на раскаленное temperatures. In кислоты, которые не являются окислителями, бор не растворяет. Концентрированный HN03 постепенно окисляется до борной кислоты. B + знание 3 n3vo3 + 3N02 По отношению к обычно используемым растворам щелочной бор стабилен.
Его соединения обычно трехвалентны. Кислородные соединения наиболее характерны для Бора. При нагревании до 700 ° С на воздухе образуется борный ангидрид по схеме, который горит красноватым пламенем: 4Б + 302-2Bj03 На практике B203 более удобно получать путем обжига h3b03.Борная кислота представляет собой бесцветную стекловидную массу.
В воздухе, B203 притягивает влагу и образует борную кислоту по схеме, которая растворяется в воде. B203 + ZN20 = 2N3V03 Борная кислота (точнее, ротобалевая кислота) представляет собой бесцветный кристалл, относительно нерастворимый в воде. При нагревании он теряет влагу, сначала проходит через метахорическую кислоту (HB02), а затем переходит в борную кислоту. Растворение этих веществ в воде сопровождается обращением к H3B03. Диссоциация гидроксида B (OH) 3 является кислой.
Но борная кислота очень слаба, поэтому большинство других кислот легко высвобождаются из раствора ее солей. Его Соль (борная кислота или Борат) обычно получают из различных полифоновых кислот общей формулы 1B203•mH20.In в большинстве случаев это тетрагорм (n = 2, m = 1).Последняя является значительно более сильной кислотой, чем ортофорическая кислота. Соль Н2В; 07 образуется путем нейтрализации Н30303 щелочью, например по схеме 2NaOH + 4H3BOj = Na2B407 + 7H20
Если он превышает щелочь, он преобразуется в 2MaOH + 1 ^ a2B407 = 4NaB02 +Н20. С другой стороны, когда сильная кислота действует на тетраборат (или его метаболиты), высвобождается свободная ортоборовая кислота. Na2B407 + H2S04 + 5H20-Na2S04 + 4H3B03 В воде из боратов присутствуют только соли наиболее активных одновалентных металлов dissolved.
By при гидролизе их раствор проявляет сильную щелочную реакцию. Наиболее важным Боратом для практики является натриевая соль тетрабората-бура. Na2B407 * un20 отделяется от раствора в виде бесцветных по составу кристаллов, выветривается на воздухе и при нормальных условиях слабо растворим в воде. Борный ангидрид очень устойчив к нагреванию, поэтому при высоких температурах борная кислота высвобождает большинство других кислот из своего состава. salts.
In в этом отношении (и его слабых местах) он похож на кремниевую кислоту. , * — Звук Галогенированное соединение бора общей формулы VG3 получают взаимодействием элементов при нагревании. Они представляют собой бесцветное вещество, которое всасывает влажный воздух. Фторид (BF3) и хлорид (BC1«) — это газы в нормальных условиях, BBg3-это жидкость, а B13 — это solid.
By вода, борная железа (кроме BF3) будет растворена по схеме VG3 + ZN20 = B (OHb + ZNG Не похож на их двойников, BF3 не метаболизирует значительно. 57 -*! Для галогенированного Бора очень характерна реакция адгезии молекул различных других веществ, особенно многих органических соединений, к ним.
Наиболее важным из этих производных является продукт с добавлением HF к BF3, фторборат H [6F4]. сам по себе он стабилен только в растворе, его кислотные свойства гораздо более выражены, чем в HF. Большинство солей HBF4 (фторборат) бесцветны и очень растворимы в воде. 6 *-71 Бор действительно не соединяется с водородом, но под действием кислоты на сплав бор-магний, помимо свободного водорода, выделяется небольшое количество различных смесей бор-водород (иначе не Бор), в которых предпочтительна соответствующая формула B4H, 0.
Последний легко распадается на B2H *и многие другие боры, которым не хватает водорода. Самый простой Бора бесцветен и очень toxic. In физические свойства, они подобны к углеродам и имеют подобное composition. As можно видеть из сравнения следующих точек плавления и кипения(°C): С, ч, б, ч, Си | ч | * ч «ч | 0 в» Ню сл » Ио −172 −165-132 точка плавления-138 −120 −84 −88 −93 −14 температура кипения 0 +16 +107 Химия простейших Боранов аналогична силанам. Как и последний (в еще большем объеме), он нестабилен при нормальных условиях conditions.
In в частности, Бораны постепенно разрушаются при выделении водорода в результате реакции, как показано ниже: B2Nv + 6N20-6N2 + 2N3VO、Кроме того, смешанный газ, полученный при разложении бор-магниевого сплава кислотами на воздухе, будет самопроизвольно воспламеняться. Сгорание Борунов сопровождается выделением большого количества тепла(например, 485 ккал!
Моль B2H6 против 341 ккал / моль QH6), может эффективно использоваться в качестве реактивного топлива 72. Среди производных диборона (B2Hb) наиболее важными являются фторхолаты, структура которых аналогична соли типа M | VI4 (борид, другие соединения или бораты).примером является abh4, бесцветный кристалл, который стабилен в нормальных условиях и легко растворим в воде. [VNL «водород анионов отрицателен и играет роль атома галогена.
Все бораты являются мощными восстановителями. Добавь 1) бра был известен алхимикам тем, кто также упоминается в трудах Гебеля. Бор был впервые приобретен в 1808 году. Природный элемент состоит из 2 изотопов, относительное содержание которых изменяется незначительно: 0B (19,6-19,8%) и B(60,4-80,2%). ±0,003.Есть монография о Боре. 2) в основном состоянии атом Бора имеет внешнюю электронную оболочку 2 $ 22p и является одновалентным. Возбуждение до трехвалентного состояния (2s2 / P) требует затрат 82 ккал / г атомов.
Энергия непрерывной ионизации атома Бора составляет 8.30. 25.15 и 37.92 эВ, а его сродство к электронам оценивается в 8 ккал / г атомов. 3) небольшое количество бора входит в состав сухой воды нефтяных месторождений и золы многих видов ископаемого топлива. Наземные растения содержат 0,0001-0,01% бора по массе от сухого вещества (кроме того, их меньше в злаках и больше в корнеплодах).
Животные организмы гораздо меньше Бора. Введение соединений бора в почву часто значительно повышает урожайность культурных растений (в частности, льна и свеклы).Особенно сильно это влияние Бора сказывается на подзолистых почвах. 4) при восстановлении всех водородом при 1200 ° С был получен очень чистый (99,999%) элементарный Бор. obtained. It также получают термическим разложением паров ВВГЭ на танталовой линии, нагретой до 1Г>00вх током.
Полученные кристаллы Бора очень малой твердости несколько уступают алмазу. Они известны 4 различными кристаллическими формами (со сложной внутренней структурой), имеют металлический блеск и в нормальных условиях очень плохо проводят электрический ток. При нагревании до 800 ° С проводимость увеличивается примерно в 100 миллионов раз(электронные свойства низкотемпературной проводимости изменяются при высоких температурах Холла).
Теплота плавления Бора оценивается в 5,4, теплота испарения-в 129, а теплота ацини (25°С) — в 134 ккал / г atoms. In помимо отдельных атомов, пара Бора частично содержит молекулы в *, энергия их диссоциации оценивается в 66 ккал! Это крот. 5) путем термического разложения при 900°C BIj, тот же цвет Бора был obtained. It красный (возможно, из-за следа режима) и имеет более простую структуру кристаллической решетки.
Если она превысит 1500°C, то будет находиться в своей нормальной форме. в) атомный радиус Бора равен 0,97, а радиус ионов B * оценивается в 0,20 А. нормальный потенциал перехода-0,87 (кислотная среда) и-1,79 вольт (щелочная среда) соответствует переходу B * * * * f. 7) химическая активность Бора сильно зависит от степени его fragmentation. In в чистом кристаллическом состоянии он гораздо более инертен, чем в мелкодисперсном состоянии. Cihconoi В. MipnoiCKiift Л. Я. Жиги А. Ф. В а л ш ш о М. г. Бор, его связь с солавой) Кит».И>q во всем Советском Союзе, 1 <Y0.
До Фрагментация («аморфность»).Например, кристаллический бор устойчив к сильнощелочному раствору даже при кипячении, но аморфный бор реагирует медленно (по схеме АПМА).2B+ 2NaOH + 2HjO = » 2NaBOj-f 3Hj).Даже расплавленная щелочь будет более или менее быстро взаимодействовать с кристаллическим бором только в присутствии окислителей. 8) некоторые небориды по своему составу, такие как нитриды, карбиды и силициды, формально соответствуют валентностям, известным по соответствующим элементам.
Такие, например. МПВ. МПВ». Крб. Крб2. MoB * WBj. ГЛ.. TIB. In в других случаях этого нет observed. An примером может служить доска общей формулы EV. Где E-Mg, V, Nb, Ta, Ti, Zr, Hf. As как правило, бораты образуются из элементов, выделяющих тепло (например, ZrBj с длиной 77 ккал / моль), обладают высокой твердостью и хорошей проводимостью. Многие из них имеют очень высокую температуру плавления.
Например, для ZrBa и HfB2 они находятся на 3040 и 3250 * C соответственно. Цирконий болдес металлокерамика, содержащая хром (как пучок металла), используется в ракетах. Устойчивость большинства боратов к кислотам очень высока. Для типа EVA он увеличивается с серией MgB,<VBi <CrBj <ZrB} <TiB,<NBBJ <TaB. In кроме того, Мгбж разлагается не только кислотой, но и водой, и он не действует на табу даже в кипяченой воде (Мп.3200°с).Есть обзорная статья о правлении 9.
An интересным смешанным производным является оксобон-Онбб пентобарбитала. 9) теплота образования кристаллической формы B2O1 из элементов составляет 305.А обычная стеклянная форма составляет 300 ккал / моль. Последний обладает высокой твердостью и уже начинает размягчаться при температуре более 200°с, четкой точки плавления нет. Кристаллическая форма плавится при 450 (5,9 ккал / моль теплоты плавления) и кипит при 2200°С. пар борного ангидрида состоит из термически стабильных молекул B-0.
Структура представлена формулой O-B-O-B-O, имеющей плоскую угловую структуру и следующие параметры:< * (B-O)= » 1.20. Д (Б — О) −1.36 А / БОБ-95 *. Энергии связи B —O и B ^ — 0 оцениваются как 123 и 207 ккал / моль соответственно. 10) плавление B » Oj при высокой температуре хорошо растворяет оксиды многих элементов. BeO (0,2 мас.(% ), TIOj(0,6), SnOj(0,8), AljOj (1) являются самыми трудными для расплавления.
11) когда смесь BaOe и элементарного Бора нагревается выше 1000°C, в паре доминирует термически устойчивая линейная молекула OB-B = 0.Прочность их B-B связей превышает 100 ккал / моль, а диссоциация по схеме BaO-2BO практически не наблюдается. Охлаждение паром сопровождается диспропорционированием оксида бора по схеме 3BjOj = » 2BaOj + 2B, в результате чего образуется коричневая смесь обоих продуктов распада.
Однако, если вы «заморозите» систему, быстро охлаждая ее до температуры менее 300 X, вы получите белый твердый полимер (BfO).Никакой специфической точки плавления, она рентгеновский снимок аморфный, она сильно реактивна, и нагретый над 300°C, она изменяет согласно вышеуказанной формуле. 12) при давлении около 6 млн бар, при температуре порядка 1500 * С, взаимодействие Броа и элементарного Бора протекает по схеме B «Oj■*4B =» 3B * 0.Этот нижний оксид Бора имеет слоистый захват structure.
It сообщалось также о получении оксидов состава B0 и WO. 13) пространственная структура BO-ионов соответствует плоскому равностороннему треугольнику (</(BO) −1.36 AJ. Кроме того, плоскость образована в виде правильного шестиугольника (рисунок XM), расстояние между ними составляет 3,18 А. Поскольку эти плоскости слабо связаны друг с другом (из-за межмолекулярных сил), кристаллы легко расщепляются и разделяют слои. * Самсонова, А. В. Mipioicul Л, Я. Консультирует по химии. IH6, м2, 190、14) борная кислота (ICi■■6 * 10°| 9a / C «■5-10» 1, / C>-«4-10’i) окрашивает пламя характерным зеленым цветом (по-видимому, из-за электронов) перехода BaOa molecule. It несколько испаряется с водяным паром и содержится в воде некоторых горячих источников.
Ее насыщенный водный раствор содержит около 4,5%HjBOj в нормальных условиях и при 100°С она составляет примерно 28%.В водном растворе молекула борной кислоты на 1 молекул воды и полиомиелита-акцепторных сформированное скрепление, основной диссоциации по схеме: прогресс: Н2ОВ(ОН)Н-4-(В(ОН)4У Это особенно подтверждается рентгенологическим анализом состава солей NaBOj-4HfO.
Установлено, что его структура соответствует формуле Na [B (OH)]-2HtO (d (BO) −1.48 A) с тетраэдрической средой атомов бора с гидроксильной группой. Энергия связи B-O четырехкоординатного Бора оценивается в 96 ккал / моль. 15) кроме воды, борная кислота очень растворима в спирте (90 г / л), не очень растворима в ацетоне (5 г / л) и почти нерастворима в эфире(0,08 г / л).
Взаимодействие с глицерином усиливает кислотные свойства HjBOi. It также увеличивается по мере увеличения концентрации самой кислоты. Именно поэтому при изменении от 0,03 м до 0,75 м водного раствора рН изменяется от 6,3 до 3,7.Это, по-видимому, связано с частичным образованием полиборной кислоты (возможно, трехгексоборной).
16) борная кислота используется непосредственно при обработке эмали железных емкостей (добавляется в эмаль) и лекарств (в качестве дезинфицирующего средства), а также служит общим исходным материалом для получения других соединений бора. Эта кислота является отличным антисептиком и консервантом, но ее использование в пищевой промышленности недопустимо, так как она вызывает несварение желудка.
17) переход от H » BOA к HB02 начинается примерно при 100°C. Метаголовая кислота известна своей температурой плавления 176, 201 и 236°C в 3 различных кристаллических формах. Электронное сродство радикалов BO * оценивается в 94 ккал / моль. 18) при взаимодействии спирта с борной кислотой в присутствии концентрированной H2SO4 <(связывается с водой) легко происходит образование эфира по схеме.
Пример: 3CH_OH + HjBO 3HjO + B (OCHa).Полученные пары метилового эфира Бора (Мп 29, Мп 69 * С) при воспламенении горят в бледно-зеленом пламени и используются в качестве качественной реакции боратов. Количественное высвобождение борной кислоты (одновременное превращение Бората в сульфат) основано на том же принципе. 19) щелочной металл-LiB02 (Мп.833 * с), Набоа (Мп.96G) и KBO2 (mp.947) — очень тепловая Р-С. X1-2.It огнеупорна, и когда нагретый достаточно, она испаряется без обрыва. мин » ° * * Женя.
Для пары молекул LiBOj и NaBOa (они моно- Определены следующие структурные параметры: d (LiO) −1.82, rf (NaO)-2.14, d (B-O) −1.36, d(B-O)-1.20 A, ZMOB-100 E. In кроме того, Анон B, Oj имеет плоскую кольцевую структуру 1,40 N, внешнюю 1,32 A внутри d (BO), как показано на рисунке XI-2.Pr. той же тройной координации атомов бора, кристаллических Ca (box) полимерных цепных ионов (рисунок XI-3) M +или Ca * +катионы расположены в пустотах кристаллической решетки Pb(BOj) j (т. е. ill. Рисунок XI-I схема * структура слоя * кристаллы Хабоя.
686X).Эта нерастворимая в воде негигроскопичная соль используется при изготовлении защитных экранов для ядерных реакторов. Метаболиты, выделенные из раствора, обычно содержат кристаллические water. Perhaps. In на самом деле, это кислый орсоборамин. Особенно если Ca (BO]) 3 2H » 0.Выражение Ca (HsBO>) a-очевидно более точное
20) неизвестная тетрабороновая кислота (L ’ / −2 «10»*, / Ca 2-10-5) в свободном состоянии может иметь следующую структурную формулу: О, да. но-в ^ ^ В-О-В^») В-О О О Помимо обычной буры, ее натриевая соль также характеризуется кристаллогидратом Na, B «или-5HjO («ювелирная бура»).Насыщенный водный раствор буры содержит приблизительно 9,5%тетрабората натрия при нормальных условиях(рН = » 9,3), а при 100°С он содержит около 33%.
Бура также растворяется в спирте и глицерине.(Член парламента.741°С) может быть получена нагреванием буры до 400°С или более(но первой образующейся аморфной фазой является vJ \ J PR 675 * C) только кристаллизуется. _ с.’. Уик. XI 3.Цепная структура(АО).」 Бура потребляется многими различными продуктами — ^ ’ l водств (стекло, керамика, кожа v Он также является медицинским (в качестве дезинфицирующего средства) и входит в состав некоторых стиральных порошков.
21) из солей различных полиборовых кислот многие существуют в природе и служат исходным сырьем для получения соединений бора. Таков, например, нерв ТКТ гидробор-Камбку-6HjO. Получают из гексагидрофтористоводородной кислоты (n * 3, m-2).Некоторые производные его гетерокомплексной кислоты, например H ^ B (W2Oj) i], наряду с полной кислотой салями, которая является изотопным узлом Бора, также известны.
Последнее соответствует неизвестному Гидрату H9BO (то есть BjO,-9HjO) в свободном состоянии. 22) превращение солей других кислот в бораты путем легирования избытком H / BOe происходит при различных температурах. Например, КНО расположен в 500, примесями КС1 составляет 800,и Касо является 1000X. При сплавлении соли или оксида металла-коричневый, например, по схеме: Наиб » или-fCoO-2NaBO> — Ф со (бя) Дж.
В бораты некоторых металлов характерно окрашены, поэтому решение в расплавленном форм шторма цветного стекла (например, больше, чем кобальт или зеленый, чем в Chromium).Это иногда используется в аналитической химии для обнаружения таких металлов. Обычно реакция протекает в ухе платиновой проволоки, и получается капля цветного борного стекла («бура жемчуга»). 23) в дополнение к буре и борной кислоте, Соль-о-о выбранной кислоты (перборат), образованная заменой атома перекиси кислорода на Борат-о-также имеет практическое значение.
Свободная борная кислота не отделяется, она присутствует в растворе. На это указывает значительное повышение кислотности раствора H B BO»при добавлении HjOi к nnm (в случае Ki приведено значение 2-10 —). Наиболее часто встречающаяся перборатная соль состава NaBO-4HaO получается при действии NaOa на раствор метабората натрия, бесцветные кристаллы которого относительно слабо растворяются в воде (около 25 г / л при нормальных условиях).
По данным рентгеноструктурного анализа структура этой соли соответствует формуле Na3 ((H0)} B (0|) tB (0H) a] −6Hs0.То есть, производное истинной борной кислоты addition. It не является кислым и не выделяет раствор KI (добавлено IX / 5.51).Исходя из этого, он обычно интерпретировался Метагидрат натрия, содержащий перекись водорода, т. е. Наборхто, кристаллизуется-3HaO. Очевидно, схема NaJ (HO) aB (Oj)jB(OH) il 4- + 4HjO * * 2Na [(HO)jBOj)+4Н20″ » 2Na [B (OH) J + 2HjOa. В чем причина недостатка йода? При дегидратации тригидрата получают NaBOi-HjOj-2HjO и NaBOj H7O1.
Они в основном используются для отбеливания различных материалов и часто вводятся в состав стирального порошка. 24) композиция lib0 бесцветная кристаллическая соль » H, 0 может быть выделена (путем дегидратации PjO при пониженном давлении) из раствора соответствующей метагольной соли 30% NJ.«EV04 -’ / aH, 0 (E — Rb, Cs) и KBOs-HjO. Эти соединения, очевидно, являются истинными перворатаминами.
Причем последняя из них производится из ортокислоты(то есть соответствует формуле KHjBO).Также были получены безводный перборат калия и Квоа аммония. Кво», NH » BO, n NH4BOj NH4B04. 25) основные свойства B (OH)не характерны, но известны некоторые солеподобные соединения бора. Его фосфорные производные получают в виде белого порошка взаимодействием раствора B (OH) и NRO в концентрированном снеку. Эта соль имеет состав (BO) PO и образуется не из ионов B*, а из одновалентных борильных радикалов-подобных BO \titanil, цирконию и др. 。
Термически он очень стабилен (около 1500°C сублимируется без разложения), но полностью гидролизуется водой. Мышьяк известен фосфатами, сходными по свойствам с бором — (БО) Асоем. В природе представители этого типа соединений, очевидно, минералов datris-Ка, (БО), (Сио), (ну и т. д.).С реакциями BCI,+ 3CINO, — ЗС1, + 2no + (bo) no был получен Борил азотной кислоты, который был стабилен только при низких температурах.
26) самой длинной известной солью Бора, непосредственно трехвалентной, является его Ацето а т-в (CH * COO). (Мп 149 * с).Из него получают комплекс M1B (CH, COO) 4] (M_Cs, Rb, K, Tl). При взаимодействии БКИ и ангидрида НСО был получен» белый кристаллический хлорный кислый Бор-в (CU*)».Сама соль стабильна только при температуре ниже −5°C и может быть стабилизирована добавлением триметолинкии.
Слегка стабилизированный хлор хлорсодержащие и гидрохлорид смешанные соли-ВС1(СУ4) и вс1 (су»), как правило, самостоятельно разлагаться ВС1$я б (ГИС) И. Трехвалентный нитрат Бора известен как комплексная соль тетраметиламмония — (N (CH|) 4HB(NOj))).Это белое твердое тело называется IN (CH|) J (BC!]Он был получен взаимодействием] и NjO-78 * C, но без влаги он был стабильным даже при комнатной температуре. Бор-B (HSO -) — бисульфат образуется при взаимодействии B (OH) и серного ангидрида.
Более удобно получить его в реакциях, таких как BCI,+ 3H, SO «〜3HCIf-f-fB (HSO»).Бисульфат Бора представляет собой гигроскопичный белый порошок, который при 240 * С еще не расплавился. Используя безводный сайту htso * ОИ, композитная кислота Ч(Б (HS04) И. Она будет сформирована. Она также была выделена в твердом состоянии. Также были получены некоторые соли этой кислоты (с Na, K, Nha, Sr).Солнечная кислота H [S] представлена гораздо шире. Б(так » HL известен для многих 1-валентных и 2-валентных металлов.
Они образуются при взаимодействии H, BO и безводного H, поэтому соответствующий сульфат.」 27) прямой нагрев Бора свыше 600 * С в парах серы приводит к образованию бесцветного сульфида Бора(B, S.): 2B + 3S B, S, — f 60 ккал. Более удобный способ получения испускает аморфного бора в потоке высушенного ч, с, серы, бора, который может быть перекристаллизован из раствора РС1, и в потоке сек, сек, он получен в виде белых игл, которые легко возгоняется при 310 * З. Н. С-Б-С-Б «- с молекулой, РФ (Б»)^ 1.65,<Ф(Б-С)=» Л.8и А. ZBSB-96е.
В галлий бора и аммиака, Бора, сульфид образует кристаллический вспомогательное оборудование(особенно желтый В2С, −6nhj), и в воде、Борная кислота и медленно до HjS. Желтый B2S, другой сульфид Бора, указан (но не уверен в его индивидуальных свойствах).Также были получены желтые сульфиды, подобные желтой сере и роболу, b2ses.
28) путем сплавления B2Sj с фосфором и серой были получены кристаллические вещества с составом BPS(2 бесцветных и коричневых варианта).Это, по-видимому, можно считать серным аналогом фосфата Бора. За счет действия сероводорода на Ббрж было получено серное производное бора в виде белой иглы, что и явилось причиной изменения состава метаболита.
Кристалл этого соединения представляет собой трехмерную молекулу(Hps2h. It образуется циклическими структурами (как BSH, так и S-атомами).Отрежьте его даже при комнатной температуре, немедленно промойте водой и растворите в бензоле. Белые кристаллы аборитов, соответствующие этой кислоте-Набсж(Мп.580°C) и КБС»(Мп.550 х) — волна, которая быстро застывает в воздухе.
Известны также Tnepoborates-желтый MBSj и бледно-желтый M2B? С $(где — — — на. К). 29) бор связывается с азотом только при 1200 х и более. Нитрид бора (BN) — это раскаленный бор (nln B.) В атмосфере аммиака. Также получается O0.Образуется с элементом, который излучает тепло (60 ккал / моль) и является одинаково белым) плотность частиц этого порошка составляет 2,3 г / см2, а его смазывающая способность лучше, чем у N-графита и MoSj. In в сжатом состоянии нитрид бора обладает полупроводниковыми свойствами (запрещенная ширина).
Зона около 3,7 9С), а наличие мелких примесей C n BjOj сильно фосфоресцирует после предварительного освещения. Если она превышает 1000X, то начинает разлагаться на элементы (pr 1200°C, давление азота 0,3 мм рт. ст.).Существуют специальные монографии по химии соединений борной кислоты. 30) в нормальных условиях нитрид бора химически инертен-не содержит хлора, кислот, щелочей и не вступает в реакцию с кислородом.
Однако при токе фтора он самовоспламеняется и выгорает по формуле 2BN-f 3Fj•= 2BFj+. — Ф Нью-Джерси. Плавиковая кислота разлагает его с образованием NH «BF».Под воздействием горячего раствора щелочи (или раскаленного водяного пара) БН разлагается с выделением аммиака. Кислород и хлор начинают действовать только при температуре 700°С и выше.
31) в кристаллической структуре нормальная форма BN подобна графиту (d (BN) x 1.45 A], но шестиугольники расположены точно вверх и вниз, чередуя n с атомами B в соседних слоях, и их расстояние составляет 3.33 A(В отличие от рисунка X1-4) отдельные кристаллы BN прозрачны. Имеются противоречивые данные о возможности образования интерстициальных продуктов (подобных производным графита), но явно присутствует аддукт щелочного металла.
Также получают смешанный нитрид бора-Li) BN2. Н ЕА(ВМ2) 2.Вот, е-са. Ничего себе они разлагаются водой. 32) при температурах выше 1350X и давлениях выше 62,000 нормальная графеноподобная структура BN изменяется на алмазоподобную (рисунок X 6). Половина атомов С являются B. It смешивается с атомом, а другая половина смешивается с атомом N расстояния d (BN)= » 1.57 A. щелочные и щелочноземельные металлы являются подходящими катализаторами для этого transformation.
As в случае графита переход алмаза сопровождается резким изменением свойств нитрида бора. 33) алмазоподобная форма этого вещества — «зона бора»или» Эльбер » обычно получается в виде мелких кристаллов разного цвета (от темного до бесцветного).Боразоны имеют почти такую же плотность, как и алмазы、 * Нидензу К.. Dausoi J. химия борной кислоты compounds. In английский. Ф зигач. М..«Мир» 19682j8 С. Диаграмма XI-4.Структура нитрида составляет 6 ° α (стандартная форма).
Твердость, ИО гораздо лучше чем впрыска в сопротивлении жары (до 2000 * К) и прочности удара. Подобно алмазу, он является электрическим изолятором. Однако с некоторыми примесями мы можем перейти в полупроводниковое состояние как p-tnpa(S), так и p-type (Be).
Химическая стойкость боразона значительно выше, чем у обычной формы нитрида бора. важным преимуществом elbor является стабильность режущего инструмента (фрезы, сверла и др.) с Нм при высокоскоростной обработке стали и чугуна. Алмазы для этого мало пригодны, так как контакт с раскаленным железом значительно облегчает их прививку.
34) из 4 валентных связей каждого атома боразона 3 являются обычными, 4-донорными акцепторами n — * — B, дающими формальный заряд N *и B. » С другой стороны, оценочное значение фактического эффективного заряда имеет противоположный знак+0, для B-8, для N-0,8(IX.§ 2 ext.4).Последний представляет собой порядок величины, найденный в атомах типичного кристалла соли (например, NaCl).Таким образом, валентная связь бориона может быть обоснована. Доля ионности.
35) только около 1000 * с связывается с фосфором и образует коричневый фосфолипид-BP. Последний, как и borazioiu, имеет алмазоподобную структуру ld (BP)«-1.96 A) и высокую твердость (больше, чем кварц). он устойчив к нагреванию(переходит в серый VTsrz, когда он превышает 1180°C), а кристаллическое состояние в нормальных условиях очень химически инертно.
Фосфид Бора обладает характеристиками полупроводника с большой запрещенной зоной (4,5-9С).Фосфорилированный мышьяк Бор-в качестве свойства известны и близки. 36) карбид бора (B «C) образуется в виде черных блестящих кристаллов, когда смесь бора (или B203) и угля смешивается в электрической печи. Этот кристалл Состоит из типа сетки NaG из линейной группы C и группы Ext. Атомы бора расположены по углам икосаэдра.
Последнее показано на рисунке. X1-5 (числа соответствуют общепринятой нумерации атомов).Плотность карбида бора (теплота, получаемая от элементов 17 ккал / моль) составляет 2,5 г / см*, он очень стабилен с огнестойкостью (температура плавления 2360 * с), очень хорошей электропроводностью (около 0,001 электропроводности ртути) и экстремальной твердостью (близкой к алмазной) для неметаллов. xl-5.In связь с различными химическими эффектами различна.
Например, при температуре менее 1000 ° с не действует ни хлор, ни кислород(взаимодействие с водяным паром при 900°с протекает по следующей формуле: B4C + 6HaO-α= 2B3Oj +C-f6H2, затем BjO, — f H, 0 = 2HB0, t).Карбид бора используется при разработке и переработке различных твердых сплавов, а также в атомной промышленности(для захвата нейтронов).Из окремненного Бора, Б, Си, в Си, как известно.
37) Галогенированный бор общей формулы VG3 получают прямым синтезом из элементов при нормальных условиях (F). 400 (С1). 700 (Vg) или 900°C(I). Для получения B G j более подходит другой способ: нагреть смесь B2Oj и CaF с концентрированной серной кислотой. В этих условиях реакция протекает по общей формуле BaOi + 3CaFj-f 3HjS04-2BF, — f-3CaSO » — fзн 2О.
Чистый сухой BF удобно получать пиролизом «Ba(BF»). При 500 ° C он уже течет быстро. 38) структура молекулы Галогенида HG соответствует плоскому треугольнику, центрированному на атоме B. сравните некоторые их свойства со следующими BF, BCIj VVg » V1v 102 57 9 А (ВГ). Один…………… 1.31 IJ4 IO 2.10 Энергия связи V-G. ккал / моль. 。 。 106 90 68 Сила постоянна. …… 7.2 3.2 2.5 2.0 Также ионизационный потенциал молекулы. 。 15.5 10.9 9.7 e. o. Температура плавления. * С.**• −128-107 −46. + 50 + 13 90 210 Критическая температура. С… 179, 300.
Стабильность вышеуказанной серии галогенированного Бора снижается. Если BF очень термически устойчив, то B1 под воздействием света разлагается в нормальных условиях. Пара действует на кварц. благодаря взаимодействию prn высокотемпературных bclj и BBrj с некоторыми оксидами металлов можно получить их безводный хлорид или бромид.
Для эффективного заряда атома Бора BFj показывает значение+ 1,42 (согласно другим источникам,+ 1,29), а для энергии непрерывного удаления атома фтора значение равно 169. Это 118 и 174 ккал моль. Фторид Бора является подходящим катализатором для нескольких органических реакций. Существует специальная монография по химии этого вещества*.
39) смешанная бороновая железа, образующаяся частично при взаимодействии различных SH, имеет ярко выраженную тенденцию к симметризации и неустойчива в отдельных состояниях. То же самое относится и к газообразным соединениям Бора при нормальных условиях-HBFi n HBO *первое из этих соединений(d (BF)= 1,31,d(BH) 1,19 A]может образовывать CjHsBF с добавлением этилена. 40) взаимодействие между галогенированным бором и Галогенидом водорода является interesting.
In газообразный BXj + 3HY * * BYj + 3HX, равновесие быстро смешивается вправо, если галоген Y больше, чем галоген X в периодической системе, и равновесие быстро смешивается влево, если X выше, чем Y. например, не-CC и HBr легко образуют взрывчатые вещества и HI. Обратное преобразование, с другой стороны, выполняется только в небольшом диапазоне 300-400 градусов Цельсия.
Эта тенденция идет вразрез со свойствами композитного Галогенида технеция (VII§ 6 add.39). 41) фторид Бора слабо растворим в бензоле (около 7: 10 по объему), очень хорош в воде(до 1000: 1 Пр 0 * С по объему).Кремний (x§ 4 доб.90) как и в случае, фторид относится к воде иначе, чем другой бор glands. It не полностью гидролизуется, но в основном реагирует с образованием гидроксифторборовой кислоты по схеме HjO + BFj ** N [HOBFa].Его состав соответствует фторированному моногидрату Бора-HjO-BF»(mp 6°C).
В качестве одного основания очень прочен, но может вступать в реакцию с основанием, но слабее двухосновного оксофторбората-H | [Obvj], например, известны состав K (Hobfa) и соли (OBF) из (BAF) (а также аминопроизводные Kfhinbi), аналогичные таковым из первой из этих солей. 42) кристаллогидрат BFi-2H » 0 (mp.6 * С), по-видимому, является оксоевой солью (HjO) [Hofi) гидроксифторборовой кислоты.
Интересно, что в его non[HOBFa]’ средняя длина связи B-F (1.37 A) является серединой между аналогичной длиной связи BFa (1.31) и BF7 (1.43).И длина связи O-B (1.56) намного больше, чем нормальное среднее значение (1.47 A).Это свидетельствует, как бы, о более активном взаимодействии бора с фтором, чем с генделькеном. Однако возможна и другая интерпретация структуры рассматриваемого соединения-комплексы hio-BFa и молекулы HjO, которые связывают эти комплексы водородными связями.
43) продукт частичного гидролиза гидроксилфторбористой кислоты по схеме NaO + H [HOBFa] * HF + H ((HO), BFA) — известный только в жидком состоянии H [(HO) aBFa]-явно не является свободной кислотой, оксоновая составляющая соль (HaO) a / OaB} 6-членного кольца (B7 с кислородом c3 и BFT-основой) анионной структуры Fb4.Было получено несколько аналогичных производных металлов (Na, K).Напротив, кристаллический K ((HO) aBF], полученный взаимодействием KF с борной кислотой, явно является мономером.
44) структура 6-членного кольца (из атома кислорода и sh-группы) характерна для оксида бора-OaVaGa (Γ-F, C1, Br) и образуется в виде сублимата при взаимодействии HBa-галогенидов с борными ангидридами, нагретыми выше 200°C. Ниже этой температуры они разлагаются на исходные материалы.
Для фторида при температуре около 1000°С при пониженном давлении наличие денитрификации в паре было подтверждено по схеме OjBjFa * * 30BF. Очевидно, такая диссоциация хлоридов еще более характерна. * Б У с Г. Д. Мартин 3. химия фторидов Бора■его продуздим, Пер, С. М. ед., йод. А, Б, Тоочмева. М Iedathclcht, 1955.288 секунд、 -%45) быля I получил тиогарид Бора-s * Bar *(G-SC Br) аналогичной структуры.
В отличие от оксогалата, они стабильны только при низких температурах (не более 20°С). 46) известно, что она еще не была полностью изучена. У меня есть несколько производных Бора, похожих на галогенид VG4. Длительный контакт между BCB и AgCN был получен взаимодействием цианида Бора (B (CN) il) с KNCS в жидком SOa. Что родинид (B (NCS) j) это из BC1 и NaCCH и других l и d [BflCCH)»]. От B, H#, HNj, это то же самое, что IB(N|)|].
Некоторые смешанные производные также объясняются (например, (Br2N » h. здесь Γ-CI, Br], двойное соединение-LilB (NCS)]]] (форма фосфата) и M(B(N.)»(M-Li, Na).Все описанные вещества бесцветны, они тверды и неустойчивы в нормальных условиях. Азид производные, относятся к взрывчатым. Наличие прямой валентной связи между бором и марганцем является интересным нестабильным соединением в воздухе RiBMn (CO) » PR *, где R — C * 47) кроме основных типов ВГ». что касается бора, то известны низшие бориды. Структура включает в себя V-V bond.
As как правило, эти соединения нестабильны. Есть отзывы о них. 48) наиболее важным представителем таких соединений является dnbor-tetra-chloride. By проходя ВСС под давлением около 1 мм рт. ст., его можно получить по схеме 2BClj + 2 HG-HgaCb + B7CI4.Искусство. Через ртутную электрическую дугу. В результате Б] С1 |он представляет собой бесцветную жидкость (Мп.-93°С) и медленно разлагаются на BCB и (BC1) » уже меньше 0 * G.
40) молекула BBCU характеризуется структурными параметрами d(BCI) 1.75,d (BB) −1.70 A, ZC1BC1-119.Энергия связи силовых констант k (BC1) −2.2 и k (BB) −2.6 B-B оценивается в 77 (88 по другим источникам) ккал / моль, а потенциальный вращательный барьер этой связи равен 2 ккал / моль. mol. In в кристалле молекулы B} SC имеют четко плоскую структуру, но в газовом и жидком состояниях групп BCB они перпендикулярны друг другу.
50) даже при низких температурах в днбор-тетре хлориды бурно реагируют с кислородом, хлором и бромом(nb не взаимодействует с серой или йодом).Также водород ом разлагается аксиально по схеме ЗВ2С1″ + зна-4вцц+Ван«. Первой стадией всех этих реакций bjcla, вероятно, является добавление соответствующей молекулы, расщепление B-B связи и симметризация полученной смеси derivative. In аммиак, реакцию замещения проводят по схеме BbCb + 6NH «—4NH» C1 + Ba (NH)*, в гидразине-по схеме B «Cl4 + 5N2H4-4N», H «C1 + B» N.
Оба амидных и нитридных производных являются белыми твердыми веществами и являются полимерами. Последнее соединение отличается по свойствам от обычного нитрида бора и, скорее всего, состоит из следующих типов структурных элементов Я, Я, Я, Я. — B-B-N-N-N-N. В качестве стабильного Мономерного соединения с B-B связями следует отметить ((CHj) aNJjB-B [N (CHj) a) a. это вещество выдерживает нагрев до 200°C на сухом воздухе.
51) Что касается VACC, знайте продукты с добавлением многих substances. An примером может служить белое твердое вещество, довольно термически стабильное производное пиридина-(C * H «N) aBaCl».Интересна реакция, протекающая в жидком хлористом водороде по формуле 2fN (CH»)<] CI-f BaCI» *(N (CH) «fe (BsCb), результатом которой является белая соль тетраметиламмония и aiyon[B / CCr〜. 52) в обоих случаях выше соединение B-B не было нарушено.
Добавление этилена, напротив, влечет за собой разрушение этой связи с образованием SCBCHFB(bp-28 * C).Интересна плоская структура рассматриваемой молекулы (за исключением атома водорода), длина связи с-С составляет не 1,54, а 1,46 а, что обычно характеризуется близостью 2 двойных связей(добавить X§ 2). * Ходднея.. Мессе * А.. Имел * грубость, IM4. * 2.233. 53) взаимодействие BaCW с водой зависит от формулы BaC1 ″ — f 4HjO = 4HCI + Ba (OH) 4.
Когда он превышает 90 * C, вторичные реакции начинают играть role. Bt (OH)» + 2b-At + 2B(OH)». Кислота, соответствующая формуле(HO) aB_B(OH) a или H4BaO, представляет собой белое кристаллическое вещество, которое легко растворяется в воде (и спирте).Прочность сравнима с Ортоборной.
Однако заметной восстановительной активностью является different. So реакция по схеме H » Bj04 + Oj + HjO-2НаВОа в щелочной среде заканчивается через несколько минут. Из-за этого вполне возможно, что Солнце было принято и по сей день. Последние также могут быть преобразованы по схеме: ЗВа (он) < — 4в(он), + 2В. 54) при нагревании в вакууме H4BiO » медленно теряет воду, образуя (B: Oz) x.
Белый полимер оксида бора, полученный таким образом, меньше, чем Ци из гороха, и его нос прозрачен. Чем пар, образующийся при «замораживании» (дополнительный II).в воде получается смесь Bs(OH) и и B (OH) j, но ее относительное содержание зависит от условий взаимодействия. 55) известны более»ненасыщенные» борные кислоты-H B BjOa и H4B202(т. е. NOVN-NVON).Первый из них (возможно, фактически новый) образуется при обработке борида магния водой и солями обеих кислот, когда он взаимодействует с щелочными растворами различной концентрации.
То есть среди гидролизатов борида магния была выделена аммонийная соль»субфолиевая кислота»-NW»0″.По-видимому, его структура похожа на Тетра Борну (add 20).Но существует прямая связь между 2 центральными атомами бора. Пиролиз этой соли по реакции (NH h hB 0 0e = 2NHa + NaO + B40 $ — вероятно, природа полимера, бор B o 5С) схема МГБ ^ +4HaOMg (ой) получается затем я + 2nova, делится своими впечатлениями, а затем (в люминесценции) 2nova, делится своими впечатлениями = зн? + B; OJ оксид бора может быть использован в синтезе BSC.
Дело в том, что при температуре около 250°с реакция с 4ВС13+ + 3bjoj * * 2bjoj +звзс1 протекает с достаточно высоким выходом тетрахлорида Бора. Последний является распространенным исходным продуктом в производстве многих других соединений бора, в том числе B — B связей, поэтому его очень легко получить самым простым способом. 57) схема 4sbfj + 3BaCb-3BjFa-f4SbClj дает четырехфторированный бин боросиликат при низких температурах (mp.56.Mp.-34 * C).
Его молекулы характеризуются следующими структурными параметрами: d(BF) * * 1.32, d (BB) −1.67 A,^ FBF-120 *.Суммарная энергия взрывчатых веществ составляет 103 ккал! Крот, и вращение вдоль него почти свободное. 58) термическая стабильность BaF»довольно высока и даже при 100°C [только разлагается на BFa и (BF)]».Свои химические свойства вообще подобны к B2CI4.Но не так много было изучено.
Особый интерес представляет тот факт, что тетрафторид Бора не вступает в реакцию с SOa, и даже при низких температурах реакция оксида ртути протекает по следующей формуле:3B2F4-f 3HgO = » B2Oa-f 4BFa + 3 HG. Бесцветный ДНК-тетраборат Бора (mp 1°C) в дальнейшем не изучался. Реакция ЗВгС1 «+ + 4ввг » — * 4вс1а * зв? Вы можете получить его, нажав на кнопку «Вг».Светло-желтое твердое вещество Ba1 * было получено в нормальных условиях.
50) т. е. BaC1 продуктов пиролиза(.В дополнение к Бо и (Р1) Вт, можно отделить небольшое количество твердых хлоридов, которые характеризуются 2 отдельно-бледно-желтый, слегка напряженной, В «С1″(Мп 95 * С) и красный»С1″, оба обладают высокой реакционной способностью(например, B4ST само-воспламеняется на воздухе). 60) с точки зрения обычной валентной теории структура молекулы b4ci4 должна соответствовать квадрату, образованному группой BCI.
Однако результаты рентгеноструктурного анализа интерпретируются в пользу тетраэдрического расположения атома Бора (</(BC1) −1.70, d (BB) 1.71 A), если это так, то каждый атом должен выполнять 4 валентные связи, а не trЕму не хватает внешних электронов, то есть молекулы электрически заряжены. deficient. In в таких случаях они обычно прибегают к интерпретации соединения в терминах теории молекулярных орбиталей(VI§ 3 add.14).
Соединение B-C1 считается нормальной ковалентной связью. Кроме того, оставшиеся 8 электронов из 4 атомов бора попарно заняты 4 связывающими молекулярными орбиталями тетраэдров. Ситуация с молекулой B * SC почти такая же. с! Субгалогенид Бора (BH) в составе«белое (F), желтое (C1) твердое вещество. Красный (Br) nln черный (1)color. It также подтверждено наличие красного BisCIii (mp 115°C) и бледно-желтого BaCU, который не сублимируется до 350°C. Все эти вещества еще не очень изучены.
62) растворимость BFj в жидком фтористом водороде мала (около 0,5 мол.%при нормальных условиях) и они химически взаимодействуют друг с другом. Напротив, в присутствии веществ, способных связываться с Н (например, воды), реакция протекает по схеме Р «-F BF»- BF^.Полученный композитный Ион[BF «] » является тетраэдром расстояния b-F. Он равен 1,43 а(то есть значительно больше, чем в случае с БФ).А сила сцепления постоянная-5,3 (по другим данным, 6,6).
- Многие фторбораты кристаллизуются и выдерживают очень сильный нагрев(например, KBF растворяется без разборки 530). по растворимости они похожи на перхлораты: соль K. HBFa и К. в растворе такого металла, как Na, происходит кислотная реакция, которая обозначается частичным гидролизом и протекает по схеме: (BFJ * +Н* 0 h * HF +(HOBF » I \при нормальных условиях константа гидролиза (v§ 7 add.6)составляет 2-10″*. 63) хорошо растворимые фторборатные соли Sn и Pb используются для электроочистки (рафинирования) этих металлов.
Нитрозил фторохолевой кислоты (NOBF4), который образуется при пропускании NjOi через концентрированный HBF, представляет собой бесцветный твердый кристалл. При нагревании с фторидом Na nln K NOF отсекается. Также был получен нитронил — (NOj) BF фтороховой кислоты. * 4)интересным продуктом является добавление»безводной серной кислоты-белого кристаллического KBF» — 4SOj (включая mp 65 * C, dec) к KBF. . ГК) формирование производных похожие на fluoroborate типа M1VG4 других галогенов не характерно.
Его структура, вероятно, соответствует (B и S) в качестве двойного донора выражению KIB (FSOi)»] cf’B Людмила Фирмаль
Тем не менее, ICiHaNH-катионная соль довольно высока. N (CNj)*) получают со всеми галогенидами, а хлорид типа M[BC1 «]также известен в Cs, Rb, K и NH».Все этнические соединения гигроскопичны и быстро разлагаются water. As как правило, они бесцветны. Исключение составляет оранжево-красный NO (BCI»] (mp.24 * С).
Смешанные фторхлориды типа M (BF » CI]) также являются known. An примером этого является нестабильный желтый NOfBFaCI].Взаимодействие BF>и NaH состоит из Na [HBFsJ в Na [H, BF, J. 66) если гранит Бора образует комплексы с другими веществами, то акцептором служит атом в(IX§ 2 доп. 2).Таким образом, он связывает молекулы VG|can только с молекулами, содержащими атомы с достаточно разными донорными функциями.
67) хорошим примером такого комплексообразования является легко прогрессирующая реакция H * N-f BF | hjnbfj + 41 ккал. Полученная молекула характеризуется следующими структурными параметрами: d (NB)= 1.60, d (BF) 1.38 A. ZNBF 107°, ZFBF = 111 *.Для константы силовой связи N — * B приведено значение k = 4,40.
Бесцветный кристалл HjNBFi (mp 162 X) не растворяется в неполярных растворителях, а лишь медленно реагирует с водой (примерно 1: 3 по массе), по схеме: H, NBF » + HjO» NH» 4 + [Hobfjjj ’.Выше 125 * Cs нитрид бора и фторированный аммоний начинают медленно разлагаться.4H * NBF * «= BN + 3NH «BF».Жидкий аммиак (растворимость около 1/10 по массе), нестабильный аддукт продукта I, NH 2 n 3 молекулы (по воде)
Схема HjN-H> NBF|), а при действии Амида калия, реакции H, NBF,+ 3KNH, — 3KF | + B (NH.),+ NH, происходит образование нестабильного Амида Бора. Последний получают непосредственно взаимодействием с жидким аммиаком хлористого Бора (ВС!,- f 6NH, — 3NH «C1 + B (NH.).].И его йодид дает белый осадок, названный бором: + B»(NH).Первым шагом реакции в обоих случаях, вероятно, является добавление NHj к VH molecule.
In в отличие от аммиака, трифторид Бора не взаимодействует с NCU (и NHjCl). 6J) известно много различных продуктов присоединения BF. Некоторые из них заслуживают особого внимания mention. So реакция clfj и BFj делает бесцветный [C1F.] (BF»] (mp 30°C) также известным(FClt) [BF — f 20, — f F?。
Он разлагается в соответствии с и фторбористой кислотой Nntronn [20JBF«] — f NjO «- 2NO ^ BF»)+ 20.] с получением оксида азота. (Х§ 2 доп.48) легко запустить (CH>)$ NTOBFj. Взаимодействие с HF хорошо растворяется в воде и спирте [(CHj) jNOH) BF «.Аналогичное производное гендлоксиламина, Фибнхжох обладает свойством слабой одноосновной кислоты (К „■3 * 10“*), а его калиевая соль[Фибнхтойк-легко растворяется в воде и спирте.
Интересна способность BFj связываться с комплексным цианидом. К ((МО (СН).)•8BFj. По-видимому, соль» двухслойного » комплекса Anon[Mo (CNBFj)>] 4〜.Согласно данным инфракрасной спектроскопии, NJ-комплексы частично образуются со смесью BFj и азота^ BF.」 69) наиболее типичными и многочисленными продуктами присоединения трифторида Бора являются фторборамин, а в других галогенидах ртути, как правило, аддукты образуются при взаимодействии центрального элемента донорной молекулы с бором.
В случае BClj продукт добавления менее известен, чем в случае BFj. Для BBrj-еще меньше, а для Bls-очень little. An примером последнего является UPBIj, который осаждается путем выгрузки раствора дисульфида углерода PIj и BI. Этот оранжевый аддукт возгоняется в вакууме при 100°C, но оранжевый Br (PB1) также стабилен до 80°C, а желтоватый CljPBIj-только до 35 ° C.
Интересная резкая разница между длинами связей CHjCNBClj (1.56 A) и CHjCNBF (1.63 A) N-B. 70) аддукты к ГАЛОГЕНИДАМ VH имеют разную стабильность: некоторые из них. Например, Нарвс1 | (14 Мп под давлением при 121°с) разлагается только при нагревании. Другие, например CljPBClj (mp −94°C). он может существовать только при низких температурах.
Специфическая стабильность зависит от природы связывающей молекулы[например, ряд (CH») jN> >(СН.), 0> CHjF или (ч), р>(CHJ успешно), с> СН, С1. (CH), N>(CH.)> P> >(Ч) САС>(СН.), СО или (СН.), 0>(СН.), с>(Чи) ГП>(ч), Тэ].В нескольких различных системах (например, продукт присоединения Амина), согласно F-Cl-Br-I, было указано, что он не уменьшается (как считалось ранее), а увеличивается. 71) подобно бору, трехвалентный азот также характеризуется координационным числом 4.
Однако комплексы, образованные обоими элементами одного и того же структурного типа, обладают различными электрохимическими свойствами. Бор образует а и [BFi] — ионы, азот образует[NH4] * cations. As как видно из приведенного сравнения, производное соответствующего электрического нейтрального вещества является временным случаем: Naftfj-ICFJ — [CHJ-[NH4IF.
72) при лабораторном производстве Бора-водорода в малых количествах сплавы бора и избытка магния обычно обрабатывают в 8-Н растворе NERO. Бораны могут быть отделены друг от друга фракционированием (при отсутствии воздуха).Приготовление донного Борана (B, H -) может осуществляться под действием разряда в смеси BC14 пара и водорода (при пониженном давлении). удобным способом получения днборана является реакция, протекающая в эфирной среде по схеме: 6MN-f 8BFj 6MBF «+ B * H » (M-Li nln Na). образование днборана происходит при нагревании смеси паров Бо *и водорода металла (Al. Mg, Zn.
It также происходит, когда вы проходите через nln (Na).Имеются признаки возможности образования в 1000 § 2§ § непосредственно из элементов. 73) будучи изолированным от воздуха и воды, VN может храниться в течение почти месяцев без разрушения. В этих условиях медленно обнаруживается только разложение наиболее нестабильного объемного VLv. Его продуктами распада являются водород и другие вещества Водород boron.
At во-первых, это может быть обнаружено удалением водорода и образованием более низкого Борана в Нм. Наличие В2Н # # в продукте разложения объясняется реакцией второго порядка взаимодействия водорода с 分解 » ню » 未, которая в момент эволюции не разлагается. Это косвенно подтверждает аналогичный процесс. Добавленный к B » Nu во время распада, SiiHe полностью преобразуется в SiH4.
74) обычным исходным материалом для получения оставшегося борогидрида в настоящее время является B * N. таким образом, регулируя условия его пиролиза, другие желательные Бораны могут быть получены непосредственно через промежуточные стадии. Основные направления таких переходов схематично показаны на рисунке. XI-6.In помимо температуры, большое влияние на процесс термической реакции Борунов оказывают различные другие факторы(например, давление).
Наиболее перспективными для использования в реактивных топливных системах являются V * N И Vk> Nts. Имеется обзорная статья*и специальная монография по боросиликатного водорода 75) шесть гидратов изучены лучше других. Точка плавления и Точка кипения: Бжх. «N | f B» H / В & H9B » H|оН / » Температура®С……..— 165 −120 —122-47-62 +99 Температура……… −93 +18 63 60106213 Водород БШУ. B5H9 и B $ Nu обычно являются жидкими.
BioHt4 представляет собой бесцветные, летучие летучие вещества без разложения(давление пара 0.045 мм рт. Prn25°С).Даже небольшое количество паров Hx в воздухе вызывает головную боль и тошноту при вдыхании. 76) борогидрат-это прежде всего нейротоксин. Они могут проникать в организм не только через дыхательную систему, но и через всасывание через неповрежденную кожу.
Минимальное содержание Hx, определяемое по запаху в воздухе, составляет порядка 1000 мг / л в течение 1 минуты, уже превышая токсическую концентрацию. Острое отравление может вызвать головную боль, тошноту, слабость, судороги или сильное раздражение. Наоборот, психическая депрессия. Пиар Диаграмма XI-6.Термическое преобразование Борея. * Паук и Я. М. ..Успехи в химии. 1963.М9. III). Михайлов Б. М.. К у М О В А М. Е.. Достижения в области химии. 19(6. М 8. 1345. * * Михайлов В. М., химический борогидрид, М. «Наука», 1967.520 С.
Хроническое отравление в основном поражает дыхательную систему, печень, почки. Для индивидуальной защиты рекомендуются резиновые перчатки и специальный противогаз(хопкаллит, силикагель, алюминий в качестве фильтрующего материала).
При случайном попадании болы на кожу, немедленно протрите ее разбавленным раствором NH. 77) во многих органических растворителях-боране. Как будто… silane. It растворяется без разложения, а с водой они разрушаются быстрее, чем с силой. Скорость interaction. In в целом, в серии, описанной выше, она уменьшается. Щелочные растворы разрушают Бораны, высвобождая 1 молекулу H}для каждой связи B — B или B-H.
78) при отсутствии примесей указанная пара боры в сухом воздухе (за исключением «нестабильного Пента-Болана» — B * Nc) самопроизвольно не воспламеняется. Однако во влажном воздухе такое самовоспламенение может произойти даже при взрыве. Только декаборант совершенно стабилен при комнатной температуре воздуха-B < < > H / теплота плавления составляет 8 ккал / моль, а при плавлении плотность уменьшается с 0,92 до 0,78 г / cm9.In другие borays, ряд жидкого состояния от 0.45(BtHe) до 0.70 (V » Nu).
В эквивалентных условиях индивидуальная термическая стабильность boray отличается в серии BioHi«> B5H,> B2H «> B $ Hc> B» Hi». 79) что касается составляющих его элементов, то Боран является слабым эндотермическим соединением (например, 9 ккал / моль B2Hv).Критическая температура гиборана+17 41,критическое давление-40 атмосфер.
Его молекулы неполярны, характеризуются потенциалом ионизации 11,4 В. напротив, молекулы других поляриев Бора изучены в этой связи. Следовательно, дипольный момент В » Н, 0 равен 0,56 (в бензоле). B * H » −2.13 (в парах). B | bH | » −3.17 (в CS) или 3.62 (в бензоле). Потенциал ионизации молекулы b8h # n B | 0HM составляет 10,8 и 11,0 вольт соответственно.
Жидкость B * H («стабильный пейтоболан») имеет достаточно высокую диэлектрическую постоянную (при температуре плавления e = 53, при 25°C e = 21).Но неорганические соединения в нем есть. Как правило, нерастворимы. Плотность при 25 * С составляет 0,62 г / см9, а теплота испарения-8 ккал / моль.
80) какой-то другой, редко изучаемый Боран, но полученный несколько более сложным способом(некоторые очень небольшие количества): В|Нц (Мп.-82 * С. давление пара 17 мм рт. при 0 * С и 67 at25e), Б » нажмите(Мп.20). ВВВ,$(Мп. При + 3°C давление пара при 28°C составляет всего 0,8 мм рт. ст.). Б}«ХК (Мп.99°с). В «Н», «последний» известен для 2 изомеров, температура плавления которых составляет 180°C (нормальный) и 129°C (iso).
Существует также индивидуальная адаптация и появление при определенных условиях большего количества соединений того же класса. Например, BioHt *можно найти в продуктах реакции в разрядке, и BtoHt можно ясно отделить от промежуточного продукта термического разложения decaborant. Bthi, как сообщалось, получил » B » Hu. ВУНЦ. 81) вопрос о строении и свойствах водорода Бора является одной из самых сложных теоретических проблем общей физики. 1.
Oi еще не считается успешно разрешенным. Поскольку бор является 3-валентным, его максимальный насыщенный гидрид водородом должен соответствовать общей формуле B * H «+ T. то есть составу BHj, BfH», B» H», B» HB и др. Такая конфигурация неизвестна. Молекула Летучего боронового водорода, по-видимому, рассматривается как результат сочетания вышеупомянутой валентно-насыщенной структуры и сшитой водородной связи B * * * H * * * B.
С такой комбинацией 2 структур, типа B. N. + 4 воланы получены(в частности, BjHi, BjH.«В» Ч / * Биоху. Биджн). Комбинация из 3 структур имеет тип ВяНя4 «(в частности, в » н / о. Вы также можете использовать THEB | H//, BioHu). 82) состав простейшего Летучего борного водорода — B2Nv-VNe + VN>и B «Hio-ВНз + В2н» + вн,.Но для пентобарбитал, «мобилизация противоположного пола» можно. Так, BVH9 б «н» + б> H «или Л+ БГ * в BsHn-б, х «+ б, х» + ЧД или ЧД,+ б, х «+ БГ.
С увеличением l в Формуле боргидрида увеличивается число принципиально приемлемых вариантов таких множеств (например, в Вьюни их 5). параллельно увеличивается и число принципиально возможных деформаций за счет объединения исходной валентно-насыщенной структуры через водород cross-linking. In кроме того, он начинается с B4H$.Сама изомеризация этих исходных структур (100 миллионов ответвлений атомов бора) становится возможной, и число их вариантов быстро растет с увеличением n.
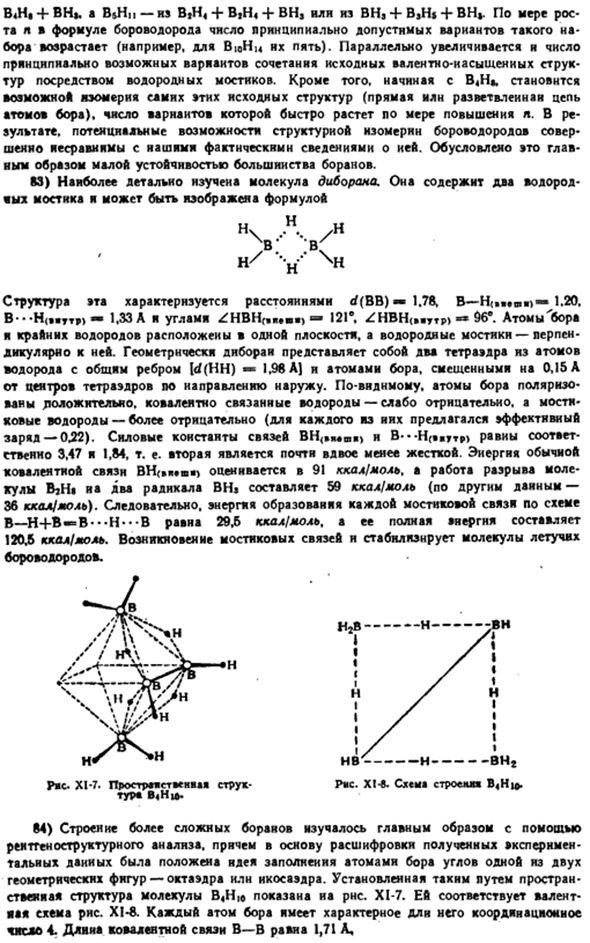
Структура борогидрогенного потенциала противоположного пола вообще не может быть сопоставлена с нашими фактическими сведениями о ней. В основном это связано с низкой стабильностью большинства Боранов. S3) молекула диборама является наиболее изученной. Содержит 2 водородных моста и может быть выражена формулой Н / Н В X ; н / в Эта структура имеет расстояние d (BB) 1.78, B-H (, 1.20.Б — » Ч(.штт «>-1.33 А и угол ЖБХ (, м — » > — 121е. ЖБХ(.. yTp>96е. Атомы бора и полярного водорода находятся на одной плоскости, а водородный мост перпендикулярен ей.
Геометрически гиболай представляет собой общий край[rf (HH) 1.98 A] и 0.15 A от центра 2 тетраэдра со смещенным атомом Бора. Внешний тетраэдр по-видимому, атом Бора положительно поляризован, ковалентно связанный водород становится слабо отрицательным, а сшитый водород становится более отрицательным (BH-связь («*»ay) и B — — — H («out»>равны 3,47 и 1,84 соответственно, т. е. 2-я энергия обычной ковалентной связи атома-HH).. 9H » > оценивается в 91 ккал / моль. Задача разрушения молекулы BjH$и 2 радикала BHi составляет 59 ккал / моль(по другим источникам-36 ккал / моль).
В результате Энергия образования каждой сшивки по схеме B-H + B — = B — — — H — — — B составляет 29,5 ккал / моль, а ее суммарная энергия-120,6 ккал / моль. Возникновение поперечных связей и стабилизация летучих молекул боронового водорода. Ряса. Х1-7.Слава этого сооружения-сутана. XL-в. Схема» * * Б » ху>. Турия Б(H | *. 84) более сложные структуры борая изучались в основном с помощью ре-генного структурного анализа.
Интерпретация полученных экспериментальных данных основывалась на предположении, что углы одной из двух геометрических фигур, октаэдра или икосаэдра, заполнены атомами бора. Пространственная структура молекулы b4h, установленная таким образом, показана на рисунке 1. XI-7.Соответствует валентной схеме на рисунке. XI-8.Для каждого атома Бора существует характерное координационное число 4.
Длина валютной облигации B — B составляет 1.71 A、 85) Как упоминалось выше, молекулы B * H могут быть «типизированы» двумя различными способами. X1-9, показанный на рисунке, результат определения его пространственной структуры, поддерживает множество типов B3H5-f B; H(рисунок X1-10).в этом случае Центральный атом B также имеет координационное число 3, которое характерно для Бора (например, ВГ$).
Аналогично, результаты определения пространственной структуры молекул BsHit благоприятствуют «рекрутингу» по типу ВН + BJH $ + внобратный путь от «рекрута»к»структуре» все еще невозможен. НВ — — — — — — Ч — — — — — — ЧД Ряса. ХІ-значения i0.Схемапостроена с помощью буквы «N». Гонка XI-9.Широко распространенная структура B «H». 86) интерпретация характерного водородного моста также является неопределенной частью теории строения летучих летучих веществ. Связь B — * * H * * * B (иногда называемая «бананом» из-за кривизны) обладает свойством, которое бесспорно отличается от обычной водородной связи(IV§ 3, 7).
Поскольку существует только 2 электрона для связывания 3 атомов, он может быть настроен в соответствии с типом 2 1 электронных связей (IV§ I dol.11).Такая интерпретация хорошо согласуется с ее относительной прочностью (согласно примеру Hj, ожидается, что 2 одноэлектронных соединения будут несколько выше, чем 1 2-электронное соединение).
Если спин обоих электронов параллелен, то это не противоречит диамагнетизму Борана. Однако на данный момент теория молекулярных орбиталей (VI§ 3 ext.14) принято трактовать Динную связь как 3-центовую: линейная связь из 3 атомных орбиталей (по 1 от каждого атома) заполнена 3 молекулярными орбиталями (связью, связью, рыхлостью, наиболее энергичной из которых является связь-одиночная электронная пара).
При интерпретации электронно-дефицитной структуры более сложного борогидрида мы также используем понятие более чем 3 центральных связей (например, 1 5-центральные связи атомов бора в B» H9).Существует обзорная статья о структуре борогидрата. 87) свойства Вкнк, первоначально синтезированного в разряде, отличаются от свойств других борогидридов.
Его структура не имеет поперечных связей. Oi-бесцветное кристаллическое вещество (Мп.199 * с).Уже сублимированный на 100 * С или более под вакуумом, он гигроскопичен, реагирует с водой, образуя сильное двухосновное вещество acid. At в то же время, Новости твердого бора (который больше не изучается) еще меньше hydrogen. It отличается цветом (чаще всего с желтым оттенком)и растворимостью в сероуглероде.
Коричневый цвет беднейшего водородного Бора приближается к цвету аморфного Бора. 88) при интерпретации химических свойств Летучего Борового водорода главным фактом является то, что атомы бора не полностью экранированы (х§ 6, доп. 103). в результате участия в них участников или других участников из окружающей среды, вообще говоря, будет иметь первичный * Восковой воск.. Эвер * * Р ДТ У » К р о Форд к Usvvhzh хамское. 1 МБ, J * 10, J9.
Основной процесс: резка водородного поперечного движения протонов nnn (X§ I ext.108), выбор направления резания Na и других направлений, ведущих к образованию кобалитовой связи B-B, зависит от характеристик адгезивных частиц. химическое превращение днборана изучено полностью, поэтому оно главным образом рассмотрено ниже. 89) под воздействием ультрафиолета (длина волны 1849 а) гиборай испытывает одновременно 2 типа распада-B, He = BaH $ + H, BaH6 = BHj-f BH. — Вероятность того или иного события примерно равна 10.1.
In в смеси днборана и трихлорида Бора при комнатной температуре устанавливается левостороннее равновесие по схеме. 00) основной стадией взаимодействия днборана с водой является, по-видимому, разрушение поперечных связей H, 0 + HV (HH) HH + OH,= 2HaOHH. Затем протоны из молекул воды переходят в отрицательно поляризованный водород связи B-H.
С расщеплением молекул водорода: NaOVNA + NOVNA. In кроме того, тот же процесс повторяется 2 раза по схеме: HjO + VNa (OH) * * NaVNA(OH) — * H,+ VN(OH), и H, 0 + VN(0H),^ Na0VN(0H), — ^ H, 4-B(0H).Поскольку каждый атом Бора промежуточных продуктов гидролиза (BHA-OH и BH (OH)) имеет только 3 координационных участка, возможность добавления к ним молекул воды больше, чем у атома Бора диборана.
Поэтому, поскольку промежуточный гидролизат не накапливается, по сравнению с первичной реакцией, тем выше доля вторичной реакции при consideration. At −130°С в диборе получены кристаллогидраты состава BaHb-2HaO с расчетной структурой hHaBH *.Это соответствует первой стадии процесса гидролиза, описанного выше. 91) гидролиз оставшегося борогидрида происходит значительно медленнее, чем днборана.
Это связано с низкой растворимостью в воде в некоторой степени. Таким образом, в общей схеме B $ H» + 15HaO = 12Ha + 5B (OH) показано, что взаимодействие B * H «и H» 0 по s протекает несравненно быстрее в растворе обоих веществ, чем при их непосредственном контакте. 92) как клэйд. Борат водорода не взаимодействует с концентрированной серной кислотой.
Сильные щелочи сопровождаются реакцией, которая не является аналогичной в химии кремния: палочки BaH помещаются в воздух, а палочки KOH покрываются белым слоем Бората калия, образованного следующей кристалличностью: KOH + BHA (HH) BHa + KOH = 2K (в воздухе HOBHjI они поглощают воду и распространяются, следующая схема). последовательный гидролиз начинается согласно: kibhjoh] + HFO * = na-F klbha (Oh) t). К(ЧД, (Ой), если ю ^ ГП-Ф K1BH (О), 1 и, наконец, Клиб(О), Л + Н, 0 = Н,+ К [В (О)<].
Чрезмерное щелочное естественное разложение следующего Бората протекает очень медленно, но при разбавлении водой оно значительно ускоряется. Bi и Sb выделяют свободный элементаль. 93) взаимодействие жидкости с щелочным раствором Борония несколько отличается от В, Н*.Первоначально он растворяется без образования водорода. Если раствор не подкислен, начинается разложение в Na и HjBOj.
Однако прогресс идет очень медленно и реакция занимает несколько дней. По-видимому, более стабильная кислотная соль образуется в щелочном растворе жидкого Борана. Они могут быть идентичны соли! Оно получен обработкой алкалиа бората магния (добавьте 55).Эти соли (и производные HB40, полученные одновременно) представляют собой бесцветные кристаллические вещества, раствор которых является мощным восстановителем.
94) в нормальных условиях твердый Вуни растворим в спирте и эфире и проявляет сильные свойства одноосновной кислоты. Некоторые соли Дека Болана также известны в твердом состоянии. Таким образом, Набиохис взаимодействие между нах и раствором ВУН < » в пропеллятном эфире, и Водный раствор и Grim[Н(CHJ успешно)] О-О-нерастворимые в воде желтый{Н(CHJ успешно))) б-о«.Свойства двухосновной ноты следующие: «Hn [/C»-3•10- (нормальный) или 3•10〜(iso)) и B, s.
It характерно для обеих форм H. An примером последних солей в них является достаточно стабильный гидролиз Чвюнма(полученный при действии КВН на дехаоран в водной среде).Соли типов M’vnm и M / ViN (/(2-й в Эно-щелочной среде)) также были получены и получены из неизвестных в свободном состоянии Борана VcN|$. 95) процедура из ВУН/». была получена интересная производная Иона B, 0H’Ё и в»££.Известны не только соли, содержащие их (в частности, нерастворимое серебро).
10 гидратов и кристаллогидратов фосфатов-(ю) 2Б, 0H10xH2O и (Hj0) 2В -, ч | 2-ХН » 0.Эти узлы сравнимы по прочности с H2SO.」 Рассматриваемые Ноны могут быть получены из нормалей насыщенного Борана B | 0H, t и B»iHu (дополнительно 81), но трудно совместить регулярные икосаэдрические интерпозиционные конфигурации атомов бора, используемые в них, с рентгеновской дифракцией.
Атомы водорода в них могут быть частично или полностью замещены Галоном atoms. In кроме того, такие изменения существенно не изменяют химический состав properties. In в частности, при$ 2VyuCl1 он стабилен в воздухе до 400 ° C. 96) известны также некоторые другие производные рассматриваемых ионов. Например. [(CtHs) действие FeClj на разбавленный водный раствор snhbbio производит белые кристаллы [(с разложением Cjhihhhbbtohu (mp 173 *С)), которые неразрешимы в холодной воде. * 2Н » 0.Поэтому Боран Вьюнп, являющийся основой этого соединения, является тетрабсидацидом(/(» «5•10» «)установлено, что для аннона[B » Hc) установлено 4-3 изомера. * Ч «(М-ЗС. Rb), CsBjHu и (Zn (NH*).] B, Ht.
97) многие соединения общего типа B10H, 2-2X, также производятся из неизвестной молекулы B, Ant, в индивидуальном виде states. An пример-Vyuts * 2 (CH.) tS (mp 123°C). BioHtt * (CH) tS * NaCN и BioHit * NaCN * NaH. Исходным материалом производства также выступает дека Болан. Существует обзорная статья по химии этого борогидрида и его производных.
98) XBjHe многие более или менее нестабильные производные этого типа известны в стабильном пентаволане. X-одновалентный атом или радикал (K. Na. Li, ки. И так далее. Пожалуй, наиболее интересным из этих соединений является (B> H.) 2CH. Радикал B ^ bC связан с углеродом через атом бора на вершине пирамиды bbN (см. Рисунок XI-9).Это вещество бесцветное HRN. It взрывается медленно в вахуме и взрывается в воздухе.
MSHH hexabilia chnu salt (M K, Na. It также известно, что будет сгенерировано из (Li). 99) при взаимодействии днборайи с порошком гидрида лития, суспендированным в кипящем эфире, образуется боронат лантана по схеме 2LiH + BtH» — 2Li (BH).Борат натрия, который является более практически важным, образуется в аналогичных условиях.
Например, на основе реакции были предложены различные способы ее приготовления: NaH + B (OCH.), — Na (HB (OCH.)), l и 2Na (HB (OCH.))+ B2H,-2Na [BH + + 2B (OCHj) j. первая стадия этих последовательных реакций осуществляется на 2-й стадии с кипением В (ОСНе) B и протекает легко при комнатной температуре. С помощью NA [BH -) (например, схемы NaBH, — f KOH-KVN, — f NaOH) можно получить бораты и другие щелочные металлы.
Взаимодействие между NaBH и NH приводило к образованию F, Болана аммония, NH и BH в жидком аммиаке и было стабильным только при температуре −40°C. 100) Борг-высушенный щелочных металлов имеет характеристики типичной соли. Ионы BH7 представляют собой тетраэдрические атомы водорода с атомом бора в центре、 * Стена ко В. И. Чаовскма Ю. А. братце»В.» А. Захаркам Л. И. Усяеха хм-ЫЫЯ. ИМС НК 6, 1011. 2.03 толстый радиус.
Связь B-H в нем характеризуется ядерным расстоянием d-1.26 A и выходным ко-сопротивлением 3.0. Энергия генерации ионов HH из HH и H оценивается в 75 ккал / моль. 101) в атмосфере водорода (или азота) LiBH, «плавящегося при 278°с путем демонтажа, NaBlU устойчив до 400°С, а KVN» до 500°С. водородный борид щелочного металла легко растворяется в воде (например, NaBH 55 г, aa 100 г, 0 pr 20°С) и взаимодействует по общей схеме: MVN » — f 4H, 0-4H,+ MON + H, BO * .
Но полученная щелочь не пойдет до конца, потому что она тормозит процесс. Скорость гидролиза снижается серией LI > Na> K. In кроме того, Боргидриды Na и K очень медленно разлагаются только в холодной воде, NaBH» — 2H » 0 и KVN4 lN, 0(Здесь l-3 или 1).Горячая вода разлагает рассматриваемый борид водорода быстрее, а в кислой среде его разложение очень сильно fast. In параллельно с гидролизом под действием кислот частично протекает реакция типа 2 ″ — f2HC1■2mci + HT + Bjlv. В отличие от своих аналогов LiBH, он слабо растворяется в эфире (0 * C и 4,5 мас.1,3% при 25#C).
Хорошим растворителем NABH является жидкий аммиак (1: 25 * C по массе при 1) и dnglim-0 (CHjCH20CH«) t (bp 161°С).Если вы подожжете в воздухе, Набх «сгорит» мягко.»」 102) борогидриды щелочных металлов сильно выражают восстановительные свойства. Наиболее часто используется NaBH. Например, с его помощью удобно получать летучие гидриды Ge, Sn, Az и Sb на основе хлоридов. Набх также широко использовано в органической химии(главным образом как разбавитель для альдегидов и кетонов к соответствуя спиртам).
Он служит удобным методом получения больших количеств дибола при взаимодействии с BF («в эфирной среде»или BC1>(в dnglnme), подкисление водных растворов происходит с получением водорода (до 2,37 Л / Г NaBH»).Еще больше водорода(до 4,13 Л / Г) можно получить аналогичным образом из l1bh*.LI [BHjCNJ] достаточно стабильного, воздействуя на последний HCN в эфире. Другие соли подобного типа, например KfBHjF, KIBH компания»NCS», к(ЧД»GeHj), на [BHjRe (Колорадо)» также известны. 103) боргидрид M (BH b(M-Mg, Ca, Sr, Ba) является белым твердым веществом.
Подобный по свойствам к борогидриду щелочного металла, немножко неустойчивый к нагревать и более активный как уменьшение agent. Be (BH4)>с низкой стабильностью и высокой реактивностью (mp.91#C) и особенно жидкость A1 в нормальных условиях (BH, b (mp.- 65.mp.+45 * С).Оба этих гидрида Бора бурно реагируют с водой. Молекула, по-видимому, построена на двойной сшивающей связи (типа B2H) между радикалом BH и гидридом BeH2 или A1H. |с параметрами d(BH) — » 1.28.д (БП-з) −1.03.д (Бэб) −1.74.<Ф(ад-Н)- » 2.10, д(АЛБ) −2.15 а).
Триметиламин уже отщепляет BH от acvno «(образование (CH)) SNBH] при комнатной температуре, но Be (BH » h выше 90°C, а борогидрид щелочного металла вообще не действует. 104) перечислил несколько других элементарных борогидридов. Из них белый Zr (BH<) «(mp 29. mp.128°C) и Hf (BH.) » (mp 29, mp.118) можно классифицировать как относительно стабильные. * С), а более или менее нестабильное число-уже более высокая деградация-65 * с желтым Sn (BH«).
Выше −30°C бесцветный AgBH «. Бесцветный кд (БХ»), над 0℃. Зеленый T1 (BH») выше 25°C и бесцветный Zn(BH») t выше 85°C. интересная скважина желтая (Ml (CO)|] ВН » (MP 7878).Это стабильно только при низких температурах. Имеется обзорная статья о двойных гидридах бора и его аналогах (Al, Ga, In)*.
105) B} H «при взаимодействии с амальгамой натрия в эфирной среде реакция протекает по следующей формуле: 2Na-f 2B, N» — NaBH «| + NaB3H. » испарение эфира позволяет отделить соли latter. In помимо растворимости в эфире, он отличается Манила В. И так далее. Скромный успех. IW4, M 7, S3!、 От Набх»и несколько более устойчив к воздействию воды. Было получено несколько других солей того же связывания(в частности, T1B «H«).
Структура ионов B, H ^соответствует сочетанию молекул не-BHJ и BjH4 через 2 водородные связи. 106) растворенный в джигриме NaBH4 может взаимодействовать с избытком гиборана по схеме: 2NaBH «- F BaSH-2NaB, H. для ионов B, H7 предложена структура[H » B — * -H — * * BHjJ и имеются два моста между BH / группой (энергия оценивается в 30 ккал / моль) 1. ^»<адрес>».
107) неизвестное производное В»Н| Mabнhгдегде (M) в свободном состоянии водородного Бора (N (CHJ) J J. NH4.K, Ag) вид соли. Анион, содержащийся в композиции 1B-HB)>, представляет собой октаэдрическую структуру. 108) по отношению к свободному хлору и Брому водород ведет себя аналогично силану(и углеводороду): оба галогена не связываются с боранами, а смешивают атомы водорода.
При избытке диборана реакция протекает по схеме BjHe-fГ » В]Н|Г4-НГ, и образуются продукты замещения с галогенами и множеством атомов водорода. Когда галоген становится избыточным, он полностью замещается -, B, H,+ 6 g «» 2VG,+ 6 Ng. Подобно кремнезему, Боран обменивает водород с Галогенидом, когда он взаимодействует со свободным Галогенидом водорода в присутствии соответствующей соли Галогенида А1.
Например, согласно схеме B, HB 4-NG-H2 + B * H » G. йодистый водород реагирует аналогично без катализатора, но это, по-видимому, связано с наибольшей легкостью расщепления Протона за счет его (VII) 4 добавления. 37). 109) продукт этой реакции, BiH I I представляет собой бесцветную жидкость. Под действием затвердевшей амальгамы натрия при −110 * с ОИ расщепляет йод и образует В«Ню по схеме: 2b > h * i + 2nai4-в4ню.
Эта реакция аналогична взаимодействию галоновых дизъюнктивных углеводородов с металлическим дерном. Миоиобром-диборан-B, H5Br-это бесцветный газ (Мп.-104.Т. Кипячение.- Ф 10°С). Согласно общей схеме «IA B * H» и BBg*, он склонен к самопроизвольному распаду 6BtH » Br-2BBg, 4-5BjH4.Еще быстрее соответствующий хлорид разлагается аналогичным образом(mp.-143.Tp-II * C), продукт, содержащий более одного атома галогена в молекуле. PO)
при низких температурах диборан образует нестабильные продукты состава (CHj) jOBH вместе с диметиловым эфиром. Давление пара составляет 18 мм рт. ст. Уже в парах с −78 * с соединения диссоциируют почти полностью. Диборай вступает в реакцию не с сероводородом, а с диметилсульфидом (Мп.-83, Мп.4-38 * C) реагирует с 53 дополнительными продуктами (CHshSBHj. Пар (давление 4 мм рт. ст., 0 * С)).
Диссоциировать в * C можно только 60%.It интересно, что относительная стабильность подобных производных G была вычерчена (дополнительно 70). В аммиаке водород Бора дает добавочный продукт, подобный белой соли. Взаимодействие диборанов выглядит следующим образом: 4-BTHA (HjNBHjNHt] BH4 (mp 90°С).Основным продуктом в этом случае может быть легко димируемый HjNBH*. Для S04-LljS04-f 2H,-f 2H, NBH, мономера, d (NB) a»1.56 A и-4.88 (во время диоксана) были найдены.
(Точка плавления 94.Точка плавления 171 * C).CHjCN и SiH CN CN ведут себя аналогично, образуя мономеры chjcnbhj и SlHgCNBH. Последнее соединение разлагается при нагревании, и полимер SIH4 устойчив к воздействию воды и кислорода (BH2CN) B. Согласно реакции взаимодействия, Гидразинсульфат в диоксане и гидрид натрия 2NaBH4 4-4 — (N, H») aSO » = Na8S044-2На4-2nah4bh3 бесцветные кристаллы (MP 61°C разложение) nshjbh параметр D (NN)-1.47.J (NB) 1.56 A. C 4.2 (в диоксане).
Пиролиз протекает по схеме 2NSH «BH *» = NaH » 4-2H, 4-BHjNHNHBH и BHjNHNHBH. ,- ■■2Hj 4 — (HBN)>.Оба продукта пиролиза явно являются полимерами. 112) интересна химическая стабильность катионных производных[H * B (NRs) i] *(R-CH / nl-еще один углеводородный радикал).Даже темная HNOj не действует на этот тип бесцветного солнца, несмотря на наличие атомов водорода, с которыми бор непосредственно связан.
Существует обзорная статья о комплексе катоиболона. • 113) с структурной точки зрения наиболее интересным является состав B2H5NH2 (mp.66.Mp.76°C) и B2H5M(CH3) a(mp.- 55.Производное днборана (см. дополнение 83).Кип 50°С). как показывают исследования этих молекул, участвующий в них nht-радикал nln N (CH3) 2 не ковалентно соединен, а водород[d (NB)= 1.55 A] в некоторых диборамбриджах. Так как 3-валентный атом азота содержит свободные электронные пары с дополнительными функциями, то 4 электрона (I от N до B n 3) могут участвовать в образовании мостиков BNB, и нет необходимости прибегать к понятию 3-центиновых связей. Имеется обзорная статья по азотсодержащим производным диборана
114) при низких температурах Днборай реагирует с фосфомой. Он образует бесцветные кристаллы HtPBHt. It будет самовоспламеняться в воздухе. Значительно стабильнее (Снэ)» РВН», (Мп.103 * с).Между тем, FjPBHj(mp.-116.tp. — 62-С) также неустойчив и самовоспламеняется в воздухе. Молекула последнего соединения характеризуется следующими параметрами: tf (PF)= 1,54. Ф (ПБ) 1.84. д (БХ) А. −1.21 ЗФПФ-100°, ЖБХ-115е. Энергия связи P — * B оценивается в 25 ккал / моль. И вращательный барьер вдоль него составляет 3,2 ккал / моль. Интересно, что FjHPBHj (bp 6°C) гораздо более стабилен, чем F » PBHj. В отличие от тритерпена, NFj не взаимодействует с Днбораном.
Влияние аммиака на FjPBHi в эфирной среде было стабильным в воздухе(HtNhPBH *. мы показали значения tf (NP) −1.66 и J (PB)= 1.89 A. высокая химическая стойкость характеризуется [(CHs) 2N} «PBH».он не реагирует с разбавленными кислотами и перегоняется паром без разложения. В его состав входят не диоиор-акцепторные, а обычные ковалентные R-V связи. Высокостабильный химически инертный циклический тример [(CHj)| PBHa) j. для аналогичного тетрамера приведены следующие структурные параметры: J (CP) −1.84, d(PB)= 2.08 A. ZPBP-104°, ZBPB = 125 *
115)в связи с различным отношением к pfv-максимальное прямое напряжение на НФ, результаты исследования молекулы (CHJ успешно) ТНП (Фдж) Биг И (Ч|) | НП (Ф|) БФ |интересные. Первый из них-соединение R V, а второй-соединение N B. 116) водород мышьяка не взаимодействует с гибораем, но(CH3)»pr −78°c образуется (CH>)* A $ BH».Это белое твердое тело (Мп.74 * C) начинают медленно разлагаться, когда он превышает 120°C. Многие производные днборана также известны, включая as_b, геоакцепторные и нормальные ковалентные связи.
Последний будет менее долговечным, чем подключенный R_B. 117) в смеси днборана и монооксида углерода равновесие устанавливается по следующей схеме: его молекулы полярны (q■■1.80) и характеризуются следующими структурными параметрами:< / (OS) −1.13, J (CB)- 1.54, ТФ (ЧД) — И. I9A. ZHBH-114е. Энергия с-Б донорно-акцепторной связи составляет 19 ккал / моль. Его длина примерно равна same. As с обычной ковалентной связью C-C облигациями. Для постоянной силы сцепления приведены значения k(BC) 3.0 и a(CO)— 17.3.Вода, согласно схеме 0CBH5-f3H20 =»»CO + 3H2-f B (OH), медленно разлагает карбонил борогидрида.
Аммиак образует твердый продукт присоединения [очевидно (NHOfHBCO).Затем триметиламин заменяет CO на форму (CH|) ’ NBH. Обратите внимание, что получить OCBF невозможно. С. С.. Успех и Shito * O. P .. Иоффе С. Л.. Тарта о» * М. А. В. А. Но » 5 мая. 197B. M II, 1913. * Б * * •ь г***.Ф. Кох и * Ва Л. Н. Hminm, успех. 1954. Ю. НК 1267. 118) если нестабильный газ взаимодействует с монооксидом углерода (давление йода), реакция будет иметь уравнение В$Нц + 2со — = ocbhjосв4не. Образовавшийся 2-й продукт получают реакцией B H Hio-fCOeHj-fB4H8CO.
It представляет собой бесцветную жидкость (Мп.- 110, Мп.60°C) и реагирует с водой или (CH>) jN без высвобождения CO. Подобно CO, BHHc взаимодействует с PF ((под давлением) — F PB PB PBH9 и B H H P PF образуются).Известны также некоторые другие карбонильные производные Боранов, например Cun (COb и B | 3Hio (CO)), летучие и высоко термостабильные. 110) Наб3ту (doi.105) и взаимодействие с хлоридом аммония в эфирной среде, реакция протекает согласно: NHC CI-f NaB, Hs-NaClJ + M> -f Hjnb jhj.
Полученный продукт из аммиака irisonecea (то есть B, H » — F-BH3) до неизвестного BjHy в отдельных состояниях может быть отделен испарением эфира, а затем очищен дистилляцией при 40-50°С в вакууме. Бесцветное кристаллическое вещество (Мп.74 * C), оно стабилизирован в воздухе, очень soluble в эфире и разложен очень медленно водой. Молекула хинбжх? Вероятно, он имеет треугольную структуру атома Бора, и молекула NH * прикреплена к 1 из его вершин.
Возможно, 1 из сторон этого треугольника образован B-B ковалентными связями (B2H»), остальные 2 являются водородными-молекулы VN NH присоединены к атому Бора. Длина связи донор-акцептор переменного тока N- * B оказалось равным 1,58 A. In жидкий аммиак, HjNBjHt растворяется без разложения, а йод разлагается с (CHj) jN с образованием твердого остатка, который разрушает (CHj) jNBHj и hydrogen. At в то же время, (CH3) jNBjH7 также известен. Аналогичное производное диметилового эфира ((CH} LOB5I7) интересно тем, что BjH4 (PFJ) J является 1 из продуктов взаимодействия с PF3 iri −15®С.
120) аммиачный триборай доступен на основе Тетраборана. Эфирная среда и аммиак, за счет взаимодействия с Кристаллом образуется (В Н2В(ННз)з)) Н это. Последний реагирует с HCl в эфирной среде по схеме 1H B B (NH HH] B Ht + HCl (H, B(NHj) i) Cl | — fH, — fB, Н, и остальные эффекты. Триборановый эфир заменяется аммиаком: (CjH ^ jOBjH,■+ NH> = HjNB, Hy + +(CjH«) aO. Iri 0°C реагирует с тетраборантом Индия по схеме: B «Н / в+ 3C $ H, N— 2CsH „Nkhj-f C * HsNBaH“. 121) B » H7 и B «H» (то есть BjH » — f-BjH.) как продукт частичного замещения водорода, l(CH.) 2NbB, H, (mp 95°C) и [(CHj) 2N] 2B <H *(mp 15°C).
Оба эти вещества были получены взаимодействием BH и (CH3) fNH. В нормальных условиях он устойчив к воздействию воздуха и воды. Когда образуется нагретый б «ч»с избытком (CHJ успешно) ин 2 молекулы (CHJ успешно) jNBH несколько. А остальные б) н / полимеризуются. 122) с изогнутыми трубками H, NBH, нагретыми до 200°C, образуется требоборин Трилинейный-B, N, H4.Последний представляет собой бесцветное жидкое вещество (Мп.-56, депутат.+55°С).
Молекула BsNsH * имеет шестиугольную форму с чередованием BH и NH (J (BN) » 1.44.Д(БХ)= 1.26, РФ (Нью-Хэмпшир) — 1.05 а, ZNBN-118 *.ZBBB =1211.Для энергии связи B-N задается значение 106 ккал / mol. It интересно, что кажущаяся симметричной молекула BSN » H «имеет» диаллический момент» и «0.50» (в бензоле).Это, вероятно, связано с отклонением связи N-H от шестиугольника (или не последней структуры последнего. Триимин (иначе бор-ацил или бор-и) является «неорганическим энзолом» из-за его сходства по структуре и некоторым физическим свойствам с бензолом.
Следует отметить, что эта аналогия часто встречается overestimated. So, в отличие от бензола, боразол неустойчив к воздуху и разлагается медленно, даже если его не хранят. Кроме того, в отличие от бензола, BjNaH характеризуется «адгезионной реакцией» (обычно 3 другие молекулы на молекулу боразола). Присоединяйтесь к Airier, HCI, HBr, NU. Чжо, с, ч, О. Борасол растворяется в воде и гидролизуется ею (очень медленно на холоде, быстрее, чем при нагревании)
Образование»NH» OH Hb (OH). в общем, разорвать этот цикл несравнимо легче, чем при использовании бензола. Например, такие разрывы легко происходят под действием щелочи. Известно много производных боразола. Некоторые атомы водорода были полностью замещены различными органическими радикалами. Некоторые из соединений этого типа могут представлять интерес в качестве реактивного топлива.
Было получено замещение тринодинида-B, (NCS) jN » H, (mp 178 * 0.Существует обзорная статья о Bora EOL и его производных. 123) Галоид боразола вытесняет только водород атомов бора. G e. действие хлора получается только в B * N «HaCl».Полный хлорный аналог боразола-B, NjCl#(mp 177 * C), синтезировали по схеме: 3BC1j-f 3NCU™1 6C1 ″ + BjNjCle. Эта реакция интересна как пример синтеза различных зарядов хлора (B-NC1 B-f из BC15). 124) возн, С.
Он получен взаимодействием B9N9Ha-3HCl и NaBH4 (в zigrim).Его структура соответствует 6-членному кольцу (образованному при участии донорно-акцепторной связи).Это бесцветное кристаллическое вещество устойчиво при нормальной температуре, а при 150°С оно медленно разлагается, не плавясь. B) Когда вы печатаете H, » NfH » становится нерастворимым(он не промокает). он хорошо растворяется в некоторых органических жидкостях (таких как ацетон и дягиль) и жидком аммиаке.
Из продуктов пиролиза боразола при 300-500°с выделяли многие борареотропиды-B»N» H, (mp 30°C), BeNeH, e (mp 60 eC). V9M9N,. Брррхио, Бен ХН. Структура и свойства этих соединений до сих пор не изучены. 125) соединение типа BjRsOs («бороксол») или BtRsSj («сульфон Бора») получают (R является одновалентным радикалом), если место радикала NH в 6-членном цикле боразола занято атомом O или S.
Вещества этой структуры известны для многих различных R. их примерами являются B>(0CH)* 0, (mp 10 * C) и Б(оч), СС (Мп 28°С). 126) простейшим представителем соединений первого типа (R-H) является «оксид Бора» — HjBjO. It получается взаимодействием водяного пара со смесью B + B / 09 прям 1050 * C и последующим быстрым охлаждением газовой фазы до −85 * C. ее молекула составляет d (BO) 1. 1.38 ■ s /(BH) представляет собой плоский шестиугольник −1.19 A. твердая бороксия разлагается по схеме:2H * B> Oa2B, Oe + BjH«.
Через взаимодействие в парах с HC1, hjcibjoj формируется последовательно. HCljBjO, and. At последний. B3o3cu (добавлено 44).примером плоского точечного цикла, такого как бороксин, является Полярная молекула H9B90 «(Q»-0.95), в дополнение к связыванию HV и BO. Между 2 атомами кислорода существует прямая связь [</(00) 1.47 A]. 127) B » H «- продукт длительного действия Тихого разряда в смесь пара и этилена в результате вакуумной перегонки родственного C * B » H. многие члены 4S были отделены.
Первый из этих «карбора и ОВ» — ЦСБ9Х » (Мп.-126, Мп. ВР.-4 * С) изучался лучше других. Его молекулярная структура соответствует трехсторонней пирамиде с 3 радикалами BH в основании и 2 радикалами CH на вершине. Следующие термины, C2B-термин Lc, имеют структуру тетрагональных пирамид и были получены с 2 изомерами (транслокационные положения CH-групп).
От продуктов, образовавшихся в результате спуска Пента-Боран-метил пара. Выделяли композицию CB * H7 Cdrboran. Для него была предложена восьмигранная структура.1. одна из его вершин занята атомом углерода. Известны некоторые хлорзамещенные карбораны. Пример: С, В, ес, еС1 ″ (Мп.448 * С).Есть обзорная статья о поликарво. •• 128) наиболее интересные получены на основе композиции де хаволла и карболая С, б, «ч|,» («Бари»).
Его молекулы имеют замкнутую структуру из 20-ти сторонних тел, образованных группой BH CH. It представляет собой кристаллическое вещество. •МяааЯоо * V. М.. камяя успех, 1м 0. * С. 872. М. корон В. В.. Сара вин и, ГЯ й ■ га х к ф. Собоя «» СКА / м. в.. Урна Usaahya, 1 * 7, F 12, 20 «、 (член парламента.300°C) запах камфорного дерева. При нагревании до 475°C, Буррен будет» yobarea » навсегда. Икосаэдр (РНС. XI-5) углерод m — > l -.
Замена хлора на все 10 атомов водорода группы BH приводит к очень высокой положительной характеристике водорода группы CH, и B, oc1iocjhjj становится типичной двухосновной кислотой. Устойчивость обнаженного ядерного ядра и способность к различным реакциям замещения связанных с ним атомов водорода, в какой-то мере сходная с химией бензола, является более исключительной, чем положенная в основу развития широкого спектра химии этого вещества.
129)как видно из всего вышесказанного, химия боргидрата и производных, полученных из природы, а также обилие их способности к синтезу приближается к органической chemistry. It это очень интересно, но экспериментально сложно, потому что не укладывается в рамки устоявшейся теории валентных структур, во многом аномально, так как позволяет включить в единую интерпретацию не только все остальные элементы, но и неводородные соединения самого Бора.
Это почти не означает общего несовершенства современных теоретических концепций и необходимости радикальных изменений в них. Скорее, можно было бы подумать, что причина заключается в недооценке некоторых особых обстоятельств, присущих молекуле о-дефицита electrons. In иными словами, речь, очевидно, должна идти о перестройке всей сложившейся системы представительства и некотором расширении ее.
Эта ситуация аналогична ситуации в конце прошлого рубежа, когда кризис классической теории валентности возник из-за накопления экспериментальных данных по»соединениям высшего порядка»(комплексам).как известно, этот кризис был разрешен отказом от теории валентности и дополнением ее теорией координации (сначала она была чисто формальной, так как физические свойства»боковой валентности»не были ясны).
В этом случае классическая теория валентной связи 2-х цепей дополняется идеей о возможности наличия 3 и более центров s-zeys. Это выражение применимо только к тем частям структуры молекулы дефицита электричества, которые не укладываются в рамки обычной валентной теории(например, B-H — B — B связи).Концепция многоцентрового связывания-молекулярная орбиталь (VI f 3 add.14), так что этот подход по своей сути является народным.
Отражает ли это физическую природу проблемы (или это форма объяснения), до сих пор? Следует отметить, что полный переход к молекулярно-орбитальному методу решает эту проблему. Прежде всего, метод МО ограничен в своих практических возможностях (по мере увеличения атомарности молекул быстро усложняется построение системы орбиталей). в то же время ОИ обеспечивает интерпретацию всей молекулы, но для химии свойства отдельных комбинаций атомов(валентных связей) имеют первостепенное значение.
130) сравните среднюю длину и энергию связи Бора со следующей: С.» ………….. в-в Б-Б-Б-О Б-Ы Б-Н Б-С Б-Б1 Б-БГ-си-я Длина«, А………….. 1.72 1Д> ИСИ 1.38 1.42 1.56 1.30 И. 7С 1DG 1.10 Ежи. поставить! моль……..«164108 ю» 79 91123100 6 Приведенные данные представляют собой простую ковалентную связь бора с координационным числом 3. Переход к 4 номерам регулировки длины Растворение (ср. Х§ 2 Добавить.19).
И энергия уменьшается. Например, длина связи B-O составит 1,47 а, а ее энергия-96 ккал / моль. Аналогично, средняя длина n — * — B донорной акаптриевой связи (за счет ее образования координационное число Бора увеличивается с 3 до 4) составляет 1,58 А. Также необходимо соблюдать осторожность. Значение 106 ккал / моль связи B-N относится к боразолу и его производным, тепловые данные BtN(от CHjhb(mp — 158°C) до энергии связи B-N[d (BN) » −1.43 A) рассчитываются равными 90 ккал / моль.
Смотрите также:
| Подгруппа титана | Алюминий |
| Третья группа периодической системы | Физико-химический анализ |
