Оглавление:



















Алюминий
- Алюминий занимает 4-е место по распространенности (после O, H, Si) в природе и составляет около 5,5% от общего числа атомов в земной коре. В истории геохимии алюминий тесно связан с кислородом и клеем. Его основная масса сосредоточена в алюмосиликатах (х§ 4).Очень распространенным продуктом разрушения пород, образованных этими минералами, является глина, а ее основной состав (соответствующий каолину) соответствует формуле Al20r2Si02-2H20.
- Среди природных форм нахождения алюминия наибольшее техническое значение имеют бокситы (A120z-l: H20) и криолиты (AlF3-3NaF)!-3 этот процесс осуществляется в специальной электропечи при температуре около 1000°С, кислород выделяется с анода, а жидкий алюминий-с катода. Последние собираются на дне печи и периодически выпускаются. высокая проводимость составляет около 0,6 от проводимости меди.
Алюминий 4 * » 7 представляет собой серебристо-белый, слегка твердый металл с плотностью 2,7 г / с, плавящийся при 660 и кипящий при 2520°С. Людмила Фирмаль
Применение алюминия в виде различных сплавов значительно шире, наряду с хорошими механическими свойствами, что характеризуется его легкостью. Особое значение имеет так называемый дюралюминий (примерный состав: 94% A1, 4% Cu, 0,5% Mg, Mn, Fe, Si соответственно). Oi ценен тем, что изделия с одинаковой прочностью почти в 3 раза легче железа.
Продвижение металлоконструкций имеет большое значение для многих технических направлений, не говоря уже об авиационной промышленности, где легкость материалов особенно важна. Это становится особенно очевидным, если учесть, например, что в груженом грузовом вагоне около 3 минут 1 общей массы приходится на материал, составляющий вагон, а в легковом вагоне ее собственный вес падает до 95% от общей нагрузки.
Очевидно, что даже частичная «замена» стали дюралюминием имеет огромное технико-экономическое значение effect. In в связи с этим, а также из-за наличия практически неисчерпаемых запасов алюминия, его иногда называют «металлом будущего».Возможности для него широко и частично заменить железо, являющееся основным металлом современной техники, во многом ограничены относительно дорогим алюминием.
14> 16 В воздухе алюминий покрывается тончайшими очень плотными оксидными стержнями, что предотвращает дальнейшее попадание металла oxidation. In в связи с этим его поверхность обычно матовая, без блеска. Когда тонкоизмельченный алюминий светится, он горит в воздухе. Аналогично происходит взаимодействие с серой proceeds. In в случае хлора и брома соединение происходит уже при комнатной температуре Круглые, с йодом-когда heated.
At очень высокие температуры, алюминий также связывает сразу с азотом и углеродом. Напротив, он не взаимодействует с водородом. По отношению к воде алюминий практически полностью стабилен. Сильно разбавленные и очень сильные HN03 и H2S04 мало влияют на алюминий, но постепенно растворяются в умеренных концентрациях этих кислот. Что касается CH3COOH и H3P04, алюминий стабилен. Чистые металлы также очень устойчивы против соляной кислоты, но обычные технические металлы растворяются в ней(рис. XI-11).
Алюминий легко растворяется в сильной щелочи (NaOH, KOH)за счет реакции. 2Л1+ 2NaOH +6Н20=ЗН2-f 2na [al (oh) 4] Он также очень энергично разъедается раствором NH4OH. In ряд напряжений, A1 находится между Mg n Zn. Со всеми стабильными соединениями он является трехвалентным. Сочетание алюминия и кислорода сопровождается гораздо большим количеством тепла, чем во многих других metals. In ввиду этого при раскалении смеси оксидов таких металлов с алюминиевым порошком происходит бурная реакция, которая приводит к выделению свободных металлов из взятых оксидов.
Метод восстановления с применением Л1 (алюминий термометра) часто применяется для получения некоторых элементов (хрома, марганца, ванадия и др.) в свободном государстве. Глинозем представляет собой очень тугоплавкую белую, нерастворимую в воде массу. Природный L1203 (минерал корунда), полученный искусственным путем, не только сильно кальцинирован, но и характеризуется отличной твердостью и нерастворимостью к кислотам.
Глинозем может быть переведен в растворимое состояние сплавлением со щелочью или K2S2O7 в зависимости от реакции A1203 + 2 NaOH = H20 | + 2NaA102 A1203 + 3K2S207 = A12 (S04)3 + 3K2S04 Природный Корунд, обычно загрязненный оксидом железа, благодаря своей чрезвычайной твердости используется при изготовлении шлифовальных кругов, шлифовальных кругов и др. Для этой же цели часто используется глинозем, полученный сплавлением бокситов(технические названия-alu и d).23-31
Поскольку А1203 не растворяется в воде, гидроксид, соответствующий этому оксиду[L1 (OH) 3], может быть получен только косвенно (начиная с физиологического раствора). это большое количество студенистого осадка белого цвета, практически нерастворимого в воде, но легко растворимого в кислотах и сильных щелочах. Поэтому гидроксид алюминия является амфотерным. Но его основные, особенно кислотные свойства, выражены довольно слабо.
Если он превышает NHtOH, гидроксид алюминия становится нерастворимым. При взаимодействии A1 (OH) 3 с сильной щелочью образуются соответствующие алюминаты, например, по схеме. NaOH + L1 (OH)s = Na [AI (OH) 4] О G, II II. РНС. XI-11-влияние примесей на скорость растворения алюминия в соляной кислоте. Алюминаты наиболее активных одновалентных металлов в воде очень растворимы, но при сильном гидролизе их раствор стабилен только при достаточном избытке щелочей.
Алюминаты, полученные из более слабых оснований, практически полностью гидролизуются в растворе, поэтому их можно получить только сухим способом(сплавлением А12оа с соответствующим оксидом металла).Большинство из них нерастворимы в воде. При использовании кислот A1 (OH) 3 образует соль с бесцветным A1-Ионом в растворе. Большинство производных сильных кислот легко растворяются в воде, но они сильно гидролизуются, поэтому их растворы проявляют кислую реакцию.
Многие из них (например, AI2S3) полностью разлагаются водой. В серии бесцветных галогенидов алюминия AIF3 значительно отличается от своих аналоговых свойств. Фторид алюминия представляет собой тугоплавкий кристаллический порошок, полученный сухим способом (например, нагреванием Al2O3 в HF паре).Практически нерастворим в воде. Соединения алюминия с хлором, бромом и легкоплавким йодом обладают высокой реакционной способностью, они хорошо растворяются не только в воде, но и во многих органических жидкостях.
Взаимодействие безводных галогенидов с водой сопровождается значительным heat. In раствор, они все очень гидролизованы. A1c13, A1Bg3 и AP3 дымят во влажном воздухе (из-за гидролиза), потому что они заметно летучие в нормальных условиях. С большим количеством солей галогенидов одновалентных металлов галогенид алюминия в основном образует комплексные соединения типа M3 [AlFe] и M [A1GL(G = C1, Br или I).Тенденция реакций присоединения обычно сильно выражена в рассматриваемых галогенидах.
Благодаря этому наиболее важное технологическое применение AICI3 связано с катализатором переработки нефти и органического синтеза. 47-61 Сульфат алюминия бесцветен и легко растворим в воде. Обычно его отделяют от раствора в виде кристаллогидратов Al2 (SO<) 3•I8H2O. In во многих 1-валентных сульфатах металлов сульфат алюминия образует бесцветный комплекс типа M [A1 (SO)] — 12H20.Будучи очень стабильными в твердом состоянии, эти соли (т. е. квасцы) в растворе сильно диссоциируют на отдельные ионы, которые составляют them.
In помимо алюминия, сложные квасцы сульфаты известны также для многих других трехвалентных металлов(Cr, Fe, V и т. д.). В качестве одновалентного катиона (M) он включает K+, Na+, NH+ и др. Среди других производных алюминия следует упомянуть соль уксусной кислоты[A1 (CH3COO) s], которая используется в крашении тканей (как протравитель) и в лекарственных средствах (лосьоны и компрессы).
Эта соль обычно получается непосредственно в растворах [из A1 (OH) 3 и CH3COOH] и сильно гидролизуется. Нитрат алюминия легко растворяется в воде. Фосфат алюминия нерастворим в воде (и уксусной кислоте), но растворим в сильных кислотах и щелочах. Добавь I) первое отделение элементарного алюминия(по схеме A1С1з+ЗК = зкс1 + А1) относится к 1825 году, но больше.
Только в 1827 году, когда были впервые открыты первые свойства этого элемента, был получен образец с низкой степенью чистоты. Технически получено Затем, в зависимости от реакции, NaAlCU + 3Na = 4NaCl-f Al. Долгое время он ценился выше золота. Природный алюминий состоит только из атомов t7Al. То есть это» чистый » элемент. 2) в основном состоянии атом алюминия имеет внешнюю электронную оболочку 3 * 23r и является одновалентным.
Возбуждение до трехвалентного состояния (zzp*) требует затрат 83 ккал / г атомов. Непрерывная энергия ионизации атомов алюминия равна 0,98. 18.82 и 28.44 эВ. Его сродство к электронам составляет 12 ккал {г-атом. 3) несмотря на наличие большого количества алюминия в почве, растения обычно содержат очень мало этого элемента. Его содержание еще ниже у животных organisms. In люди, это только 1 миллион к 1 его веса.
Биологическая роль алюминия не была выяснена. Соединение не обладает выраженной токсичностью. 4) поскольку очистка алюминия от примесей затруднена, необходимо очистить само сырье, чтобы получить его. Krnolnt обычно получают искусственно путем совместного растворения он-соды в плавиковой кислоте (в зависимости от реакции: 3Na, COj + 2Al (OH) 5 + I2HF = 2NasAIF » — fЗСОа + 9нго). 60%от А1?Oe и многие примеси (SiO2, Fe2Oj и др.) подвергаются предварительной химической обработке для извлечения из них достаточно чистого глинозема (в том числе sioj менее 0,2% и 0,04% Fej03).
Источник бокситов и очень сложный. 5)в криолитовом расплаве (Мп 1012°С) равновесие происходит в основном по суммарной схеме Na3AlF * * 3Na + — f 2F — + AlF^.Дальнейшая диссоциация тетрафторалюмината Yo-yah протекает в значительно меньшей степени: AlF4 * * F «+ — f AlFj * * 2F — + AIFJ * * 3F—f AlF,+ * 4F» — F A1,+.Глинозем, растворенный в криолите, диссоциирует по следующей схеме: Al20, * * АУ * — F AIOJ. Поскольку между образующими ионами возможны вторичные реакции (например, F «+АУ+ ** FA10), молекулярный состав ионов в растворе abo3 в расплавленном криолите очень сложен.
Самая низкая температура плавления (665 ° С) достигается в системах, учитывающих следующий состав: 58%криолита, 37%AlFj, 5% AUO . в)показана принципиальная схема. Электропечь ХГ-12 для выплавки алюминия состоит из ящика из чугуна, внутри которого уложен теплоизоляционный слой из термостойкого материала, поверх которого расположена толстая углеродистая футеровка К, которая при электролизе выполняет роль катода. Блочный углеродный электрод а используется в качестве анода, и процесс протекает при температуре окружающей среды 960°C, напряжении около 5 в, силе тока около 14 млн.
А. образующийся кислород образуется с углем CO n CO anode. In параллельно, небольшое количество CF4 получается из-за незначительного выделения фтора. При сгорании анода его необходимо постепенно понижать. Боковая стенка печи (большая часть поверхности жидкости) покрыта твердой наружной коркой электролита, что предотвращает коррозию Газамун, выпущенный из анода, защищает расплав от охлаждения. Во время работы печи в печь периодически добавляют А120(и небольшое количество криолита), который удаляет расплавленный металл. Выплавка алюминия очень энергоемка.
На 1 тонну металла требуется около 16 000 кВт-ч электроэнергии. Его основная очистка осуществляется продувкой хлором. Обычно, продажа металла включает 99,7% алюминия. Наряду с другими примесями (в основном Si и Fe), он содержит следовые количества галлия. 7) промышленный алюминий обычно промывают электролизом 3 Ликвидусных систем 8 при температуре 710-740°C. Net алюминий действует как катод(плотность Рисунок XI-I2.Алюминиевый алюминиевый контур электропечи. 2,35 г / см), электролит-расплавленная смесь солей плотностью 2,7 (60-BaClj, 23-AIFj, 17% — NaF).
Анод представляет собой оригинальный алюминий, который добавляет до 25% меди для увеличения его плотности(это делает плотность 3,3 г / см). в этом 3-слойном электролизе металл (Cu.Например, га).Они не проходят в электролите,но тот, что на левой стороне, не заметен на левой стороне. cathode.In таким образом, алюминий становится более 99,99% чистоты и может быть дополнительно очищен, если это необходимо, например, методом растворения шпульки (X§6, стр. 18). 8) на 6000.
Алюминиевый порошок может быть превращен в компактный металл путем приложения давления к металлу.Его сжимаемость относительно невелика(от объема до 10 тыс., равна первоначальному 0,92), а электрическое сопротивление незначительно уменьшается с увеличением давления (от обычного примерно до 0,8, около 5 млн).при выплавке алюминия плотность падает с 2,55 до 2,38 г / см.
Теплота плавления составляет 2,6 ккал / г атомов.Когда давление повышается, температура плавления повышается довольно быстро (от 2 миллионов до примерно 100°C).Теплота испарения составляет 70, теплота сублимации (25°С) — 78 ккал / г atoms.In пары, алюминий одноатомный. 9) в дополнение к алюминиевым применениям, показанным в тексте,он широко используется в производстве бытовой утвари, нефтяной промышленности и производстве труб для разбрызгивателей,а также в сборных башнях для хранения зерна, наружных крышках электрических проводов (вместо свинца) и т. д.
Так как он в 4 раза дороже железа, то начинает конкурировать с оловом при изготовлении банок.Благодаря своей высокой теплопроводности(почти в 3 раза превышающей теплопроводность железа) алюминий особенно подходит для строительства различных теплообменных установок. При 100-150°С можно получить фольгу толщиной менее 0,01 мм, поскольку она пластиковая.Аналогичная фольга используется для производства электрических конденсаторов и для упаковки некоторых продуктов.
Чистая алюминиевая поверхность отражает около 90%входящего в нее излучения(не только видимого, но и инфракрасного и ультрафиолетового).Поэтому нанесение алюминия на стекло (с помощью вакуумного испарения) позволяет получить высококачественные зеркала, которые очень равномерно отражают лучи различных длин волн.
Старение тканей в глубоком вакууме через жидкий алюминий сопровождается металлизацией (без потери воздухопроницаемости). помимо других применений, такие металлизированные ткани в сочетании с черным помогают контролировать температуру (U§1).14).Например, 2-слойный плащ будет держать ваше тело в тепле, если вы носите его с металлической стороной наружу (когда жарко), защищать ваше тело от перегрева и с черной стороной (когда холодно).
Мелкодисперсный алюминиевый порошок используется в производстве атмосферостойкой серебряной краски, а также в качестве добавки в некоторые виды реактивного топлива.Используя алюминиевую стружку, можно наклеить прозрачную надпись на стекло (раньше оно было нежирным и слегка влажным). 10) пайку алюминиевых изделий(после механической очистки поверхности) можно проводить с использованием сплава 60%Sn + 40%Zn или 60%Zn + 40%Cd.
In в этом случае смесь 8,6% NH4BF4 действует как хороший флюс. 5.0-Cd (BF4) 2 и 86.4-trimethoprimine-N (CH2CH2OH) j (масло с температурой кипения 150 мм рт.ст. при 278°С). также рекомендуется предварительно протереть область пайки насыщенным раствором CuClj, а затем выполнить пайку обычным способом. 11) соответствующий пенообразователь можно получить ПЭО алюминия («фомалюм») путем добавления к расплавленному алюминию (например, MgHj) и заливки в полученную форму.
Микропористый металл с плотностью 0,4 г / см, пригодный для механической обработки.Детали из него можно закрепить даже гвоздями. 12) алюминий можно использовать для выпрямления AC.Выпрямитель состоит из небольшого (на поверхности) алюминиевого и относительно большого свинцового (или железного) электрода, погруженного в раствор буры (100 млн.(NH)) 2coj 10% раствор].
Такая система может выдерживать напряжение до 40 bp, пропуская ток только в одном направлении, где A1-это anode. To выпрямляя ток более высокого напряжения, алюминиевый выпрямитель подключают последовательно(для получения достаточной силы тока-параллельно). 13) важной областью применения L1 является т. н. насыщенная поверхность литровых и Е-стальных или чугунных изделий с алюминиевым металлом, что придает им термостойкость и антикоррозионную защиту.
Глаз обычно проводят при температуре 49°С в смеси порошкообразного алюминия (49), оксида алюминия (1000) и хлорида аммония (2%).Эти продукты можно нагреть до 1000°C, не опасаясь окисления. 14) в дополнение к дюралюминию, многие другие сплавы на основе AI также используются в этой технологии. Среди них mn (10-14% Si) используется в производстве различных механических parts.
It стоит отметить прочность 0,1-Na) и гидропараз (3-12 мг).Устойчив к воздействию морской воды. Алюминиевый сплав с очень высокой коррозионной устойчивостью, включая и Мг и Си. Основной материал для изготовления вертолетных винтов. 15) мировое производство алюминия в 1885 году достигло только 13 g. In 1900, 7000 г, в 1935-26 млн тонн, в 1950-130 млн тонн, а сейчас ежегодное производство составляет около 800 млн тонн (за исключением Советского Союза).
16) оксидная пленка, образующаяся на поверхности алюминия в атмосферных условиях, обычно имеет толщину менее 10’v см (т. е. 100 А), но очень плотно связана с металлом. Искусственно полученная пленка под действием окислителя значительно толще. Например, хорошую защитную пленку можно получить, погрузив алюминий в раствор, содержащий 20% NajSO *и 10% HNOj.
С помощью подходящего наполнителя можно придать этим пленкам другой цвет. 17) напротив, после контакта алюминия с раствором HgClj эта пленка становится очень рыхлой и перестает защищать металл от дальнейшего воздействия oxidation. As в результате он быстро растет на «подбородке» (AhO $ -xHaO) из водного окна и постепенно полностью окисляется. Полученный водный оксид n сам по себе после обезвоживания нагреванием проявляет высокую адсорбционную активность.
18) приведенные в тексте данные о действии кислоты на алюминий находятся в нормальном состоянии. При нагревании сопротивление значительно увеличивается reduced. In в частности, при кипячении алюминия в разбавленном растворе некоторых органических кислот необходимо избегать возможности выраженной растворимости алюминия.
19) легкость расплава алюминия до сильнощелочного, ABO3 + 20H ZNgO f = «2A1 (OH)<. при ряде напряжений A1 находится далеко слева от водорода, поэтому экспонирование чистой металлической поверхности сразу сопровождается реакцией по схеме: 2A1-f6H *(от воды)-2A1- + 3Ha и 2AI- + 80H» 2A1 (OH) {.Равновесие первого НС всегда смещается вправо на 2-е NS. In таким же образом происходит растворение в щелочах и других активных металлах. Свой гидро экран гермафродит (Sn.
Вы также можете использовать его в качестве инструмента, чтобы узнать, что происходит. Переход A1 * 5 + Ze = A1 соответствует обычным потенциалам-1,66 в (кислотная среда) и-2,31 в (щелочная среда). 20) результирующая теплота А1203 от элементов составляет 400 ккал / mol. By при сжигании алюминиевого порошка в потоке кислорода получается пламя с температурой до 3500 ° С.
На этой основе был построен «огненный нож», который образовывался пламенем из смеси алюминиевого порошка и железного порошка, взвешенного в кислороде, и вылетал (под давлением) из длинных стальных труб. С помощью такого «ножа», в частности, можно было резать бетонные блоки толщиной не менее 3 метров.
21) обычно приготовление в лаборатории свободных элементов методом алюмо-сами осуществляется с помощью шамота TTE 堝, помещенного на слой песка (рис. XI-13).Внутри Тигля помещают мелкодисперсный порошок металлического алюминия и смесь соответствующего оксида (/1).И на вершине этого есть слайд смеси AI + BaO? Металлическая магниевая лента была проколота и воспламенилась. Сверху все засыпает Порошкообразный CaFa (B).он плавится во время реакции и образует слой, который изолирует реакционную смесь от внешнего пространства.
22) алюминотермия также иногда используется для сварки отдельных стальных деталей, особенно на стыке рельсов трамвая. Используемая смесь («Термит») обычно состоит из тонкого порошка алюминия и оксида железа (FejO). Он воспламеняется с помощью предохранителей из смеси A1 и BAOA. Основная реакция протекает по формуле 8A1 +3Fc30a= 4L1203 + 9Fe + 800 ккал, в результате чего температура составляет около 2500°C. In кроме сварки, термиты используются для переплава стальной стружки (отходов металлургической промышленности).
23) чистый глинозем (точка плавления 2050.Тигли.3500°с) используется непосредственно при изготовлении зубных протезов cement. So разновидность порошка высококачественного зубного цемента получают сплавлением при 700-800°с и измельчением тщательно приготовленных смесей следующего состава: 28,4 ′ 3 A13Oe. 20.9-SiOj, 19.7-NajSiFe, 19.0-CaSiFe. 3.9-CaCOj, 4.1-и » P04.«4.0-Ч Асо. Диаграмма XI 13.. Ла-жидкость для замешивания такого цемента креп- Бо? A1 Торический раствор (H2P04) A. R G * ’S установка элек. МО; е |: сии.
24)расплавленные продукты глинозема имеют плотность 4,0 g / cm}, имеет очень высокую механически прочность и задерживает до 1800°C. химическая устойчивость очень высока. Но они хорошо проводят тепло и выдерживают температуру fluctuations. By распыляя расплавленный глинозем, можно создать эффективное защитное покрытие на металле.
25) сплавление aljoj и SiOt одинаковой массы с последующим продуванием расплава привело к получению стекловолокна («Fiberfrax»), характеризующегося высокой термостойкостью и отличной устойчивостью к химическим воздействиям. Свойства изменяются до 1250°C, плавясь только при температурах выше 1G00 CC, что особенно подходит для производства теплоизоляционных материалов. 26) на основе корунда был создан твердый искусственный камень «Микролит». built.
It состоит из очень мелких (порядка Микрона) частиц корунда и небольшого количества стекловидного связующего материала. Резец Microlite держит весьма твердость до 1200 ° C, которое позволяет для очень высокоскоростной обработки металла. 27) прозрачные кристаллы корунда, красиво окрашенные с малейшими примесями других веществ. Известны также драгоценные камни: красный, рубин (цвет от примесей хрома), синий сапфир (следы Ti и Fc) и так далее on. At настоящие, драгоценные камни (рубины, сапфиры и др.), которые основаны на оксиде алюминия, сплавляются и впоследствии изготавливаются искусственно.
Кристаллизация Al2O в присутствии подходящих примесей. Такой искусственный камень по своему качеству лучше натурального. 28) идея оптического квантового генератора (*liera>) впервые была реализована с помощью кристалла рубина-устройства, создающего в видимой области спектра или вблизи нее пучок излучения одного цвета (то есть определенной длины волны 1).Работа лазера(и связанного с ним»Мазера», который производит пучок подобных коротких радиоволн) основана на высвобождении энергии за счет определенного снижения энергетического уровня многих одинаковых частиц одновременно.
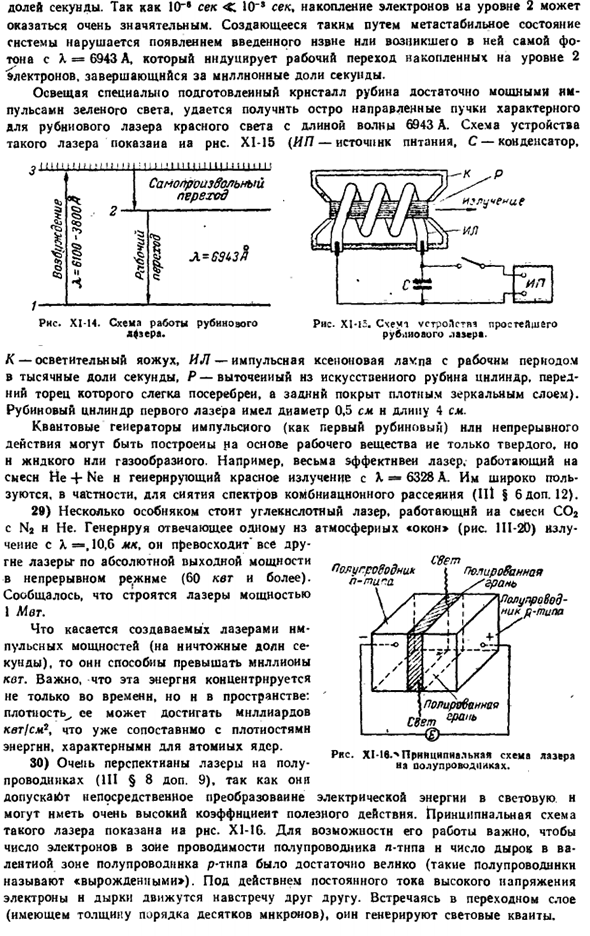
Такие частицы в кристалле рубина состоят из примесей(около 0,05 мас.%CrjOj) — атом трехвалентного хрома. Под воздействием света с длиной волны 6100-3800 л эти атомы возбуждаются от Земли до высокого энергетического уровня (переход 1-3 на рисунке XI — 14), и оттуда электроны сразу же спонтанно переходят на промежуточный уровень 1-2 за время 1 млрд. minutes. An важной особенностью последнего является именно он. Электрон может оставаться на нем относительно долго-1000/1 Дробная часть второго. 10 «* сек <10 »» сек, поэтому накопление электронов на уровне 2 может быть очень большим.
Метастабильное состояние созданной таким образом системы нарушается появлением введенного извне фотона или фотона, генерируемого при R = 6943 а, что вызывает движение электронов, накопленных на уровне 2. Облучая специально подготовленные кристаллы Рубина импульсами достаточно сильного зеленого света, можно получить пучок резко направленного красного света, характерного для рубинового лазера на длине волны 6943 А. На рисунке 6 показана структура таких лазеров. XY5 (IP-мощность, c-конденсатор.
Добровольный переход Фигура Си-И4.Схема работы рубинового бульдозера. Л = 6913Y K-осветительная лампа, IL-импульсная ксеноновая лампа с 1000-секундным временем работы 1 минута, а P-обработанный цилиндр из искусственных рубинов, слегка посеребренный на его переднем конце и покрытый плотным слоем зеркал сзади).Первый лазерный рубиновый цилиндр имел диаметр 0,5 см и длину 4 см.
Квантовый генератор импульсов (как и первый Рубин) или непрерывного действия может быть построен на основе твердого, а также рабочего вещества жидкости или газа. Например, лазер, который работает со смесью he-F Ne и производит красное излучение в X 6328 A, очень эффективен и широко распространен used. In в частности, для регистрации спектров комбинационного рассеяния света (III§ 6 add.12).
29) несколько отличается углекислотный лазер, который работает со смесью CO2 и Na и He. Икс.«=10, г мл, производит излучение, соответствующее одному из атмосферных «окон» (рис.111-20) 1, и превосходит все остальные лазеры с абсолютной мощностью в непрерывном режиме (60 кВт и более). 1 встретил лазера производится. Как для выхода импа Ульс произведенного лазером(очень малым одним на 1 второе), он может превысить миллионы cats.
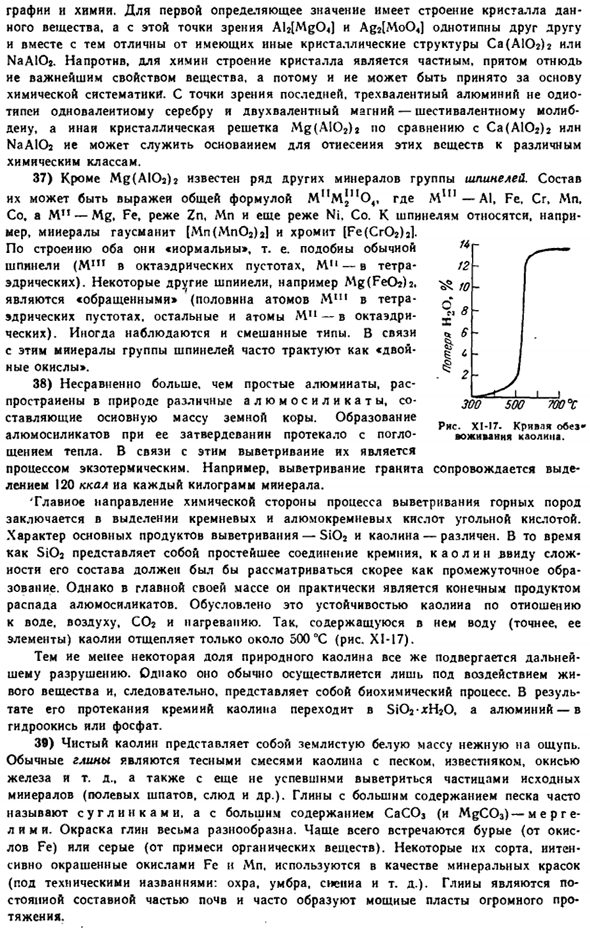
It важно, что эта энергия концентрируется не только во времени, но и в пространстве: плотность se может достигать миллиардов кВт / см*, что сопоставимо с плотностью энергии, которая уже характерна для атомных ядер. 30) полупроводниковые лазеры очень перспективны, поскольку они позволяют осуществлять прямое преобразование электрической энергии в световую и могут достигать очень высокой эффективности(III§ 8 add.9).Схема такого лазера показана на рисунке 1. СИ-ИГ.
В связи с возможностью его работы важно, чтобы число электронов в зоне проводимости полупроводника p-npn и число дырок в валентной зоне полупроводника P-pnp было достаточно большим(такой полупроводник называется «вырожденным»).Под действием постоянного тока высокого напряжения электроны и дырки движутся навстречу друг другу. other. It встречается с переходным слоем (толщиной около нескольких десятков микрон) и производит световой квант.
Рисунок XY2.Самое простое трение устройства Cxeyi. Shoogo. ииупи. «_.»Весь полуфабрикат * * польский p-tega / face LoluproWater-МШ ^ P тип * — о 1 Г / / / Я | * / л \ porio6sinao свет Вт * — Ф.- Диаграмма XI — 16.4 принципиальная схема лазера олупро»в од1мках.» 31) излучательные свойства отдельных квантовых генераторов сильно различаются как по длине генерируемого излучения, так и по мощности пучка. Такой пучок может быть пригоден, например, для операции на глазу или для прожигания отверстия в алмазе.
Многие сферы потенциального практического использования квантовых генераторов уже определены, и их число с каждым годом увеличивается year. In в частности, монохроматическая природа мощного лазерного излучения и уже частично освоенный метод плавного изменения х открывает возможность селективной стимуляции лазером в нужном направлении химического процесса. •
32) изоэлектрическая точка гидроксида алюминия находится вблизи рН = 9,5, а растворимость продукта колеблется от 6 * 10〜м (если он недавно осажден) до 2-10-4.Его кислотная диссоциация (как одноосновная кислота) постоянная равна 4!0 -, 1-и 3-я константы главной диссоциации (по схеме AYUN «* * AR »+ OH’) равны I 10″*. 33) гидроксид алюминия осаждается в процессе нейтрализации кислого раствора при рН = 4,5.
Характер залежи во многом зависит от условий ее формирования. Продукты осаждения из кислых растворов под действием аммиака и холода аморфны и содержат большое количество воды, в то время как осажденные при нагревании(или оставленные в жидкости на длительное время) почти соответствуют составу AljOj-HjO, а рентгенологические исследования указывают на существование кристаллической структуры.
В микрокристаллической структуре присутствуют также осадки состава Al(OH), полученные из щелочных растворов (например, путем насыщения их СО3).Поскольку выделение из щелочного раствора происходит очень медленно, отдельные кристаллы A1 (OH) g могут достигать такого значения, которое можно идентифицировать с помощью микроскопа.
- Кристаллическое превращение гидроксида алюминия в виде минералов диаспоры (NAYU2), b * -mint a [Al (OH)] и gndrargillt (A1 (OH)), образует основу природного боксита. 34) A10 ^за исключением среды pH> 13, где преобладает неион, щелочные алюминатные растворы включают [ACON)^, 1A1(0H) b]», [A1(0H)»] » * ионы и различные полимерные анионы.
При отделении от такого раствора некоторые алюминаты сохраняют состав гидроксо-соли (Sr3 [Al (OH)]] a), которая служит примером, другие подвергаются частичному обезвоживанию. Например, кристаллический алюминат калия характеризуется не K [A1(0H) 4] (т. е. KAlOi-2HsO), а составом 2KAU2-ZNaO. 35) безводный алюмосиликат, полученный сплавлением с aljoj, и соответствующий оксид металла или карбонат получают из NAYU*.
Из упомянутых здесь соединений стоит упомянуть встречающуюся в природе обычную шпинель-Mg (AlOj)»(mp 2115°C). Людмила Фирмаль
36) рентгеноструктурный анализ ее кристалла показал, что единичная решетка шпинели состоит из 8 молекул, то есть соответствует формуле Mg » Ali «0».Атом кислорода образует плотную упаковку, в которой имеется 16 октаэдров и 8 тетраэдрических пустот. Атом алюминия является первым атомом, а атом магния расположен во втором атоме. Определенная группа AJ » неразличима, потому что каждый атом кислорода находится в равноудаленном контакте с 3 атомами алюминия(rf (AlO)= 2.02 A).
Напротив, удельное расстояние MgO»от каждого из 4 атомов кислорода до Удельного атома магния jrf (MgO)^1.75 A]обусловлено тем, что оно меньше, чем у другой группы. Поэтому с кристаллографической точки зрения формулу для шпинели следует записать Al3 [Mg04].Потому что его характерная структура похожа на структуру некоторых типичных солей, таких как Agj(MoO«]). Однако такая трактовка шпинели-как алюминиевой соли предполагаемой магниевой кислоты H «MgO» — явно не соответствует химическим свойствам гидроксида магния. Вот различия в подходе классификации кристаллов ’Ямудксшв Ю. Успех п. * з * и {1972 г. № 6.
Одна тысяча сто одиннадцать、 Графин и химия. Для первых решающее значение имеет кристаллическая структура конкретного вещества, и с этой точки зрения, АИ?(МГО?) И Ag2 (Му? Они похожи друг на друга и в то же время отличаются от Ca (A10bb или NaAIOj), который имеет другой Кристалл structure. As для химии она также может быть основой химических линий, так как кристаллическая структура является специфической, а не важнейшими свойствами вещества.
По сравнению с CA Небесной решетки Mg (A102) J (A10 * H или NaAlOa могут быть основой для классификации этих веществ на различные химические классы. 37) В дополнение к Mg (AIOab известно для много других минералов в группе шпинели. Их состав может быть представлен общей формулой MMM / I04.шпинели включают, например, гауссовский (Mn2) 21 и хромитовый (FefCrOahl.). оба структурно «нормальны». другими словами, нормальная шпинель (8-сторонний m1p, Тетра-граненый). Мг. N атомов, а остальные 8-граненые пустоты (внутри атома M11) и некоторые другие шпинели. также могут наблюдаться смеси. нные type.
In в связи с этим минералы шпинели часто трактуются как «двойные оксиды».»」 38) различные алюмосиликаты, составляющие большую часть земной коры, настолько распространены, что их нельзя сравнить с простыми алюминатами. Образование алюмосиликатов при затвердевании протекало с поглощением heat. In в связи с этим их выветривание является лихорадочным процессом. Например, выветривание гранита сопровождается выделением 1 минерала 120 ккал на килограмм. «
Основным направлением химической стороны процесса выветривания горных пород является разделение Кремниевой и алюмосиликатных кислот угольной кислотой. Природа SiO2 и каолина, основных продуктов выветривания, различна. SiOj является простейшим соединением кремния, но поскольку каолин сложен по своему составу, его следует рассматривать скорее как промежуточный слой.
Однако большая его часть на самом деле является конечным продуктом разложения алюмосиликата. Это связано со стабильностью каолина к воде, воздуху, CO *и нагреванию. Именно поэтому вода, содержащаяся в нем (точнее, ее элементы) каолин режет только около 500°с(рисунок XI-17). Тем не менее, некоторые части природного каолина могут быть дополнительно разрушены. Однако она обычно осуществляется только под воздействием организма. Таким образом, это биохимический process. As в результате этого потока кремниевый каолин становится SiOj-xHjO, а алюминий-гидроксидом или фосфатом.
39) чистый каолин-это землистая белая масса, нежная к коже. Обычный Шнейк представляет собой тесную смесь каолина с песком, известняком, оксидом железа и др., а также с частицами исходного минерала (полевого шпата, слюды и др.), который еще не наделен погодными условиями. Глину с высоким содержанием песка часто называют суглинком, а глину с высоким содержанием CaCOj (и MgC03) называют мерзилом. Цвет глины очень разнообразен. Чаще всего они встречаются коричневые (от оксида железа) или серые (от смеси органических веществ).
Некоторые из их разновидностей сильно пигментированы оксидами Fe и Mn. Используется как минеральная краска (техническое название: охра, Янтарь, Ши и др.).Глина всегда является незаменимой почвой в почве и часто образует очень мощный слой. И затем 12 ^ 10 С О −1 Х G 2 300500 1700°C Рисунок XI-I7.Кривая обоих лук Мия каолин. 40) частицы каолина очень малы и имеют слоистую структуру, поэтому они могут вступать в контакт очень близко друг с другом.
Это связано с его водостойкостью, которая является самым важным свойством глины. Еще одно очень важное свойство глины тесно связано с этим домашним животным. 1.Его пластичность, то есть способность легко приобретать и хранить заданную форму. Большое значение для пластичности глины имеет тот факт, что поверхность частиц каолина гидрофильна. По этой причине при замесе с водой отдельные агрегаты частиц окружены сильно адсорбированной водной оболочкой, что позволяет таким агрегатам легко скользить близко друг к другу.
Высокая адсорбционная активность некоторых глий основана на техническом использовании для отбеливания различных масел. Некоторые глины также обладают высокой каталитической активностью. 41) при контакте с водой агрегаты частиц каолина имеют отрицательный заряд. Добавление небольшого количества щелочи приведет к значительному увеличению заряда за счет дальнейшей адсорбции он ions.
As в результате частицы в блоке отталкиваются друг от друга, и блок разлагается на отдельные частицы. Каждый из них окружен собственной водной оболочкой. Этот процесс сопровождается дополнительным связыванием воды, и при наличии небольшого количества щелочи глина становится заметно «сухой».Как? С другой стороны, ее частицы сильно отталкиваются друг от друга, и такая глина теряет свою пластичность и может быть вылита в форму. Это иногда очень важно.
Относительно низкая пластичность многих природных глин (особенно самой кольнии) обусловлена наличием в них мелких щелочей impurities. In в этих случаях к глии можно добавить небольшое количество слабой кислоты, чтобы значительно повысить ее пластичность. Нейтрализуйте избыток щелочей. Напротив, добавление относительно большого количества щелочи вызывает рассеяние отдельных частиц и агрегатов каолина, а также их прикрепление к более крупным частицам. aggregates.
By а крупное, образование водной оболочки из крупного агрегата потребляет гораздо меньше воды, чем в мелких случаях (и тем более в отдельных частицах), поэтому глина заметно разжижается. Поэтому, если добавить достаточное количество щелочи, счет воды будет намного меньше при перемешивании глины, что очень важно. 42) глина является основным сырьем керамической промышленности.
Так называемая сырая керамика охватывает изготовление материалов и изделий из различных огнеупоров (таких как шамот) и кислотостойких (таких как клинкер), из глины, керамики (готовых изделий), черепицы, тонкой керамики, фаянса и изделий из него. С технической точки зрения глина делится на»жирную»и»постную».Первые содержат относительно большое количество каолина (примесей мало).Они обычно оборудованы с превосходной дуктильностью и высокой огнестойкостью.2-й, наоборот, содержит много impurities.
As как правило, они гораздо менее пластичны и более склонны к плавлению. Глина расплавится, когда она превысит 1650 ° С. спекание начинается значительно ниже температуры плавления (для чистого каолина-1400°С, для обычной глии-низкая температура).в результате полного спекания глинистой массы получается искусственный камень большой прочности, так называемый клинкер.
43) вышеупомянутый шамот является наиболее распространенным огнеупорным материалом. Глиняные кирпичи складывают в печи и укладывают в паровые котлы. Масса шамота обычно включает 50-65% SiOj,45-30-AljOj, 2-CaO. 1.5-MgO и 1.5-Fe5O. 44) процесс изготовления керамики обычно подразделяется на следующие отдельные операции: 1) Очистка глины(всегда). 2) Приготовить исходную смесь из глины и песка, полевого шпата и др., и замесить его с водой.3) формование полученного теста.
4) формовочная сушка. 5) выпечка и 6) покрытие лекарственным средством(всегда).Примеси глины очищаются только тогда, когда требуется исходное сырье высокой чистоты (например、 Он обычно разрыхляет сырую глину, взвешивая ее с водой: частицы, такие как тяжелый песок, быстро падают на дно, а каолиновые взвеси переносятся в отстойник и осаждаются. Состав исходной смеси во многом зависит от вида продукта. Кирпичная масса обычно состоит из смеси немытой глины и большого количества песка, фарфора, керамики, каолина, кварца, полевого шпата и др.
Изделия формуются механическим или ручным способом в керамике. Сушка молдингов осуществляется просто на воздухе или в специальной сушилке. Температура выпечки, в зависимости от вида изделия, обычно колеблется от 900 до 1400 градусов Цельсия. В результате обжига получается твердое пористое вещество и при необходимости глазируется. в состав препаратов гл могут входить различные вещества: мозоли, полевой шпат, кварц, борная кислота, оксиды металлов (особенно Pb и Sn). 。
В этом случае гликозид сливается и образует стекло, которое блокирует поры. Обжиг керамических изделий наиболее экономичен в так называемой туннельной печи (рис. XI-18).Такие печи длинные(50-150 м) ■ «ж’ Т — «’ фии ’в *’ UHWT Н-в * * «Фу * БПФ’ * JfqМЬДand Нью-Йорк № 1» п Отопление * ПБК? j (^рождение Рисунок XI — 18 схема туннельной печи. Узкий канал с нагревательным устройством в центральной части. Рельсы проходят через всю печь, вдоль которой медленно движутся ряды тележек, нагруженных хлебобулочными изделиями (от рисунка XI-18 слева направо).
Воздух, необходимый для сжигания топлива, движется в сторону тележки (от рисунка XI-18 справа налево), которая охлаждает уже воспламененный продукт и нагревает его, еще не вошедший в зону горения. Это позволит более полно использовать heat. In помимо экономичности в плане расхода топлива, туннельная печь характеризуется высокой производительностью. Потому что процесс выпечки осуществляется непрерывно. Керамическое производство является одним из старейших в истории человечества.
Кирпичи производились в Египте более 6000 лет BC. In в древности здесь было гончарное производство (рис. XI-19). (Цзяай 。Я Диаграмма XI-19.Древнеегипетская керамика (2000 г. до н. э. он said. it это не так. 45) при сплавлении каолина с содой и серой (или Na2SO «и углем») получается важная минеральная краска-иламанар. В зависимости от условий получения, могут использоваться различные цвета.
Синий ультрамарин, используемый при изготовлении масляных красок, бумажных красителей и др., является наиболее практичным. Его цвет успешно нейтрализует желтый оттенок, поэтому обычный ультрамарин («синий») используется для изготовления голубого белья, льна, крахмала и т. д. Его состав можно приблизительно представить формулой NarAUSi ^ Oai. Окрашивание вызвано свободной серой или соединениями серы (возможно, ионами Sj), распределенными коллоидно в сплаве.
Ультрамарин устойчив к воздействию воздуха, воды и мыла, но узлы (даже самые слабые) разлагаются с выделением сероводорода, элементарной серы, кремниевой кислоты. 46)в волновой среде, не AI34 ″ непосредственно окружен 6 молекулами воды. Такая неводная сумма не диссоциирует несколько по схеме: (AI (OHs) c] » * * * * * (A1 (ON_ON) — + H \ее константа диссоциации равна 1-10〜*.То есть октаэдрическая среда А6 *, содержащая слабую кислоту (по прочности близкую к уксусной кислоте), также сохраняется в кристаллогидрате многих солей алюминия.
47) некоторые константы галогенида алюминия сравниваются ниже. aif3 AlClj AIBrj Плотность. г / с*…………….. 3.1 2.5 Тепло образования. ккал! Теперь играем:’ GMA ’ сдает и крадет……. 361 I&8 Температура плавления. С………. 1010 191 Температура кипения. С………… 1279 181 При нагревании A1C13 сублимируется, и его температура плавления может быть определена только под давлением. Критическая температура a1c13 составляет 26 Ат. Критическое давление при 353°С.
48) интересный 4-й способ образования фторида алюминия заключается в нагревании до 450°C, а не AljOj с потоком фторида Бора. а (уравнение реакции?: AljOj + 3BF3 ″ =(obf) прогрессирует в соответствии с sf + 2A1F3).Безводный А1Ф3 практически нерастворим не только в воде, но и в жидком фтористом водороде. Водный раствор фторида алюминия, образующийся при взаимодействии HF с A1 (OH) 3, слабо растворим в воде и очень сильно гидролизуется. Кристаллогидрат AIF3-3HjO обычно отделяют водным раствором HF.
49) из продуктов присоединения к фториду алюминия лучше других изучены соединения с фторидом одновалентного металла типа M {A1F»|, MjIAIFj) и преимущественно с Ms [AIFe).Последний из них включает, в частности, природный криолит-Наджаиф). в виде кристаллогидратов H3AIFeGH70 и H3A1F-3H20 выделена соответствующая свободная гексафтораламиновая кислота. 50) Ион[A1F J-тетраэдр (d (AlF) 1. 1.69 A), non(AlFej3〜это октаэдр[d(AtF)■= 1.81 A]).
Непрерывная диссоциация ионов (AlFe) в водных растворах характеризуется следующими константами (25°С и μ » 0,5): LI) 4.0 74 IK 383 3.2 123 98 255 АИФ: АИФ 2 ″ 10〜 АИФ з-ИГ АИФ. A1P、 АиФ’8th * Полная константа диссоциации (константа нестабильности) этих нон равна их произведению. То есть п0*, гр. 51) в случае хлорида алюминия(не его аналогов) характерным поведением изменений проводимости с температурой является characteristic. As это видно из рисунка XI-20.
Ближе к точке плавления проводимость быстро возрастает; когда A1C13 переходит из твердого состояния в жидкое, она падает почти до 7 месяцев. А потом он снова начинает подниматься. При кристаллизации расплава А1С13 наблюдается необычайно резкое уменьшение объема (почти вдвое) и значительное выделение тепла (8,5 ккал / моль).И то, и другое обусловлено переходом хлорида алюминия из его молекулярной структуры (в жидком состоянии) в ионы (в твердом состоянии).
Кристаллизация A1Br3 и AI3 сопровождается относительно небольшим уменьшением объема (уменьшение на 15%) и значительно меньшим выделением тепла (2,7 и 4,0 ккал / моль). 52) плотность пара при относительно низких температурах A1C1$, A1Bg3 и AN3 почти точно соответствует формуле 2-А12Г». при температуре кипения диссоциационная часть составляет 0,02 соответственно. 0,7 и 24%.
Димер по схеме 2A1G3—a ^ GB сопровождается значительным тепловыделением: 29,0 (O), 26,5(W), 22,5 ккал(1).Таким образом, хлоридно более склонны к dimerosis, чем йодид. Он полностью мономерных и только превышает 800 x в. Молекулы AlClj плоская в D(A1CI) −2.06 в Я ГГО * ы 1U0 * 80 Диаграмма XI-20.Схема imeee-me электропроводность AICI3 температура- 53) для теплоты димеризации фторида алюминия в паре при 1000 ° С было найдено значение 49 ккал / моля12фа.
То есть величина, превышающая величину хлорида. Однако давление паров в этих условиях было очень мало (3 мм рт. ст.), и фторид алюминия лишь затемнялся на 1-2%. Молекула A1F3 d (A1F) — = 1.63 A и ZFA1F 120e. Fe непрерывная термическая диссоциация (III§ 5 add.12) требует следующих энергозатрат (ккал / моль): — 156(AIF» — * A1F3 + F), 106(AIFa-«•A1F + F)и 159(A1F AI + F). 54) XI-21, как показано на рисунке.
Пространственная структура молекулы соответствует 2 тетраэдрам с общим краем. Каждый атом алюминия связывается с 4 атомами галогена, в то время как центральный атом галогена связывается с обоими атомами алюминия. Из 2 связей Центрального галогена 1 является донорным акцептором (IX§ 2 add.2).Алюминий действует как акцептор. Оба соединения нельзя отличить друг от друга.
Структура характеризуется следующими параметрами: Airraid)= 2.04 (C1). 2.22(ВГ), 2.53(я); ^ GA1G(.сказал он. A., = 122°(01).118°(Бр).112э(я); 4(A1GCredp)= 2.24 (С1).2.38(БР), В 2.58 A (1); РНС. Х1. 21.Гтп. ZTA1 Hz Utr = » 87°(01).82°(Бр).102°(1).А! Для одиночной молекулы 2G. Числитель размеров (все), значение rf (Atl) = W 2.44 A. очевидно, что он имеет структуру, аналогичную Галогениду алюминия. Re 2cu (VII§ 6add.31).
55) галогенид алюминия (за исключением A1F3) растворим практически во всех органических solvents. In кроме того, определение молекулярной массы в таких растворах дает различные результаты. Таким образом, была найдена простая молекулярная масса A1Br3 в эфире и пиридине. А в CS2-двойной. Это различие связано с тем, что пиридин и эфир значительно более полярны, чем CS2. 56) безводный хлорид алюминия обычно получают нагреванием металла потоком хлора или HCl или пропусканием хлора через смесь AljOj и раскаленного угля.
Соляной кислоты в А1 раствор хлористого водорода в насыщенных по формуле[А1(ОН2) «)С1«(д(АУ)= «= 1.88 А]), соответствующий структуре с бесцветной кристаллизационной воды сольватный АУ3-6Н20 могут быть изолированы. В остатке образуется оксид алюминия, удаляются вода и HCl. Растворимость хлорида алюминия в воде очень высока и практически не изменяется с температурой-от 0°С до 44 г до 100 ° с, степень гидролиза этой соли, определяемая традиционным методом от А1С13 до 49 г на НАО на 100 г, достигает 0,1. 2%solution.
In дело, по-видимому, не только в гидролизе Ио, но и в образовании сложных кислот типа Н-типа[AYU3OH]. 57) в газообразном аммиаке безводный хлорид алюминия образует бесцветный порошкообразный комплекс AIC13-6NH3, а при 180°С лишь частично разрезает NH3. Моноаммония AICI3 * NH3 плавится при 125°C и перегоняется при 422°C почти без разложения. Для константы силовой связи значение k = 2.2 равно obtained.
In помимо аммиака, хлорид алюминия может связывать оксид азота PH3. So], H2S, HCN, другие неорганические молекулы и многие органические вещества. Самым простым примером последнего является Трим стирамип (СН3) 3NA1CU [d (NA1)= 1,96 был получен. д(А1С!) = * 2.12 A]и 2 (CH3) 3N-A1CI3. 2-й комплекс имеет структуру трехгранной пирамиды, в центре которой размещен алюминий (координационное число-5).
В воде все эти дополнительные продукты легко разлагаются. 58) SeCl <AlClj (mp 164°С) можно использовать в качестве примеров соединений типа X * AlClj. TeCU AlCU (mp 149), NOOCIAIC1, mp 180, PC!5A1C13 (mp 379), POC13 A1C13(mp 187).Для последнего из этих веществ была установлена структура 0 — » A1 диоиор-акцептор 結合13роа1с13 со связью. Остальное, по-видимому, является производным тетраэдрического аниона[A1C1″].Типичные соли этой и другой, например, на(Т. Пр. Он также известен как [Д (АККЛ)= 154°С]и [Д (АККЛ) = 2.13 ° с]. К (250). Cs (377), NH «(303)、
И в виде комплекса с диоксаном была выделена соответствующая nm свободная кислота(HAICU).Среди других производных первым из первых является обычная соль типа M (A1C1″b, полученная во многих переходных металлах двухвалентного состояния (V-Ni)) интересным соединением является бесцветный кристалл (Re (CO) e) AlCl4.
200 X и xopouJo растворяет в воде BiCIs + 2BI•+ 3AIC1S = 3biaici4 производные формально одновалентного висмута, которые образуются в 260 куб. см по схеме, на самом деле являются тримером, а атом висмута id (BiBi)= 3.0 A], то есть последний имеет степень окисления, которая равна+1, но равна 3.Это коричневое вещество (mp 253°C) темнеет под воздействием воздуха и становится неравномерным с водой на BiClj и BI.
59) а) исследование продуктов, соответствующих Br3 и AP3, значительно хуже, чем в AL*, но многие из них явно еще более стабильны. Например, он эквивалентен 10 мм рт. ст. Давление PH3 комплекса H * PA1Ge достигает+ 10 ° С (CI), соответственно. 85 (Br) или 93(I).Из отдельных веществ следует отметить H2SAIBr3 (mp 98cC).Для этого структура тетраэдра с атомами алюминия несколько искажена в центре (d (AIBr)=2.34.D (AIS)= » 2.40 A) был установлен.
Дипольный момент этого соединения очень велик (Р = «5.1» в бензоле).Интересно, что в парах A1Br3 сочетается с PBb3 и SbBr3l, но не взаимодействует с Asbbr*. Для Br3SbAlBr3 этано-подобные структуры были обнаружены в d (BrSb)-2.51 и rf (SbAl) −2.52. d (A’. Br)= * 2.30 A. ZBrSbBr96e. ^ BrAlBr110. Примером производной Alls является темно-коричневый Alls-2PI $(mp 130°C).
Для этого, скорее всего, будет структура тригональной пирамиды (число координации алюминия 5).Бесцветный кристалл Lil ’ AbU(mp.220°C) интересно. Очень растворим в бензоле. Исследование такого раствора показывает, что это вещество существует в виде мономеров и не диссоциирует. Его структура еще не была сформирована established. It может соответствовать формуле Li [I3AlIAlh], содержащей Ион G в качестве комплексообразователя. 60) водоросли (G is CI, Br.
I) при нагревании в избытке AsjOj или As2S3 в герметичной трубке (и последующей перегонке aeg3) получали соответственно ОКСОГАЛОГЕНИДЫ OA1G или ТИОГАЛИДЫ алюминия SAIT. Они бесцветны. Очень гигроскопичное вещество, которое легко гидролизуется во влажном воздухе. Их взаимодействие с аммиаком приводит к образованию соответствующих амидных производных OAlNHj и SAlNHj. ОКСОФТОРИДЫ OA1G образовывались в газовой фазе при взаимодействии AIF®и A1203 примерно при 2000°C, но не разделялись.
61) в эфирной среде алюминиевый сплав— Al (N3) 3 цианид— A1 (CN) S и LI [AI (CN)») и U и U комплексные ряды-A1 [A1(NCS) 4].А в ацетонитрильной среде-тиоцианатный комплекс Kj [AI (NCS) e].Все они представляют собой бесцветные вещества, которые разлагаются при хранении, гигроскопичны и легко гидролизуются во влажном воздухе. 62) растворимость в воде сульфата алюминия составляет (г Al2 (SO<) s на 100 г H, 0): Температура°C…………. 0 10 20 30 50100 Непонятно, сколько именно………….. 31.2 33.5 3С.2 40.5 52.2 89.1 ♦ Сульфат алюминия особенно используется для очистки воды.
При добавлении к последнему Al |(SO») 3 и небольшому количеству извести получается коллоидный раствор A1 (OH) 3 first. It затем коагулирует с образованием большого количества студенистого осадка, захватывая частицы и бактерии, взвешенные в воде во время ее образования и перетаскивая их со дна пробы. Очистка воды происходит быстро, поэтому размер отстойника может быть небольшим, но это действительно очень важно.
При обработке жесткой воды добавление извести часто не требуется. Пиролиз безводного Ah(SOa) 3 начинается при 530°C и заканчивается при 860°C (с образованием A1a03).кооперативный диссоциирующий Ион AISO; учитывая K = 2-10 «4. 63) обычно квасцы гораздо менее растворимы, чем отдельные сульфатные компоненты. Когда температура повышается, растворимость в большинстве случаев
Например, он увеличивается очень сильно, как видно из следующих данных о калиево-алюминиевых квасцах (г к (АИ на 100 г воды (SO (SO<) a]): Температура°C…………. 0 / 5 M 60100 Непонятно, сколько именно………….. 3.0 С. 0- 8.4 24.8 154 0,1 и из них. рН раствора-3,2. Калий-алюминиевые квасцы [KAIfSOih * 12НаО] являются наиболее важным представителем этого типа соединений. Для красивых тканей Oii [и Ab (SO<)) используется в качестве протравы, в кожевенной промышленности используется для»белого«дубления кожи.
С бумагой-с клейкой бумагой. Последняя операция особенно необходима для различных типов письма, так как антипригарные (например, фильтровальная бумага или газета) чернила не являются diffused. In в медицине квасцы применяют как наружный констриктор (например, для остановки кровотечения при небольших порезах).
При 93° они растворяются в кристаллической воде, после чего легко обезвоживаются. «Ожоги» (то есть обезвоженные жарой) квасцы иногда используют как средство от потливости ног. 64) AlClj получали ацетат алюминия взаимодействием с уксусным ангидридом [(CH3C0) 20]при 180°C. In в индивидуальных условиях эта соль может существовать только при полном отсутствии воды.
Его водный раствор сильно гидролизуется, что не только легко высвобождает основные соли, но и обладает низкой электропроводностью, свидетельствующей о наличии комплексообразования. Такое комплексообразование ацетилацетоната алюминия-AI (CsH » 02) i (mp.192. mp.315°с) несравненно замечательна.
Средняя энергия его алюминиево-кислородной связи оценивается в 64 ккал / моль. 65) для нитрата алюминия, кристаллическая гидратная А1 (с бортовым номером 03) 3 * 9HjO характерно, и взаимодействие с н, ос дает аддукт А1(с бортовым номером 03) 3 * NjOs. При последующей сублимации получают безводный А1 (N03) 3.Комплексная соль типа M [A1(N03) » |стабильна только в отсутствие влаги и образуется из последней. Растворимость тринитрата алюминия очень высока, от 0°C до 56g до 80 ° C на NAO 100g AI(N03) 3 120g. его перхлорат более растворим-0°при 120 g, A1 (СУ4) 3 при 180 G, 90°с at3030 при 100 g. 66) нормальный фосфат алюминия (A1PO<) интересен тем, что regard.
It повторяет диоксид кремния точно с кристаллической модификацией (x§ 4 Добавление.17).Это связано с одновременностью суммы зарядов A1 * 3P°и Si * 4Sl * 4, Когда радиусы всех 3 элементов равны close. So вы можете думать о a1po < решетка.»1 </(АУ)= 1.74,</(ро) = 1.52 a] в виде решетки диоксида кремния, где половина атомов si * 4 заменена атомами A1°, а другая половина-атомами P + 3.
Таким образом, вещества различных химических классов (оксиды и соли) относятся к одному типу crystallographically. As в случае шпинели (дополнение 35) это указывает на невозможность механического переноса принципа классификации одной науки на другую. Структурные различия между рассматриваемыми веществами проявляются при затвердевании расплава.
Если жидкость SiOj образует стекло легко, то A1PO не получается в стакане State. It кристаллизуется, как только остынет до температуры ниже точки плавления (около 2000 eC).Это, очевидно, связано с ионной природой расплава a1po. 67) сульфид алюминия (AtjS3) доступен непосредственно из элемента. Реакция начинается с нагревания и сопровождается большим выделением тепла(173 ккал / моль).
После очистки сублимацией Al, Sj представляет собой белую иглу (mp 1120°C).Расплавленный A12S3 хорошо растворяет аморфный глинозем и снова высвобождает его при охлаждении. Но уже в виде кристаллов. Когда он светится в воздухе, AI2S3 горит до AB03 и SO2.Когда вода использована, она вполне разложена в Al (OH) j и HjS, и эти можно после этого использовать для того чтобы получить чисто сероводород. 68) хлорид Тиония (SA1C1) получали нагреванием AljSj вместе с избытком AlClj в герметичной камере. tube.
In воздух, это белое твердое тело постепенно изменяется на OA1CI. Известный желтый селен-id алюминий (Алаза), образованный из Элементы со значительной теплотой (130 ккал / моль).для получения селенида водорода удобно использовать взаимодействие с водой. Теплота образования темно-коричневого A12Te3 составляет unknown. In влажный воздух, теллур выделяет водород.
69) порошкообразный алюминий соединяется с азотом при температуре более 800 ° С, и реакция сопровождается значительным выделением тепла (76 ккал / моль A1N).Нитрид алюминия представляет собой белый порошок, который не изменяется при нагревании до 1800°C, а при превышении этой температуры элементы начинают распадаться.
Под давлением азота 4, Айн плавит на 2200°C. It получают нагреванием (N’h4) 3AIFe до 500°C в потоке аммиака. Химическая стойкость нитрида алюминия сильно зависит от компактности sample. In форма сыпучего порошка, он медленно разлагается даже водой[по схеме AIN-fЗН20 = А1 (он) 3+ NH3).Напротив, кристаллический Аин практически не поддается действию кипящей сильной кислоты и лишь медленно разрушается горячим раствором щелочи.
Его кристаллы обладают высокой твердостью и достаточно хорошей теплопроводностью, а по электрическим характеристикам приближаются к полупроводникам. Интересно, что при нагревании алюминия более чем до 1750°C в атмосфере Нью-Джерси, смешанной с CO, вместо синего образуется A1N синего цвета. Наличие небольшого количества кремния дает оптическую способность AIN-фосфора. При нагревании смеси LijN и AlN образуется сероватый двойной нитрид LijAlNj.
70) в техническом масштабе нитрид алюминия может быть получен нагреванием смеси оксида алюминия и угля до 1700 Å в атмосфере азота, в зависимости от реакции: A1aO + ZC + 4-Nj-f 168 ккал = 3CO-f 2A1N. когда a1n ионадо проходит перегретый водяной пар, выделяется аммиак и регенерируется глинозем. Это была ось предлагаемого, но не привитого в действительности метода синтеза аммиака. 71) интересным азотным производным алюминия является Al {N [Si (CH3) 3] 2} 3, с триойльной группой A1N3 на d (AIN)= 1,78 A. это бесцветное кристаллическое вещество сублимируют в вакууме и растворяют в неполярном органическом растворителе.
При энергичном продвижении гидролизного взаимодействия с водой распад связей AI-N происходит быстрее, чем связей N-SI. 72) серый фосфид (A1P) получается взаимодействием элементов при температуре около 500°C. Oi образуется с выделением тепла (29 ккал / моль) и сам по себе стабилен до не менее 1000 СС, но во влажном воздухе медленно разлагается до A1 (OH) 3 и РН*это связано с его использованием в зернохранилищах для обеззараживания зерна * энергия диссоциации молекулы а оценивается в 51 ppm / моль, а ее потенциальный шум составляет 8,4 вольт.
Фосфид алюминия обладает полупроводниковыми свойствами (запрещенная зона 2,5 ЭА). I. Также был получен двойной фосфид состава i3aip2. 73) характеристики полупроводников (ширина запрещенной зоны 2,1 эВ) приведены также в Алас, где тепло, выделяемое из алюминия, составляет 28 ккал / моль. Оранжевые кристаллы стабильны в сухом воздухе, но IA1 (OH) 3 и AsH3 постепенно разлагаются с водой. Двойной мышьяк Li3AIAs2 также известен. 74) oi-это полупроводник, близкий к Si и Ge, поэтому его аналоговые свойства более важны, чем алюминиевый сплав и оксид алюминия (AlSb).Cheap.
It характеризуется в основном проводимостью р-типа с запрещенной зоной 1,52 эВ. Образование этого соединения из элемента происходит с выделением тепла (23 ккал / моль).В сухом воздухе AlSb(mp 1070°С) устойчив, но во влажном воздухе он постепенно разрушается. 75) желтый карбид алюминия (А1 «С3) образуется при нагревании смеси оксида алюминия и угля примерно до 2000°С. реакция образования NS-элементов протекает с выделением тепла (47 ккал / моль).он растворим в жидком алюминии и может быть перекристаллизован из него.
При превышении 2000 ° с карбид алюминия частично разлагается и начинает испаряться(при 2400°С общее давление достигает 1 атм).Разлагают в воде по следующему уравнению: A1 «C3 + 12H20 = 4A1 (OH)3 + ZSI». нагревая металлический алюминий до 500°C с потоком ацетилена, можно получить карбиды (точнее ацетилен) состава A12 (C2) 3.In вода, она разлагается с выделением ацетилена. 76) сплавление A1 ″ C3 и AI2O3 привело к образованию оксоуглеродов алюминия-AljOC (mp 2200°C) и A1404C (mp 1890).И то и другое будет постепенно разлагаться в воздухе.
77) состав борида алюминия-A1Br и A1B. последний образуется в виде прозрачных, сильно преломляющих свет и очень твердых кристаллов за счет перекристаллизации Бора из расплава aluminum. It известен в 2-х формах, структура которых до сих пор точно не установлена. Оба борида не разлагаются в воде и очень устойчивы к воздействию кислот. 78) реакция LiH и 4LiH + AICU™3licl + LiAlH4 полностью обезвоживается взаимодействием с раствором AlClj в эфире и последующим испарением жидкости (отфильтрованной из эфира licl и Lih нерастворимой), lam o-гидрид (в противном случае Alan t) может быть получен литий-Liall.это бесцветное кристаллическое вещество, стабильное при температуре менее 125°С. Но под воздействием воды гниль разлагается с выделением водорода.
Литий-алюминиевый гидрид легко растворим в эфире(0 ° C при 21,3, 25 ° C при 28,3 МАС.% ), Характеризующийся еще более выраженными восстановительными свойствами, чем соответствующий способ (например, восстановление CO до CH30£1). в обеих ситуациях с его помощью можно проводить различные восстановительные реакции органических соединений.
Взаимодействие с lialh AsHj> PH. уменьшение порядка v 83) в эфирном растворе по схеме 3LiAIH4•+■AICU = 3LiCl-f4A1H образуется гидрид алюминия, который постепенно осаждается в виде белой аморфной массы. Последний является сильно полимеризованным продуктом основного состава (зола), но он также содержит связывающий эфир, от которого он не может быть полностью освобожден без потери части водорода.
Структура кристалла (A1H3) P делает связь AI-H-AI d (все!) = 1,72 соответствует трехмерной сети, образованной перемычкой A. при температуре более 100°C гидрид алюминия распадается на элементы и быстро гидролизуется в воде. Есть обзорная статья. 84) возможно, эфирный раствор гидрида алюминия содержит эфиры его monomers. By взаимодействие (CH3) 3N с этим раствором, Кристаллом * Семеменко К. И.. Булычев Б. М.. Shsvlyagina А. Е. ..Достижения в области химии. 1966, М9、 152E,. Состав (CH3) 3NA1H3(mp.76°C) и A1H3•2 (CH$) в (Температура плавления 9°) compounds. It разлагается без разложения в вакууме.
Для первого из этих соединений известны гораздо менее стабильные аналоги фосфора — (СН3) зраш. 2-я структура состоит из атома водорода, центрированного на атоме алюминия ((A1H), равносторонний треугольник до −1.71).Донорно-акцепторная связь связывается с атомом азота 2 молекулы trimethylammonium. So, координационное число алюминия — 5.Возможно, это добавочный продукт к галогенидам алюминия, таким как 2(CH3) 2S * AlBrs (mp 72°С) или 2РОС1з » a1с1з (MP 164).* Имеется обзорная статья о комплексных производных альмотридина. 83) аммиак действует на A1H3 по-другому, чем триметиламин.
При температуре −80°C на Тетрагидрофуране образуется белый, громоздкий осадок HjNAIHj. Это уже будет около-30 * С с удалением водорода и вводом H2NA1H2. HNAIH при комнатной температуре, наконец, A в примерно 150°C. «» 86) взаимодействие между A1H3 в эфирной среде и галогенидом алюминия образует смешанный гидрид с a2p2g и A1NG2 в эфирной среде. composition. In отдельные государства, они, вероятно, существуют как dnmers. A1H3 * A1C13 (т. е. A1H2C1 * L1NS12) выделяли из производных хлора и брома. L1PVg2 и A1H2Vg, бесцветная жидкость.
Первое соединение Java перегоняют без разложения под высоким вакуумом, последнее разлагается при температуре более 35°C на A1IVg2 и A1H3.Соответствующие йодиды являются AlHIj (mp 80°C) и L1H21(mp 35) в нормальных тяжелых условиях. Раствор эфира влаги всех этих алюминиевых гидрогаррандов стабилен. 87) при взаимодействии гидрида алюминия с добораном образуется a |(ВН»b (§i PostScript 103)).Наиболее летучим соединением алюминия является боранат-давление паров составляет уже 0 ° C при 120 мм рт. ст. Согласно схеме, 3NaBH < — falkb = 3NaCl + A1 (HV») I самовоспламеняется в воздухе.
Алюминиевый лечении рака мочевого пузыря считается перспективным горючим реактивного топлива. (Ч), нал(ЧД ч ч [д(Най)= 2.01 а]. 88) при температуре около 800°с одновалентное состояние алюминия является несколько стабильным соответствующее соединение частично образуется при высоких температурах за счет обратимой реакции A1Gz 4-2a1 z = * ZA1G или A1gEz + 4A1 **** ZA12E (здесь E-O. S. Se), но в низком положении не может существовать. Стандарт элемента А1Ф НС (вызванного 25 КС) жара образования 61.А1С1-15 и А1бг-1 ккал! Моль. Для молекул l120 приведены структурные параметры d (АУ)= 1.66 A и zaioai = 145°.
Для производных одновалентного алюминия существует обзорная статья и специальная монография*##. 89) A1F был изучен гораздо лучше, чем другие соединения одновалентного алюминия, образование которых выражается примерно при 1000°с формулой: A1F3(t) — f 2A1(g)-f F5 ккал 3AIF®.Давление пара A1F составляет 5 мм рт. Ст. 1015 ® С и 100 мм рт ст. При 1075°C, то есть, он будет намного более волатильным, чем AIF $(даже больше, чем A1).
Молекула A1F характеризуется ядерным расстоянием 1,65 а и малой полярностью (q 1,5).Энергия диссоциации атома составляет 159 ккал / моль. 90) смесь равновесия и температуры выше может быть использована для очистки алюминия. Высокотемпературное взаимодействие между AlFj и исходным металлом дает AIF. It разлагается в холодной зоне и выделяет более чистые металлы. Этот процесс является типичной транспортной реакцией (IX§ I добавление.
43).Повторите несколько раз, чистота составляет 7 девяток (II§ 6 мил.10) вы смогли получить алюминий. Управление чистотой 、 АЛП Алпатова Н. м.. Дымова т. п. .. к ней » Л. Ю. М. .. Осипов О. Р.. Достижения в области химии. М. 2.21. * * M ak * G и r J. P. успехи в химии. 1953,. > 4•>Ъ ъ * * Бел Беляев А. И.. Фирсанова Л. А. алюминий в Металлургическом процессе Одчовплмтня. М.. Металлургдздат. I960. 142 страницы Три-сопротивление образца (температура жидкого гелия), которое линейно зависит от содержания примесей. 91) алюминий с нулевой степенью окисления представляет собой дипирильное производное-А1 (ДИПИ) 3.Алюминий со степенью окисления −1 известен также в виде комплекса С дигидропромом Li LiAI (CbH7N) 4l.
Смотрите также:
| Третья группа периодической системы | Физико-химический анализ |
| Бор | Подгруппа галлия |
